急性胆道梗阻大鼠肝脏iNOS的表达及意义
张西波,段启龙,李忠廉,刘军舰,尚海涛,郝成飞,张鸿涛,鲍建亨
(1天津市南开医院,天津300100;2山东医学高等专科学校)
阻塞性黄疸可以通过多种机制造成肝细胞损伤,研究其肝损害机制,对如何保护及改善肝功能具有重要意义。诱导型一氧化氮合酶(iNOS)主要分布在肝细胞、巨噬细胞、Kupffer细胞中,在各种刺激因子作用下iNOS表达合成NO,发挥生物学作用,参与机体许多病理生理过程[1~4]。2012年3月 ~2012年12月,本实验通过对胆道梗阻大鼠肝脏的iNOS表达的检测,探讨阻塞性黄疸肝损伤的机制。
1 资料与方法
1.1 实验动物分组 选择成年雄性SD大鼠60只,体质量250~300 g,由天津市中西医结合急腹症研究所动物研究中心提供。随机分为假手术对照组(S组)30只和阻塞性黄疸组(OJ组)30只。
1.2 动物模型制备 术前24 h禁食水,麻醉后消毒手术区,上腹正中切口入腹。OJ组开腹后于胆总管中上1/3行胆总管双重结扎;S组开腹后只暴露肝门,游离上段胆总管后关腹。
1.3 标本采集、观察及检测 两组在术后第1、3、7、10、14天每时相点处死大鼠6只,经腹主动脉抽血约4 mL,离心后冷藏。之后迅速切取肝组织,一部分置于-80℃中保存,另一部分用多聚甲醛固定保存。观察动物一般情况,包括动物精神状态、毛色、饮食状况及手术开腹所见,光镜观察肝组织的病理改变。采用苏—赖氏法测定ALT、AST的水平;苯甲酸钠—咖啡因比色法测定血清总胆红素(TB)的水平;RT-PCR检测肝组织iNOS mRNA的表达;免疫组化检测肝组织iNOS蛋白的表达
1.4 统计学方法 采用SPSS17.0统计学软件,计量资料以¯x±s表示,组间比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 两组大鼠一般情况 S组术后第1天基本恢复正常,眼球、双耳、爪及皮毛颜色无改变,行动敏捷,对疼痛刺激反应灵敏,食欲良好、尿液正常;解剖大鼠,可见腹腔黏膜颜色正常,原手术区轻度粘连,余未见异常。OJ组术后第1天起尿呈逐渐加深,第3天起眼球、双耳、尾、爪开始变黄,精神、食欲变差,体质量下降,睡眠增多,尿色黄褐色,大便呈陶土色;术后1周左右可见全身皮毛明显黄染,术后2周黄疸持续存在;解剖大鼠见腹腔黏膜及脏器黄染明显,手术区粘连严重,部分大鼠有腹水,胆总管扩张明显。
2.2 两组光镜下肝组织病理改变 S组肝细胞无肿胀、坏死,肝细胞索排列整齐。OJ组术后第1天见少量嗜中性粒细胞和淋巴细胞浸润;术后第3天可见新增生的细小胆管和无管腔的小胆管,嗜中性粒细胞和淋巴细胞浸润较术后第1天明显增加,肝细胞轻度变性,可见灶状和片状坏死,肝组织汇管区可见胆管增生和纤维组织细胞增生,偶见胆管扩张;术后第7天肝细胞出现变性坏死发生率增加及程度加重,重者见片状出血和坏死,肝门区组织可见胆管增生和纤维细胞增生;术后14 d小叶结构受到破坏,可见肝细胞空泡变性及坏死。随着梗阻时间延长,肝组织病理改变逐渐加重。
2.3 两组各时点血清ALT、AST、TB水平变化 术后S组ALT、AST、TB增高不明显,各时点比较无统计学意义(P >0.05)。OJ组术后 ALT、AST、TB 增高明显,各时点与S组比较差异有统计学意义(P均<0.05)。见表1。
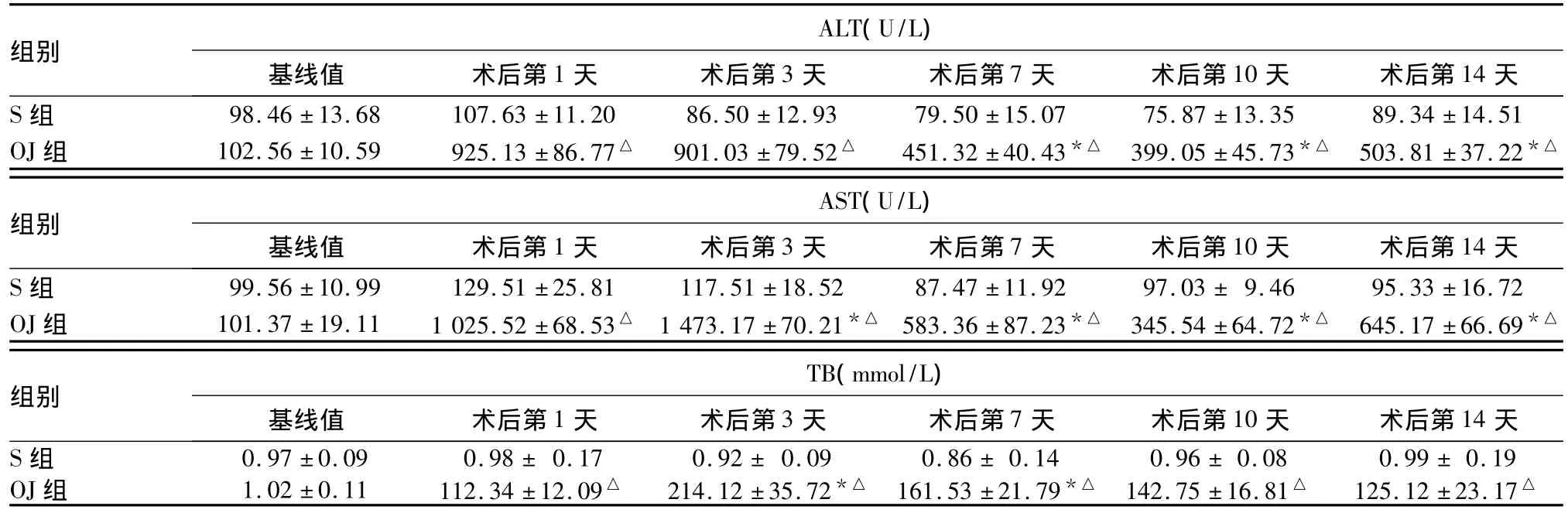
表1 两组各时点血清ALT、AST、TB水平比较 (n=6,¯x±s)
2.4 两组各时点肝组织iNOS mRNA、蛋白表达变化 S组术后iNOSmRNA、蛋白表达变化不明显,各时点比较无统计学意义(P>0.05);OJ组术后iNOS mRNA、蛋白表达增高明显,各时点与S组比较差异有统计学意义(P均<0.05)。见表2。
3 讨论
3.1 阻塞性黄疸时iNOS影响NO水平变化的机制
阻塞性黄疸发病早期,NO少量合成,体内NO浓度较低。梗阻进一步加重时,iNOS在许多病理因素(炎症反应、自身免疫反应等)作用下得到活化,产生大量的NO,参与中性粒细胞、淋巴细胞和巨噬细胞的细胞毒性作用[5]。炎症介质如内毒素、LPS、IFN-γ、IL和 TNF等是 iNOS活化的驱动因子。机体免疫系统受到这些驱动因子的活化,传递给巨噬细胞核,导致 iNOS活化,释放大量 NO,iNOS活性可持续达20 h,较 cNOS合成的NO浓度高1 000倍[6],是引起体内NO过量产生的主要基础。一般认为在阻塞性黄疸时,胆汁不能进入肠道而反流进入血液,引起高胆汁酸血症,使肠道内细菌大量繁殖,内毒素释放增多、灭活减少。同时肠道发生病理改变,黏膜下层炎性水肿,上皮细胞变性、坏死、脱落,线粒体肿胀、内质网扩张,肠黏膜屏障功能和免疫功能严重受损。黏附在肠黏膜上皮的细菌发生移位,大量的内毒素进入血循环,产生严重的内毒素血症。内毒素血症时肝脏Kupffer细胞吞噬活性被抑制,但Kupffer细胞分泌功能明显亢进,释放出过量的TNF、IL-1等炎性因子,这些炎性因子与内毒素协同作用于肝组织而诱导iNOS的产生[7]。因此,可以认为阻塞性黄疸时血清和肝组织中NO水平增高主要是由于iNOS基因活化产生过量的NO所致。本研究发现,阻塞性黄疸组在梗阻发生初期肝组织iNOSmRNA表达升高缓慢,与之相对应的假手术组则维持在低水平;梗阻7 d以后,黄疸组肝组织中iNOSmRNA表达迅速升高,与假手术组差异进一步加大。iNOS蛋白表达水平的变化也呈现同样趋势。因此,阻塞性黄疸时各种炎性细胞因子诱导肝脏内iNOSmRNA表达,并产生 iNOS蛋白,使肝脏产生NO增多。
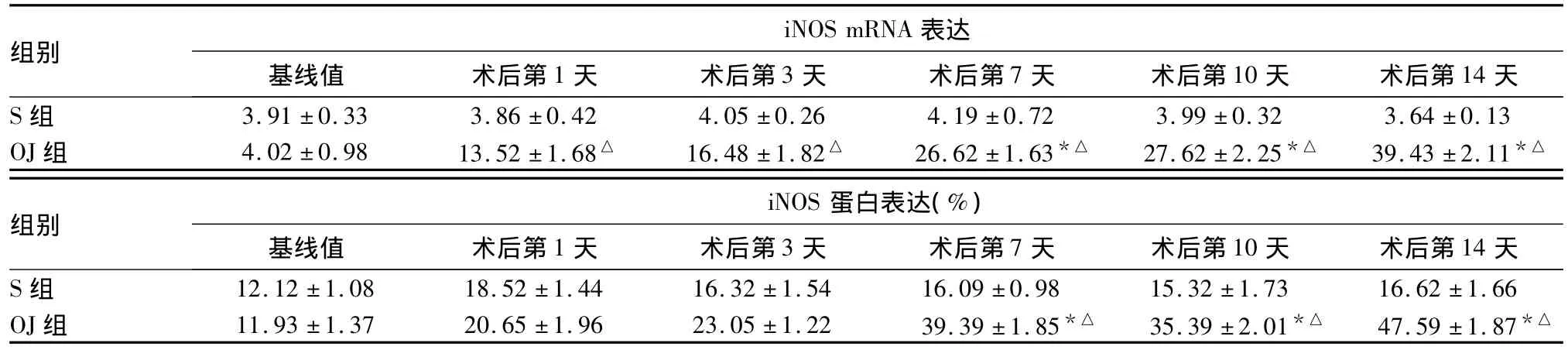
表2 两组各时点肝组织iNOS mRNA、蛋白表达比较(n=6,¯x±s)
3.2 阻塞性黄疸时iNOS表达变化对肝功能及肝组织的影响 阻塞性黄疸可导致机体各系统器官的损害以及相应的病理生理改变[8,9],增高的NO对机体的作用评价目前还很不一致[10,11]。本研究结果显示,阻塞性黄疸时,黄疸组在最初3 d随着梗阻时间的延长血清ALT、TB值逐渐升高;光镜下见肝脏组织病理学改变逐渐加重,此时iNOS mRNA、iNOS蛋白表达较假手术组表达增多,但增长速度相对缓慢,肝组织NO水平缓慢增高。梗阻后3 d开始,随着iNOS mRNA、iNOS蛋白表达增多,NO水平持续增高,血清ALT、TBIL值反而相对下降,光镜下见肝脏组织病理学改变减轻。表明梗阻形成初期NO水平增高能减少肝脏酶的释放和减轻肝脏的病理改变,对肝脏有保护作用[12]。梗阻7 d以后黄疸组iNOS表达明显升高,14 d时达到最大值,NO水平增高明显,血清 ALT值重新升高,光镜下见肝脏组织病理学改变进行性加重。表明梗阻形成晚期NO水平极度升高可加重肝脏酶的释放和肝脏的病理改变,对肝脏有损伤作用。目前认为,NO在阻塞性黄疸肝损伤起损害作用的原因是:①内毒素血症刺激,使Kupffer细胞、肝细胞、肝窦内皮细胞内iNOS转录表达而合成大量的具有细胞毒性的内源性NO。②阻塞性黄疸时大量合成释放的NO与超氧阴离子作用形成过氧亚硝酸阴离子及其分解产物羟自由基,可通过诱导巯基氧化及与肝细胞膜不饱和脂肪酸结合形成过氧化脂质造成脂质过氧化损害等对肝细胞产生损害作用。③阻塞性黄疸时引起的肝脏血管短路形成,使流经肝窦的血流量减少,肝细胞处于缺血、缺氧状态,而此时的内毒素血症又可刺激血管上的iNOS表达,生成的NO通过调节离子通道,使血管平滑肌舒张,造成流经肝窦的血流量进一步减少,加重肝细胞缺血、缺氧状态。④可引起肝细胞线粒体损伤,影响肝细胞能量代谢。⑤大量的NO可介导肝细胞凋亡和直接引起肝细胞死亡,从而造成肝损害。
因此,NO在阻塞性黄疸肝损害中具有双重作用。在发病早期或NO少量合成时,NO可扩张血管,改善肝脏功能。随着疾病的发展,各种刺激因子引起iNOS表达增加,生成大量的NO,过量的NO具有细胞毒性,对阻塞性黄疸肝脏起损害作用。
[1]Salykina MA,Sorokina EG.Effects of selective inhibitors of neuronal and inducible no-synthase on ATP content and survival of cultured rat cerebellar neurons during hyperstimulation of glutamate receptors.[J].Bull Exp Biol Med,2013,155(1):40-43.
[2]Hwang SY,Hwang JS,Kim SY,et al.Glucosamine inhibits lipopolysaccharide-stimulated inducible nitric oxide synthase induction by inhibiting expression of NF-kappaB/Rel proteins at the mRNA and protein levels[J].Nitric Oxide,2013,31(2):1-8.
[3]邱江锋,吴志勇,张志奇,等.iNOS基因治疗肝硬化门静脉高压症的实验研究[J].中华外科杂志,2004,42(7):428-431.
[4]Ljungdahl M,Osterberg J,Ransj U,et al.Inflammatory response in patients with malignant obstructive jaundice[J].Scand JGastroenterol,2007,42(1):94-102.
[5]Hoang T,Choi DK,Nagai M,et al.Neuronal NOSand cyclooxygenase-2 contribute to DNA damage in a mouse model of Parkinson disease[J].Free Radic Biol Med,2009,47(7):1049-1056.
[6]Kang CH,Jayasooriya RG,Choi YH,et al.β-Ionone attenuates LPS-induced pro-inflammatory mediators such as NO,PGE2 and TNF-α in BV2 microglial cells via suppression of the NF-κB and MAPK pathway[J].Toxicol In Vitro,2013,27(2):782-787.
[7]Harbrecht BG,Billar TR,Stadler J,et al.Inhibition of nitric oxide synthesis during endotoxemia promotes intrahepaticthrombosis and an oxygen radical-mediated hepatic injury[J].J Leukoc Biol,1992,52(4):390-394.
[8]Hong JY,F Sato E,Nishikawa T,et al.Effect of obstructive jaundice and nitric oxide on the profiles of intestinal bacterial flora in wild and iNOSmice[J].JClin Biochem Nutr,2009,44(2):160-167.
[9]Caˇglikülekci M,Pata C,Apa DD,et al.The effect of N-acetylcysteine(NAC)on liver and renal tissue inducible nitric oxide synthase(iNOS)and tissue lipid peroxidation in obstructive jaundice stimulated by lipopolysaccharide(LPS)[J].Pharmacol Res,2004,49(3):227-238.
[10]Jiang H,Verovski VN,Leonard W,et al.Hepatocytes determine the hypoxic microenvironment and radiosensitivity of colorectal cancer cells through production of nitric oxide that targets mitochondrial respiration[J].Int J Radiat Oncol Biol Phys,2013,85(3):820-827.
[11]李小刚,刘青光,潘承恩,等.丹参注射液对梗阻性黄疸肝内NO、MDA、ET的影响及其意义[J].西安医科大学学报,2002,23(2):158-161.
[12] Kadiiska MB,Bonini MG,Ruggiero C,et al.Thiazolidinedione treatment decreases oxidative stress in spontaneously hypertensive heart failure rats through attenuation of inducible nitric oxide synthase-mediated lipid radical formation[J].Diabetes,2012,61(3):586-596.

