葛根素对急性乙醇中毒大鼠脑内阿片肽和多巴胺的调控作用
崔淑芹
(德州学院医学系,山东 德州 253023)
葛根素对急性乙醇中毒大鼠脑内阿片肽和多巴胺的调控作用
崔淑芹
(德州学院医学系,山东 德州 253023)
目的:检测葛根素对急性乙醇中毒大鼠皮层、小脑、海马和纹状体内阿片肽和多巴胺(DA)表达水平的调控作用,为临床防治乙醇中毒和开发中药葛根提供依据。方法:雄性SD大鼠24只随机分为对照组、乙醇中毒组和葛根素组,每组8只,采用放射免疫法检测各组大鼠皮层、小脑、海马和纹状体内β-内啡肽(β-EP)、强啡肽(DnyA)和亮脑啡肽(L-EK)表达水平,采用高效液相色谱法检测各组大鼠各脑区DA、多巴克(DOPAC)和高香草酸(HVA)的表达水平,并计算(DOPAC+HVA)/DA的比值。结果:与对照组比较,乙醇中毒组和葛根素组大鼠皮层内β-EP、DnyA和L-EK表达水平降低(P<0.01),皮层、小脑、海马和纹状体内DA、DOPAC和HVA表达水平均升高 (P<0.01);与乙醇中毒组比较,葛根素组大鼠皮层内β-EP、DnyA和L-EK表达水平升高(P<0.05,P<0.01),DA(P<0.01)、DOPAC(P<0.01)和 HVA表达水平均降低,小脑、海马和纹状体内所有指标表达水平均降低(P<0.05,P<0.01),皮层、小脑和海马内(DOPAC+HVA)/DA比值升高,纹状体内该比值降低(P>0.05)。结论:葛根素对急性乙醇中毒造成的脑组织损伤有保护作用,其机制可能与葛根素对脑内阿片肽和DA的调控有关。
葛根素;急性乙醇中毒;阿片肽;多巴胺
急性乙醇中毒是临床常见病,患者因短时间内摄入过量乙醇而表现为自控能力差、兴奋、运动失调、短暂性记忆缺失、痛觉迟钝和精神症状等,重者可导致昏迷或死亡。现代研究[1]认为:急性乙醇中毒的系列症状与脑内多种神经递质的改变有关,脑内内源性阿片肽和多巴胺(dopamine,DA)等神经递质的变化可能是导致这些症状产生的重要原因之一。目前关于乙醇中毒对脑内阿片肽和DA影响的研究越来越深入。Jarjour等[2]研究显示:急性乙醇摄入有促使内源性阿片肽释放的作用,也有学者[3-4]报道了乙醇中毒时脑内阿片受体的变化和阿片受体拮抗剂对急性乙醇中毒的作用;研究者[5-6]通过对脑组织的电生理观察初步证实了乙醇摄入后多巴胺能神经元对运动兴奋的重要作用,阐明了DA与乙醇中毒临床症状的关系。在我国葛根用于解酒已有4千多年的历史,中药解酒研究中以解酒保肝研究[7]较多,葛根素对乙醇中毒所致的脑组织内源性阿片肽和DA的调控作用尚未见系统研究。鉴于内源性阿片肽和DA在脑内分布较广,本研究在前期关于葛根素对急性乙醇中毒脑内氧自由基和行为学干预研究[8]的基础上,通过观察葛根素对急性乙醇中毒大鼠模型多个脑区内源性阿片肽,即β-内 啡 肽 (β-endorphin,β-EP)、 强 啡 肽(dynorphin,DnyA)和亮脑啡肽(Leu-enkaphalin,L-EK)及DA等水平的影响,进一步探讨葛根素对乙醇中毒大鼠脑内内源性阿片肽及DA的调控作用,旨在降低乙醇对机体的损害,为临床防治急性乙醇中毒和开发中药葛根作为解酒药物提供实验基础。
1 材料与方法
1.1 实验动物与主要试剂 雄性SD大鼠24只,体质量为(200±20)g(山东鲁抗医药股份有限公司),动物合格证号:SCXK鲁20080002。56%白酒(北京怀柔红星股份有限公司),2%注射用葛根素(山东瑞阳制药有限公司),β-EP、DnyA 和L-EK放射免疫试剂盒 (第二军医大学神经生物学教研室),高香草酸(HVA)、3,4二羟苯乙酸(DOPAC)和DA均购于美国Sigma公司。
1.2 急性乙醇中毒大鼠模型的建立 健康雄性SD大鼠适应性饲养1周后,用56%白酒按15g·kg-1灌胃,于60min后将大鼠断头取血,采用顶针空气色谱法(HPGC)检测,将大鼠全血标本中乙醇浓度为1.25g·L-1作为造模成功的评价标准。
1.3 实验分组及给药方法 24只SD大鼠随机分为对照组、乙醇中毒组和葛根素组,每组8只。乙醇中毒组大鼠给予56%白酒,按15g·kg-1剂量灌胃;葛根素组大鼠给予56%白酒,按15g·kg-1灌胃,同时给予葛根素200mg·kg-1腹腔注射。对照组大鼠给予与乙醇等容量的生理盐水灌胃,对照组和乙醇中毒组大鼠用与葛根素等容量的生理盐水腹腔注射。
1.4 大鼠脑组织内各项指标的检测 采用放射免疫法检测大鼠脑组织内阿片肽水平:给药90min后,断头处死大鼠,立即取下大鼠右半脑,在沸腾的生理盐水中煮5min,分离皮层、海马、纹状体和小脑,准确称质量后,分别置于玻璃匀浆管内,加入1mol·L-1醋酸1mL,充分匀浆后转入到塑料 试 管 中,室 温 放 置 100min。4℃、4 000r·min-1离心20min,取上清加入1mol·L-1NaOH 1mL用来中和酸,按照试剂盒说明书操作方法检测β-EP、DnyA和L-EK水平。采用高效液相色谱(HPLC)法检测大鼠脑组织内DA水平:给药90min后,断头处死大鼠,立即取下大鼠左半脑,冰上分离皮层、海马、纹状体和小脑,放入1.5mL EP管中准确称质量,加入200μL冰冷样品预处理A液,冰浴超声10s(0.5Hz,振动1s,间歇1s,重复4~5次)。避光,冰浴静置1h后,4℃、12 000r·min-1离心20min。定量吸取上清液160μL,加入半量上清液体积的样品预处理B液(80μL),漩涡混匀。冰浴静置1h后,4℃、12 000r·min-1离心20min。吸取上清液200μL,经过0.22μm的一次性滤器过滤后,加样检测。根据HPLC结果,计算DA、DOPAC和HVA的表达水平及(DOPAC+HVA)/DA比值。
1.5 统计学分析 应用SPSS 11.5统计软件进行统计分析,β-EP、DnyA、L-EK、DA、DOPAC和HVA表达水平以±s表示,组间比较采用单因素方差分析。
2 结 果
2.1 大鼠皮层、小脑、海马和纹状体内β-EP、DnyA和L-EK的表达水平 与对照组比较,乙醇中毒组大鼠皮层内β-EP、DnyA和L-EK表达水平降低(P<0.01),小脑、海马和纹状体内β-EP、DnyA和L-EK表达水平明显升高 (P<0.05,P<0.01);与乙醇中毒组比较,葛根素组大鼠皮层内β-EP、DnyA和 L-EK 表达水平明显升高(P<0.05,P<0.01),其余各脑区内β-EP、DnyA 和L-EK表达水平均明显降低(P<0.05,P<0.01)。见表1。
表1 各组大鼠脑组织内β-EP、DnyA和L-EK的表达水平Tab.1 The expression levels ofβ-EP,Dny and L-EK in brain tissues of the rats in various groups[n=8,±s,wB/(pg·g-1)]
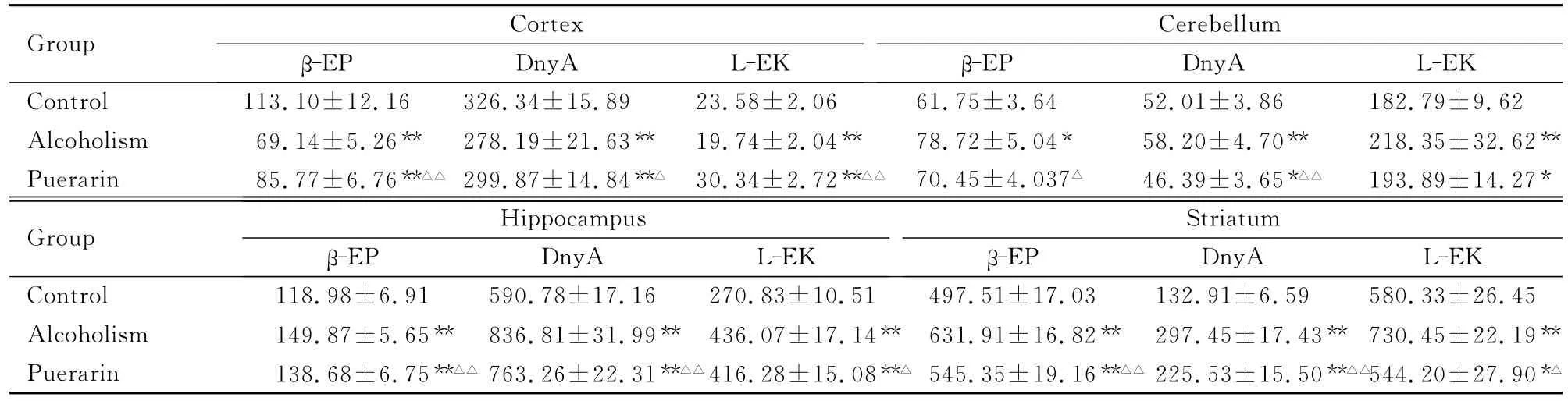
表1 各组大鼠脑组织内β-EP、DnyA和L-EK的表达水平Tab.1 The expression levels ofβ-EP,Dny and L-EK in brain tissues of the rats in various groups[n=8,±s,wB/(pg·g-1)]
*P<0.05,**P<0.01compared with control group;△P<0.05,△△P<0.01compared with alcoholism group.
06 61.75±3.64 52.01±3.86 182.79±9.62 Alcoholism 69.14±5.26** 278.19±21.63** 19.74±2.04** 78.72±5.04* 58.20±4.70** 218.35±32.62**Puerarin 85.77±6.76**△△ 299.87±14.84**△ 30.34±2.72**△△ 70.45±4.037△ 46.39±3.65*△△ 193.89±14.27*Group Hippocampus β-EP Dny A L-EK Control 113.10±12.16 326.34±15.89 23.58±2.Group Cortex β-EP DnyA L-EK Cerebellum β-EP Dny.51 497.51±17.03 132.91±6.59 580.33±26.45 Alcoholism 149.87±5.65** 836.81±31.99** 436.07±17.14** 631.91±16.82** 297.45±17.43** 730.45±22.19**Puerarin 138.68±6.75**△△ 763.26±22.31**△△416.28±15.08**△ 545.35±19.16**△△ 225.53±15.50**△△544.20±27.90*A L-EK Control 118.98±6.91 590.78±17.16 270.83±10 A L-EK Striatum β-EP Dny△
2.2 大鼠脑组织皮层、小脑、海马和纹状体内DA、DOPAC和HVA的表达水平 与对照组比较,乙醇中毒组大鼠皮层、小脑、海马和纹状体内DA、DOPAC和 HVA表达水平升高 (P<0.05,P<0.01);与乙醇中毒组比较,葛根素组大鼠小脑内DOPAC表达水平升高 (P>0.05),小脑内DA、HVA及其他脑区DA、DOPAC和HVA表达水平均降低 (P<0.05,P<0.01)。与对照组比较,乙醇中毒性组和葛根素组大鼠各脑区(DOPAC+HVA)/DA比值升高;与乙醇中毒组比较,葛根素组大鼠皮层、小脑、海马内(DOPAC+HVA)/DA比值升高,纹状体内该比值降低,但差异均无统计学意义 (P>0.05)。见表2。
3 讨 论
内源性阿片肽是一种神经活性物质,广泛存在于脑的多个部位,有激素和神经递质的功能,对中枢神经系统和外周器官均起作用[9]。阿片肽主要分为五大家族:脑啡肽、内啡肽、强啡肽、孤啡肽和内吗啡肽,目前研究较多的是脑啡肽、内啡肽和强啡肽。传统观点认为:阿片系统主要涉及到成瘾物质如酒精、吗啡的强化和奖赏效应。但是关于阿片类药物成瘾和脱毒的研究[10]发现:阿片系统也参与了学习记忆及运动的协调等,阿片肽含量的异常可影响中枢神经系统的结构和功能。Davis等[11]首次提出乙醇对中枢神经系统的损害可能是通过内源性阿片类物质介导的这一理论,也有研究认为甲啡肽可以抑制神经细胞生长。Sarkar等[12]通过胚胎鼠的细胞培养初步证实了乙醇可导致中枢β-EP神经元凋亡;有研究[13]表明:急性乙醇摄入可以增加大脑某些区域内啡肽和脑啡肽基因的表达,促进脑和垂体释放内源性阿片肽。
脑内DA是调节躯体运动、睡眠、精神活动和精神依赖的重要神经递质,DA含量异常可导致多种运动、精神系统疾病的产生。DOPAC是DA代谢的中间产物,而HVA则是DA代谢的终产物,所以, (DOPAC+HVA)/DA可反映神经元内DA的代谢情况。乙醇对脑内DA系统的影响可能因剂量的不同和鼠龄的不同而表现出不同效果。韦丰等[14]通过对成年鼠的研究发现:一定量的乙醇对DA系统有明显的兴奋作用,大脑中富含DA区域的神经元兴奋性增强,伴随精神运动性兴奋等表现。Shabanov等[15]发现:孕鼠接触乙醇后,胎鼠脑内DA含量减少,多巴胺能神经系统活性的降低。Oswald等[13]研究发现:内源性阿片系统对乙醇的强化与奖赏效应可能是导致乙醇依赖和滥用的机制之一,并阐明了这种奖赏效应与中脑多巴胺系统奖赏通路的密切关联性。
表2 各组大鼠脑组织内DA、DOPAC和HVA表达水平及(DOPAC+HVA)/DA比值Tab.2 The expression levels of DA,DOPAC,HVA and(DOPAC+HVA)/DA ratios in brain tissues of the rats in various groups (n=8,±s)
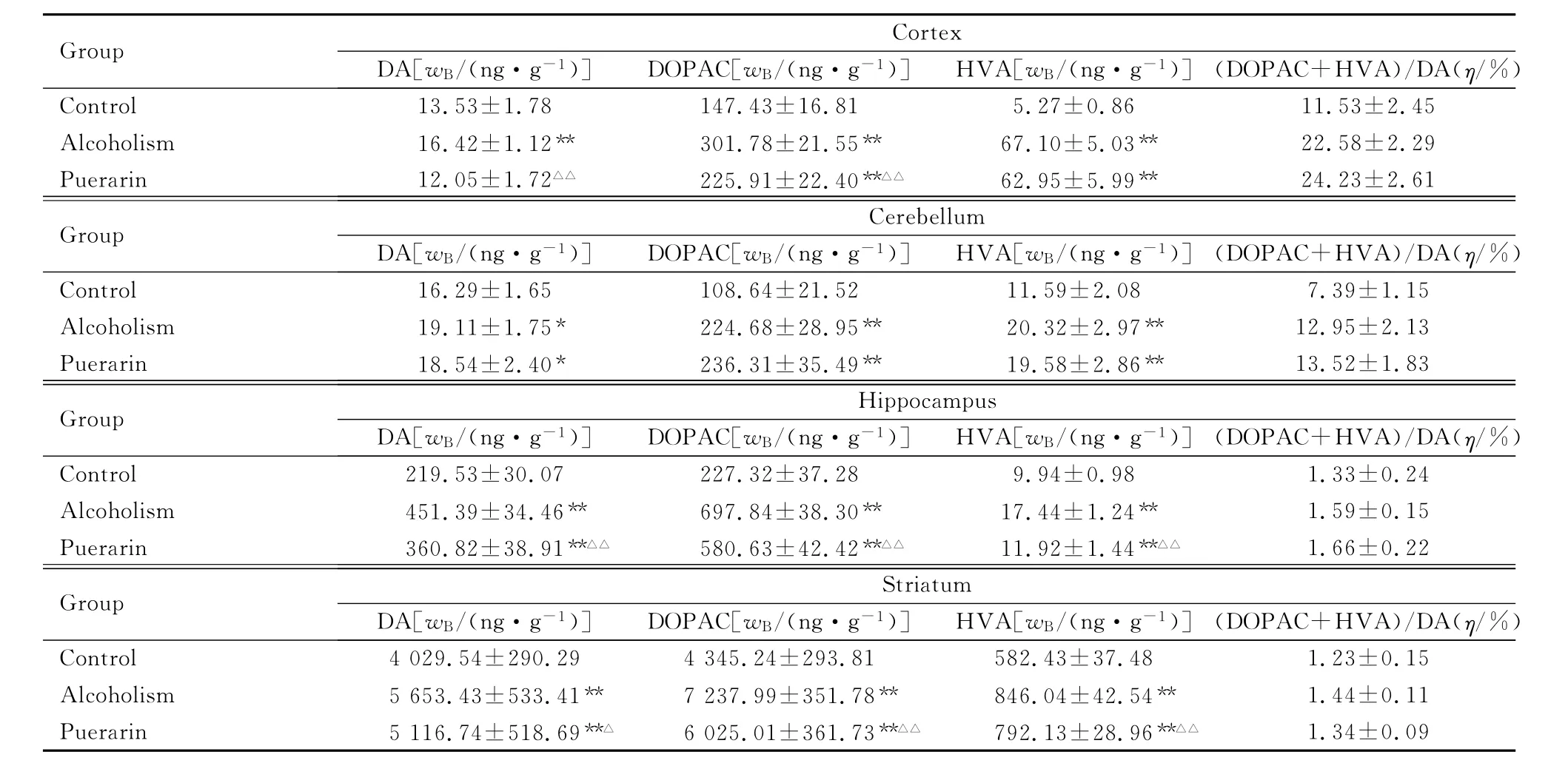
表2 各组大鼠脑组织内DA、DOPAC和HVA表达水平及(DOPAC+HVA)/DA比值Tab.2 The expression levels of DA,DOPAC,HVA and(DOPAC+HVA)/DA ratios in brain tissues of the rats in various groups (n=8,±s)
*P<0.05,**P<0.01compared with control group;△P<0.05,△△P<0.01compared with alcoholism group.
Group Cortex DA[wB/(ng·g-1)]DOPAC[wB/(ng·g-1)]HVA[wB/(ng·g-1)](DOPAC+HVA)/DA(η/%1.53±2.45 Alcoholism 16.42±1.12** 301.78±21.55** 67.10±5.03** 22.58±2.29 Puerarin 12.05±1.72△△ 225.91±22.40**△△ 62.95±5.99** 24.23±2.61 Group Cerebellum DA[wB/(ng·g-1)]DOPAC[wB/(ng·g-1)]HVA[wB/(ng·g-1)](DOPAC+HVA)/DA(η/%))Control 13.53±1.78 147.43±16.81 5.27±0.86 1 7.39±1.15 Alcoholism 19.11±1.75* 224.68±28.95** 20.32±2.97** 12.95±2.13 Puerarin 18.54±2.40* 236.31±35.49** 19.58±2.86** 13.52±1.83 Group Hippocampus DA[wB/(ng·g-1)]DOPAC[wB/(ng·g-1)]HVA[wB/(ng·g-1)](DOPAC+HVA)/DA(η/%)Control 16.29±1.65 108.64±21.52 11.59±2.08 8 1.33±0.24 Alcoholism 451.39±34.46** 697.84±38.30** 17.44±1.24** 1.59±0.15 Puerarin 360.82±38.91**△△ 580.63±42.42**△△ 11.92±1.44**△△ 1.66±0.22 Group Striatum DA[wB/(ng·g-1)]DOPAC[wB/(ng·g-1)]HVA[wB/(ng·g-1)](DOPAC+HVA)/DA(η/%)Control 219.53±30.07 227.32±37.28 9.94±0.9 43±37.48 1.23±0.15 Alcoholism 5 653.43±533.41** 7 237.99±351.78** 846.04±42.54** 1.44±0.11 Puerarin 5 116.74±518.69**△ 6 025.01±361.73**△△ 792.13±28.96**△△Control 4 029.54±290.29 4 345.24±293.81 582.1.34±0.09
本研究结果显示:与对照组比较,乙醇中毒组大鼠皮层内β-EP、DnyA和L-EK的表达水平降低,皮层内DA、DOPAC和HVA及小脑、海马和纹状体内所有指标的表达水平均升高;与乙醇中毒组比较,葛根素组大鼠皮层内β-EP、DnyA和L-EK的表达水平升高,DA、DOPAC和HVA表达水平降低,除小脑内DOPAC表达水平升高外,小脑内DA、HVA及海马和纹状体内DA、DOPA和HVA的表达水平均降低,皮层、小脑和海马内(DOPAC+HVA)/DA比值升高,纹状体内该比值降低。急性乙醇中毒后大鼠脑的多个区域阿片肽和DA表达水平升高,显示急性乙醇中毒对大鼠脑组织有损害作用,葛根素组大鼠各脑区阿片肽和DA表达水平均降低,显示葛根素对这2类神经递质有调控作用,进而对乙醇中毒大鼠脑组织起到一定保护作用。虽然葛根素组大鼠小脑内DOPAC的表达水平较乙醇中毒组略高,但差异无统计学意义。皮层、小脑和海马中(DOPAC+HVA)/DA比值的升高,可能是葛根素加快了DA的代谢、使其代谢产物DOPAC和HVA增多所致,至于纹状体内该比值降低的原因,还需进一步研究。
综上所述,葛根素对乙醇中毒造成的脑损伤有一定保护作用,其机制可能与葛根素对各脑区阿片肽和DA的调控有关。
[1]李秀敏,邓 源.乙醇的中枢神经系统损伤作用[J].中国临床康复,2005,9(21):181-183.
[2]Jarjour S,Bai L,Gianoulakis C.Effect of acute ethanol administration on the release of opioid peptides from the midbrain including the ventral tegmental area[J].Alcohol Clin Exp Res,2009,33(6):1033-1043.
[3]Xiao C,Zhang J,Krnjevic K,et al.Effects of ethanol on midbrain neurons:role of opioid receptors[J].Alcohol Clin Exp Res,2007,31(7):1106-1113.
[4]Schank JR,Goldstein AL,Rowe KE,et al.The kappa opioid receptor antagonist JDTic attenuates alcohol seeking and withdrawal anxiety[J].Addict Biol,2012,17(3):634-647.
[5]Paul F,Kramer,Christine H,et al.Dopamine D2receptor over expression alters behavior and physiology in Drd2-EGFP mice[J].J Neurosci,2011,31(1):126-132.
[6]Michael J,Tamara J.Mice selectively bred for high-or low-alcohol-induced locomotion exhibit differences in dopamine neuron functio[J].J Pharmacol Exp Ther,2009,329(1):342-349.
[7]Zhao M,Du YQ,Yuan L,et al.Protective effect of puerarin on acute alcoholic liver injury[J].Am J Chin Med,2010,38(2):241-249.
[8]崔淑芹.葛根素对急性乙醇中毒大鼠脑内神经递质及行为学的干预作用[J].吉林大学学报:医学版,2012,38(4):665-668.
[9]张建辉,庞广昌.阿片肽的研究进展与展望[J].食品科学,2006,27(12):823-829.
[10]Bakalkin G,Watanabe H,Jezierska J.Prodynorphin mutations cause the neurodegenerative disorder spinocerebellar ataxia type 23[J].Am J Hum Genet,2010,87(5):593-603.
[11]Davis VE, Walsh MJ. Alcohol,amines and alkaloids:apossible biochemical basis for alcohol addiction[J].Science,1970,167(920):1005-1007.
[12]Sarkar DK,Kuhn P,Marano J,et al.Alcohol exposure during the developmental period induces beta-endorphin neuronal death and causes alteration in the opioid control of stress axis function[J].Endocrinology,2007,148(6):2828-2834.
[13]Oswald LM,Wand GS.Opioids and alcoholism[J].Physiol Behav,2004,81(2):339-358.
[14]韦 丰,周儒伦,杨 征,等.酒依赖的中枢神经递质基础 [J].中国药物依赖性杂志,1998,7(3):136-140.
[15]Shabanov PD,Lebedev AA,Bychkov ER.The effect of ethanol exposure in pregnancy on maturation of monoaminergic systems in the developing rat bran[J].Ross Fiziol Zh Im I M Sechenova,2012,98(2):202-211.I泌达导致低血糖的可能性大。
Regulation of puerarin on endorphin and dopamine in brain of rats with acute alcoholism
CUI Shu-qin
(Department of Medical Science,Dezhou University,Dezhou 253023,China)
Objective To investigate the regulation of puerarin on the expression levels of endorphin and dopamine(DA)of cortex,cerebellum,hippocampus,and striatum of the rats with acute alcoholism and to provide basis for clinical treatment of alcoholism and the exploitation of traditional Chinese herb pueraria.Methods 24male SD rats were randomly divided into control group,alcoholism group and puerarin group,and there were 8rats in each group.The expression levels ofβ-endorphin(β-EP),dynorphin(DnyA)and Leu-enkephalin(L-EK)in cortex,cerebellum,hippocampus and striatum were detected by radioimmunoassay,and the expression levels of DA,dihydroxy-phenyl acetic acid(DOPAC)and homovanillic acid(HVA)of the rats in various groups were detected by high performance liquid chromatography(HPLC)method.The ratio of(DOPAC+HVA)/DA was calculated.Results Compared with control group,the exrpession levels ofβ-EP,DnyA and L-EK in cortex of the rats in alcoholism group and puerarin group were decreased(P<0.01).The expression levels of DA,DOPAC and HVA in various brain regions were increased(P<0.01).Compared with alcoholism group,and the expression levels of β-EP,DnyA and L-EK in rat cortex in puerarin group were increased(P<0.05,P<0.01),and the expression levels of DA(P<0.01),DOPAC(P<0.01)and HVA in cortex and all the indexes mentioned above in the cerebellum,hippocampus and striatum were decreased(P<0.05,P<0.01),and the ratios of(DOPAC+HVA)/DA in cortex,cerebellum and hippocampus were increased,but it was decreased in striatum(P>0.05).Conclusion Puerarin has protective effect on rat brain damage induced by acute alcoholism and the mechanism may be related to the regulation of puerarin on endorphin and DA on the rat brain.
puerarin;acute alcoholism;endorphin;dopamine
R322.8
A
1671-587Ⅹ(2013)03-0539-05
10.7694/jldxyxb20130324
2012-09-07
山东省科技厅自然科学基金资助课题 (ZR2010CL018);山东省德州市科技局科技计划基金资助课题(20090162-4)
崔淑芹 (1965-),女,山东省德州市人,副教授,医学硕士,主要从事神经生理学研究。

