Fenton-铁氧体法联合工艺处理络合电镀废水
江洪龙,俞马宏*
(南京理工大学化工学院,江苏 南京 210094)
有机电镀废水来源比较广泛,如各个重金属使用行业的工艺废水与冲洗废水,其中不但含有大量不同种类的重金属离子,还有大量有机配位污染物[1]。这些配位剂与金属离子结合生成稳定的螯合物,用一般重金属处理方法很难达到良好的效果。
Fenton 氧化法是在酸性溶液中使Fe2+与H2O2混合,可在常温下反应,不需高压反应器,催化剂的需求量低。强氧化性羟基自由基能氧化难降解的有机污染物,使配位的金属离子游离于溶液中。Fenton 氧化技术已成功用于处理各种各样的工业废水[2-3]。铁氧体法处理重金属废水是在一定温度下将二价铁盐加入到废水中,调节pH 至碱性,在有氧环境下形成黑色带磁性的尖晶型固体,铁氧体无二次污染,且可用作磁性材料[4]。Fenton 法与铁氧体法2 种工艺中都存在二价铁离子,本文将其联合来处理络合铜镍电镀废水,以达到综合利用的目的。
1 实验
1.1 试剂与仪器
电镀废水由南京某电镀厂提供,该废水的pH 为6.5,主要污染物为:COD 1 550.1 mg/L,总悬浮颗粒物1.92 mg/L,总镍550.60 mg/L,总铜26.28 mg/L。
FeSO4·7H2O、H2O2(质量分数30%)、硫酸、氢氧化钠等均为分析纯。
BS-210-S 分析天平(美国耐普克电子),722 型光栅分光光度计(上海光谱仪器),5B-3C 型COD 测定仪(连华科技),XD-3 型X 射线分析仪(XRD,北京普析通用),THZ-82 恒温振荡器(常州国华电器),PHS-25型精密pH 计(上海雷磁)。
1.2 废水的处理
1.2.1 Fenton 氧化破络
(1) 在250 mL锥形瓶中进行,每次取废水200 mL,放入恒温水浴锅中加热至设定温度。
(2) 加入称量好的FeSO4·7H2O,摇匀至全部溶解后,用H2SO4(0.5 mol/L)溶液或NaOH(2 mol/L)溶液调节废水pH 至规定值。
(3) 用移液管定量移入一定体积的H2O2,放入振荡床以200 r/min 的速率振荡搅拌,待氧化反应结束后,取出锥形瓶。
(4) 用NaOH 溶液调节pH 至8 左右,静置分层,4 000 r/min 离心20 min,取上清液进行分析。
1.2.2 铁氧体法
(1) 在250 mL 锥形瓶中进行,每次取Fenton 氧化反应后的废水200 mL,放入恒温水浴锅中加热至设定温度。加入称量好的FeSO4·7H2O,摇匀至全部溶解后,开始曝气,并用H2SO4溶液(0.5 mol/L)或NaOH溶液(2 mol/L)调节废水pH 至规定值。
(2) 反应一段时间后,静置分层,4 000 r/min 离心20 min,取上清液进行分析。
(3) 将锥形瓶中的剩余沉淀物抽滤后,置于烘箱中于60 °C 下烘干得到黑色固体颗粒,碾磨至粉末状后用大型永久磁铁石将其筛选为磁性产物和非磁性产物,多次多份筛选并计算磁性产物的质量分数,对磁性产物进行XRD 分析。
1.3 分析方法
COD 由COD 快速测定仪测定;总铜按HJ 485- 2009,采用二乙基二硫代氨基甲酸钠分光光度法测定;总镍按GB/T 11910-1989,用丁二酮肟分光光度法测定;溶液pH 用便携式pH 计测定。
2 结果与讨论
2.1 Fenton 氧化工艺参数对COD 去除率的影响
2.1.1 初始pH
初始pH 对COD 去除率有显著的影响,因pH 直接影响到·OH 的形成。在温度25 °C、H2O23.33 g/L、m(Fe2+)/m(H2O2)= 0.1的条件下对废水进行Fenton氧化60 min,研究初始pH 对COD 去除率的影响,结果见图1。Fenton 反应的初始pH 在适宜范围内变化才能产生最大量的活性·OH[5];从图1可知,pH = 3 时,COD的去除率最高,所以本工艺选定Fenton 反应的最佳pH为3。这与很多Fenton 反应的pH 研究结果相同[6-7]。
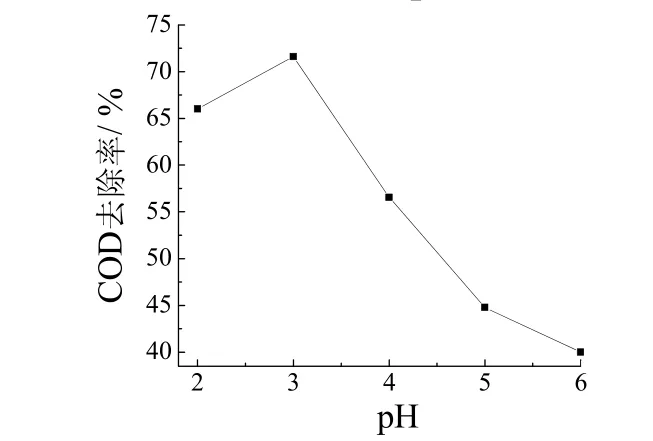
图1 初始pH 对COD 去除率的影响 Figure 1 Effect of initial pH on COD removal
2.1.2 初始H2O2质量浓度
其他工艺条件同上,考察了初始双氧水质量浓度对COD 去除率的影响,结果见图2。
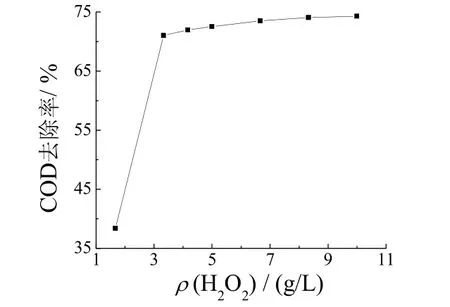
图2 H2O2 初始质量浓度对COD 去除率的影响 Figure 2 Effect of initial concentration of H2O2 on COD removal
H2O2的初始质量浓度较低(如1.665 g/L)时,反应后溶液不完全分层,浑浊且呈褐色,只有少量沉淀生成。从图2可知,随初始H2O2质量浓度的增加,废水的COD 去除率增大;当H2O2增大至3.33 g/L 时,COD去除率增大至71.01%;继续增加H2O2的用量,COD去除率的增大并不明显。因为低浓度下双氧水的质量浓度增大时,其羟基自由基的质量浓度也增大,但含高浓度双氧水的废水中产生的·OH 与H2O2反应生成H2O 和HOO·。HOO·自由基的氧化电位比·OH 低,从而导致COD 去除率降低[8]。选取本工艺的双氧水质量浓度为3.33 g/L。
2.1.3 Fe2+与H2O2的质量比
其他工艺条件同上,初始Fe2+与H2O2质量比对COD 去除率的影响见图3。m(Fe2+)/m(H2O2)从0 增大至0.1 时,COD 的去除率明显增大,这说明在Fe2+含量相对较小时,溶液中的·OH 随Fe2+增多而增多,从而增强催化反应[9]。继续增大m(Fe2+)/m(H2O2),COD 去除率增大并不明显甚至有所降低,这是由于 当溶液中Fe2+含量过高时,Fe2+被催化产生的·OH 氧化成Fe3+,消耗了溶液中的·OH,不利于Fenton 氧化反应的进行[10]。加入过多的Fe2+不仅会消耗产生的·OH,降低催化反应效率,而且产生的Fe3+会增大污泥体积和铁离子浓度,不利于沉淀过程。因此,选定Fenton氧化的初始m(Fe2+)/m(H2O2)为0.1。
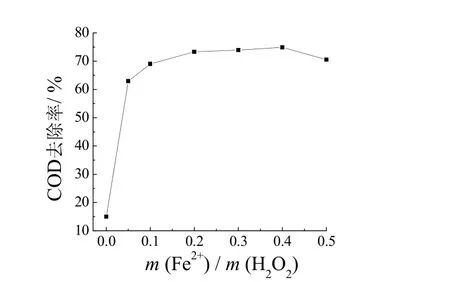
图3 m(Fe2+)/m(H2O2)对COD 去除率的影响 Figure 3 Effect of mass ratio of Fe2+ to H2O2 on COD removal
2.1.4 反应温度
其他条件同上,在不同温度下对废水进行Fenton氧化,隔一定时间后取样,用NaOH 溶液调节其pH 为8,测定样品的COD。为确定Fenton 氧化反应的时间,为下一步铁氧体沉淀反应准备,观察不同温度下COD随反应时间延长的降解情况,结果见图4。
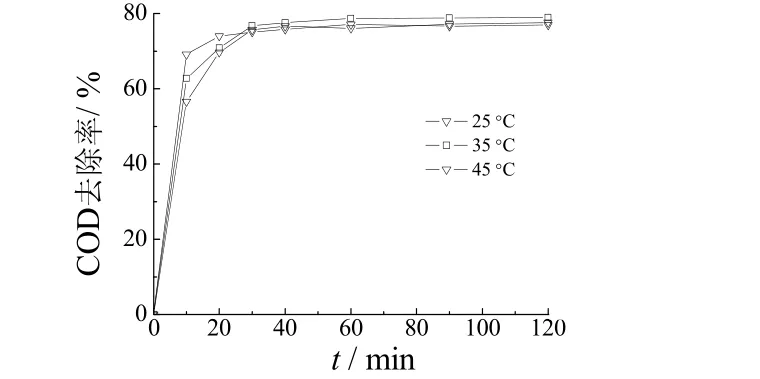
图4 温度对COD 去除率的影响 Figure 4 Effect of temperature on COD removal
从图4可知,温度越高,Fenton 反应的速率越快。这是由于在较高温度下,·OH 生成的速率加快,从而使COD 去除率提高[11]。60 min 后,已基本反应完全,最终的COD 去除率差别不大,说明在该时间范围内温度对最终的COD 去除率影响不大。因此,确定Fenton反应时间为60 min,Fenton 反应温度为25 °C。
综上所述,Fenton 氧化破络的最优反应条件为:初始pH 3,初始H2O2质量浓度3.33 g/L,m(Fe2+)/ m(H2O2)= 0.1,温度25 °C,时间60 min。
2.2 铁氧体处理工艺参数的影响
铜镍电镀废水经Fenton 法破络处理后,溶液呈黄褐色,直接用铁氧体法处理所得溶液。影响铁氧体法处理重金属废水中铁氧体形成的重要因素为pH、温度、m(Fe)/m(Me)(其中Me 为废水中的金属离子)和通气量[12]。
2.2.1 沉淀pH
在50 °C、m(Fe)/m(Me)= 10、曝气速率25 mL/min的条件下,对经破络的电镀废水进行铁氧体处理60 min,pH 对金属离子去除率的影响见图5。
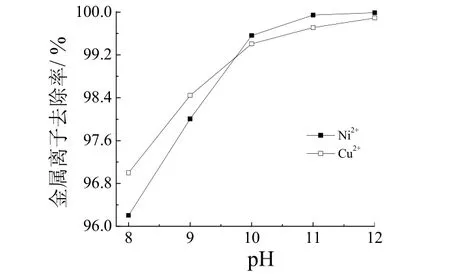
图5 沉淀pH 对金属离子去除率的影响 Figure 5 Effect of precipitation pH on removal of metal ions
从图5可以看出,Cu2+和Ni2+的去除率随pH 增大而增大。另外,pH = 11 时,废水中Ni2+、Cu2+的质量浓度分别低于GB 21900-2008 规定的排放限值(Ni、Cu 均为0.5 mg/L),均可达标排放。观察实验过程沉淀物状态发现,沉淀污泥的颜色随pH 的增大而加深,由墨绿色向黑棕色、黑色变化;沉淀污泥的絮体也逐渐变大,沉淀效果变好。所以铁氧体过程的沉淀pH 选定为11。
2.2.2 曝气速率
其他条件同上,研究曝气速率对铁氧体处理效果的影响,结果见表2。从表2可知,不曝气时,出水Ni2+的质量浓度相对较高,且沉淀物放置在空气中会变为黄褐色,Fe2+被氧化为Fe3+。曝气时,随曝气速率增大, 金属离子的出水质量浓度变化不大,说明曝气量对金属离子的去除率影响不大,但曝气的效果优于不曝气。可见曝气有利于铁氧体的形成,但曝气过量会使沉淀污泥变成棕色,磁性组分减少,呈弱磁性,过量的曝气将大量的二价铁氧化为三价铁,溶液中形成磁性铁氧体的过程受到抑制[10-12]。所以曝气量不能太大,较适宜的曝气速率为25 mL/min。
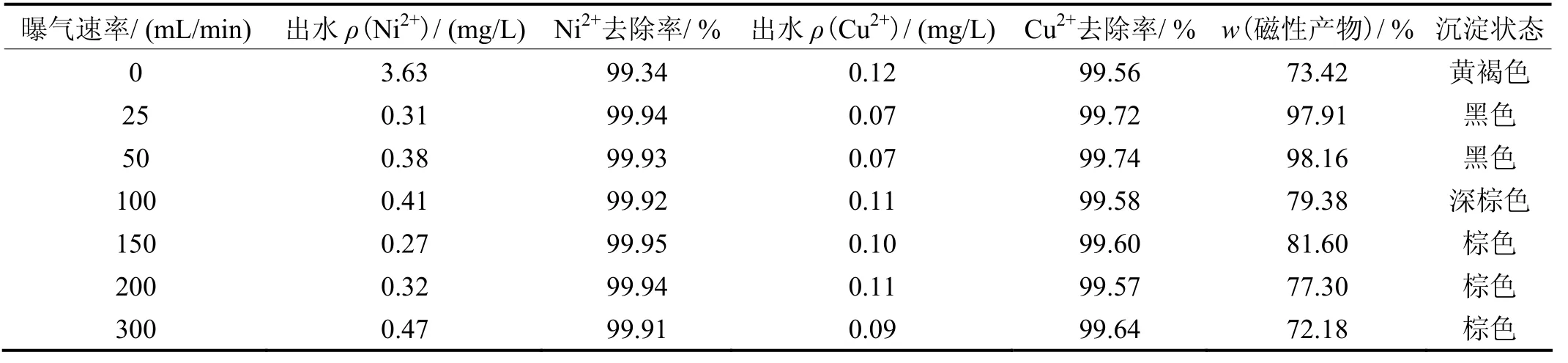
表2 曝气速率对处理效果的影响 Table 2 Effect of aeration rate on treatment effect
2.2.3 Fe2+与Me 的质量比
其他条件同上,研究投加的铁离子与废水中金属离子之间的质量比对铁氧体处理效果的影响,结果见表3。从表3可知,随m(Fe)/m(Me)增大,铜、镍离子的去除效果明显增强,形成的铁氧体的颜色也由棕黄色向黑色转变,颗粒也越来越细,磁性组分也越来越多[13]。当m(Fe)/m(Me)= 10 时,出水Ni2+质量浓度为0.33 mg/L,出水Cu2+质量浓度为0.13 mg/L,均达到GB 21900-2008《电镀污染物排放标准》;此时沉淀污泥呈黑色,磁性强,沉淀性能良好。所以,在保证出水Ni2+和Cu2+浓度达到出水标准情况下,综合考虑减少材料消耗和降低处理成本,选择m(Fe)/m(Me)为10。
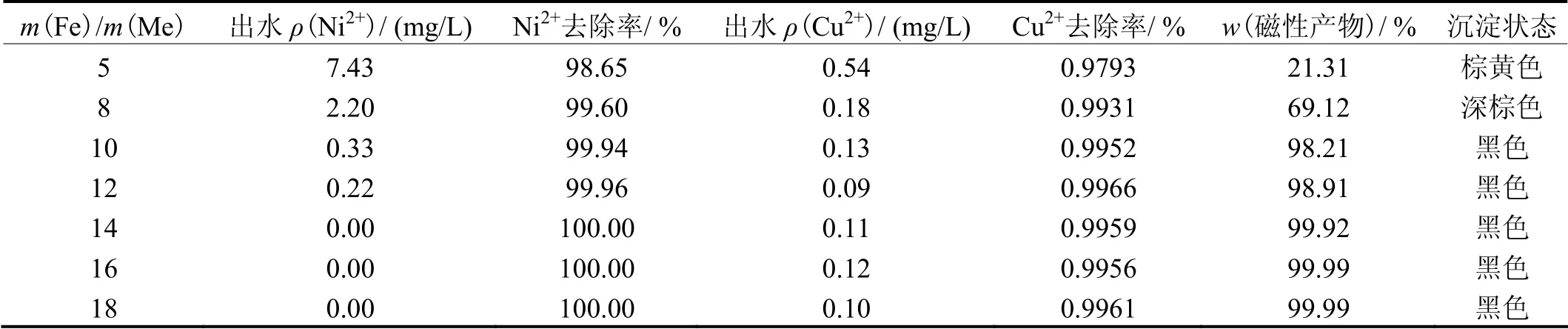
表3 m(Fe)/m(Me)对处理效果的影响 Table 3 Effect of mass ratio of Fe to metal ions in influent on treatment effect
2.2.4 反应温度
其他条件同上,反应温度对铁氧体处理效果的影响见表4。从表4可知,温度对铁氧体的处理效果有一定影响,这一结论与很多研究[14-15]一致。温度越高,沉淀污泥的颜色越深,颗粒越来越细,形成的铁氧体磁性也越来越大。这是因为温度高促进了溶液总氢氧化物脱水,更有利于铁氧体沉淀物的形成,保证出水达标。考虑成本,选定温度为50 °C。
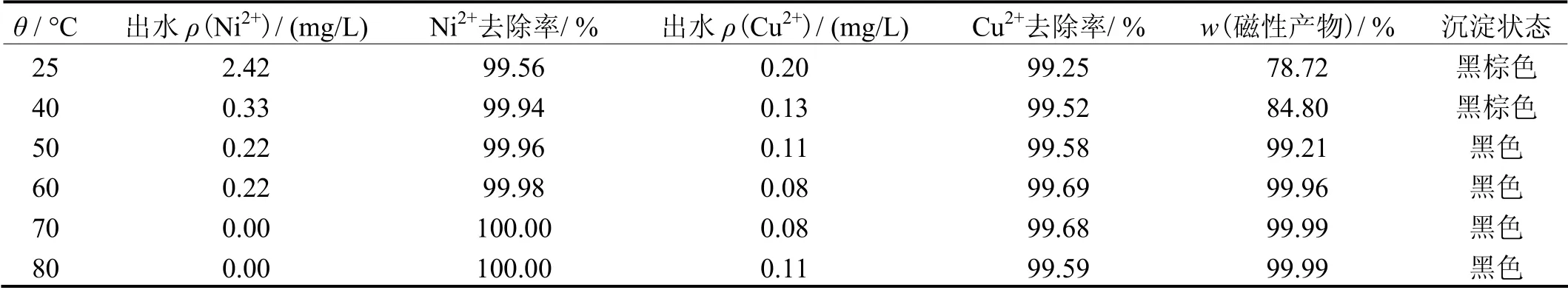
表4 温度对处理效果的影响 Table 4 Effect of temperature on treatment effect
2.2.5 曝气接触时间
其他条件同上,曝气接触时间(陈化时间[16])对铁氧体处理效果的影响见表5。从表5可知,曝气接触时间对铜、镍离子的去除效果有较大影响。曝气反应40 min后,随曝气反应时间延长,铜离子和镍离子的去除率变化不大;但从沉淀物状态可以看出,随曝气时间延长,溶液的颜色依次是墨绿色、深棕色、黑色和深棕色。综合金属离子的出水质量浓度和沉淀物颜色分析,选定最佳曝气时间为60 min。
2.2.6 沉淀物分析
将经烘干的沉淀污泥碾磨后的磁性组分进行XRD分析,不同反应条件下所得试样的XRD 谱图见图6, 其中曝气时间均为60 min。由于沉淀物成分相当复杂,因此产生的峰形也较复杂,图中只标出峰形明显的物质,产物基本上都有磁性。从图6可知,在pH 11、m(Fe)/m(Me)= 10、通气量为25 mL/min 的条件下,形成的铁氧体都存在铁镍矿NiFe2O4及Fe3O4,而且50 °C时铁镍矿NiFe2O4的峰形比25 °C 时更加突出。而在C、D 条件下所得污泥的谱图中,NiFe2O4峰并不明显,还含有Fe3O4、CuO·3H2O 等物质。
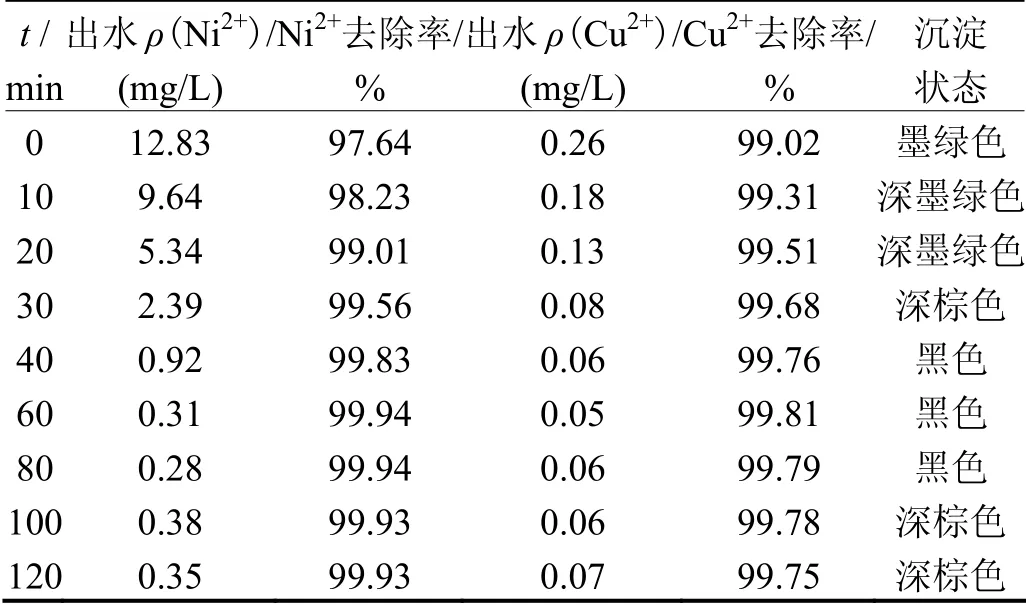
表5 曝气接触时间对处理效果的影响 Table 5 Effect of aeration contact time on treatment effect
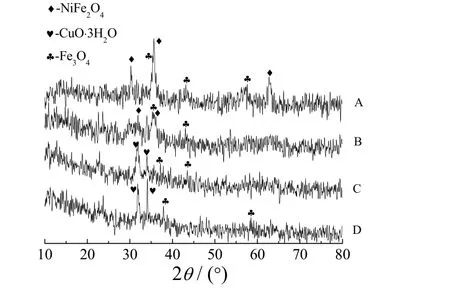
图6 不同条件下所得污泥的XRD 谱图 Figure 6 XRD spectra for sludge obtained under different conditions
只有当因素条件都满足时,才会形成尖晶形铁氧体,从铁氧体反应机理[17]推导出的NiFe2O4生产反应方程如下式:
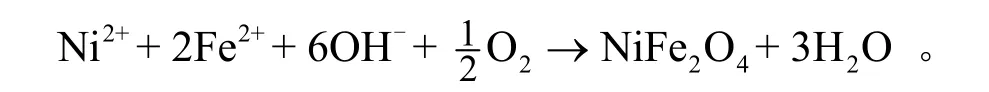
可见,曝气、充足的二价铁离子和碱都是形成铁镍矿NiFe2O4的必要条件。
3 结论
(1) Fenton-铁氧体共沉淀工艺可有效地对废水进行预破络,从有机络合铜镍废水中去除重金属离子。Fenton 反应的最佳工艺条件为:初始pH 3,H2O23.33 g/L,m(Fe2+)/m(H2O2)= 0.1,温度25 °C;铁氧体共沉淀的最佳条件为:沉淀pH 11,曝气流量25 mL/min,m(Fe)/m(Me)= 10,温度50 °C,曝气接触时间60 min。此条件下COD 去除率可达73.4%。在最佳工艺下,废水中镍离子、铜离子的去除率可分别达到99.94%和99.81%。
(2) 铜镍废水经Fenton-铁氧体共沉淀联合工艺处理后,出水镍离子、铜离子的质量浓度分别为0.33 mg/L和0.13 mg/L,可达到国家规定的排放标准。
(3) 在最佳工艺条件下,所得污泥的磁性组分含有铁氧体晶体NiFe2O4、Fe3O4等,铁氧体既无二次污染又可作为磁性材料回收利用。
[1]沈品华,屠振密.电镀锌及锌合金[M].北京: 机械工业出版社,2002.
[2]KUO W G.Decolorizing dye wastewater with Fenton’s reagent [J].Water Research,1992,26 (7): 881-886.
[3]BADAWY M I,ALI M E M.Fenton’s peroxidation and coagulation processes for the treatment of combined industrial and domestic wastewater [J].Journal of Hazardous Materials,2006,136 (3): 961-966.
[4]丁明,曾桓兴.铁氧体工艺处理含重金属污水研究现状及展望[J].环境科学,1992,13 (2): 59-67.
[5]LINDSEY M E,TARR M A.Quantitation of hydroxyl radical during Fenton oxidation following a single addition of iron and peroxide [J].Chemosphere,2000,41 (3): 409-417.
[6]YOON J,LEE Y,KIM S.Investigation of the reaction pathway of OH radicals produced by Fenton oxidation in the conditions of wastewater treatment [J].Water Science and Technology,2001,44 (5): 15-21.
[7]LU M C,LIN C J,LIAO C H,et al.Influence of pH on the dewatering of activated sludge by Fenton’s reagent [J].Water Science and Technology,2001,44 (10): 327-332.
[8]LOU J C,HUANG Y J,HAN J Y.Treatment of printed circuit board industrial wastewater by Ferrite process combined with Fenton method [J].Journal of Hazardous Materials,2009,170 (2/3): 620-626.
[9]KANG N,LEE D S,YOON J.Kinetic modeling of Fenton oxidation of phenol and monochlorophenols [J].Chemosphere,2002,47 (9): 915-924.
[10]TU Y J,CHANG C K,YOU C F,et al.Treatment of complex heavy metal wastewater using a multi-staged ferrite process [J].Journal of Hazardous Materials,2012,209/210: 379-384.
[11]FU F L,WANG Q,TANG B.Fenton and Fenton-like reaction followed by hydroxide precipitation in the removal of Ni(II) from NiEDTA wastewater: A comparative study [J].Chemical Engineering Journal,2009,155 (3): 769-774.
[12]ERDEM M,TUMEN F.Chromium removal from aqueous solution by the ferrite process [J].Journal of Hazardous Materials,2004,109 (1/3): 71-77.
[13]魏先红,翟晓君,邹光中.铁氧体法处理含镍废水的工艺条件研究[J].应用化工,2005,34 (4): 259-260.
[14]MANDAOKAR S S,DHARMADHIKARI D M,DARA S S.Retrieval of heavy metal ions from solution via ferritisation [J].Environmental Pollution,1994,83 (3): 277-282.
[15]MARTIN DE VIDALES J L,LÓPEZ-DELGADO A,VILA E,et al.The effect of the starting solution on the physico-chemical properties of zinc ferrite synthesized at low temperature [J].Journal of Alloys and Compounds,1999,287 (1/2): 276-283.
[16]王九思,来风习,韩迪,等.超声波-铁氧体法处理含镍废水实验研究[J].广州化工,2009,37 (8): 193-195.
[17]BARRADO E,PRIETO F,VEGA M,et al.Optimization of the operational variables of a medium-scale reactor for metal-containing wastewater purification by ferrite formation [J].Water Research,1998,32 (10): 3055-3061.

