12C6+离子束辐照对大青叶生理生化特性的影响*
李雪虎,陆锡宏,辛志君,周 翔,梁剑平
(中国科学院近代物理研究所,甘肃 兰州 730000)
近年来发展起来的重离子束辐照与传统的紫外线、X射线和γ射线相比具有更高的传能线密度(Line energy transfer,简称 LET)、相对生物学效应(RBE)和更尖锐的电离峰(Bragg峰)等特点,能够在低伤害前提下得到较高的诱变率和较宽的突变谱,突变体更稳定[1],已广泛应用于作物改良和诱变育种。近年来,中国科学院近代物理研究所用重离子诱变育种技术开展了多种植物材料的辐照研究,首次用重离子束辐照技术培育出“陇辐2号”小麦、大丽花、甜高粱和紫苏等新品种[2-4]。
大青叶为十字花科植物菘蓝的干燥叶,是一味常用中药,具有清热解毒、凉血利咽的功效,用于温邪入营,高热神昏,发斑发疹,黄疸,热痢,痄腮,喉痹,丹毒,痈肿等[5]。临床上则用作治疗各种病毒性流行性感冒、乙型脑炎、单纯疱疹病毒性角膜炎、流行性腮腺炎和病毒性肝炎等传染性疾病[6]。随着需求量的增大和对品质要求的提高,价值越来越受到人们的关注。但栽培品种及产地气候不同,产量和有效成分含量存在较大差异,且质量不稳定。现有品种抗病性和抗虫性较差,个别产地品种退化严重。采用12C6+离子束进行大青叶辐照育种的研究在国内外还未见报道。本文研究了不同剂量12C6+离子束辐照对苗期生理生化特性影响,为大青叶辐射育种提供理论依据。
1 材料与方法
1.1 实验材料
已经过三个世代的纯化试验大青叶种子,于4℃冰箱保存待用,植物种子标本保存于中国科学院近代物理研究所药物研发中心。
1.2 辐照方法
辐照实验在中国科学院近代物理研究所兰州重离子研究装置(HIRFL)生物辐照终端上进行。初始能量为100 MeV/u的12C6+离子束经过束流管道的镍窗、电离室、空气、降能片后照射样品 (植物种子),用空气电离室监测注入量,样品更换和数据获取均由计算机控制,全部过程在室温和大气环境条件下进行,辐照剂量分别为20,40,50和 80 Gy,剂量率为10 Gy/min,没有辐照的种子为对照。
1.3 幼苗培养
将不同剂量辐照处理的大青叶种子和对照组各100颗用纱布包好,用水浸泡过夜,75%酒精消毒2 min,用无菌水冲洗3次放入已灭菌的MS固体培养基(MurashigeandSkoog,1962),每皿40粒,在室温下昼夜交替培养。
1.4 生理生化指标及其测定
幼苗培养4周后,用铲子从盆钵中完整地挖出大青叶幼苗,洗净并收集根系和幼苗,进行生理生化指标测定,各组统计20株,所有指标测定每处理重复3次。具体指标及测定方法如下。
1.4.1 根系活力采用氯化三苯基四氮唑(TTC)法进行[7,8]称取根系鲜样1 g,浸没于盛有0.4%TTC和66 mmol/L磷酸缓冲液的等量混合液10 mL的烧杯中,于37℃保温3 h,然后加入1 mol/L硫酸2 mL终止反应。取出根,小心擦干水分后与3 mL乙酸乙酯和少量石英砂一起在研钵中充分研磨,过滤后将红色的提取液移入10 mL容量瓶,定容至10 mL,于 485 nm处测定 OD值,求出 TTC的还原量。
1.4.2 丙二醛(malondialdehyde,简称 MDA)含量的测定 MDA的检测按照 Dhindsa等的方法[9]。MDA 含量(mmol/L)=6.45(OD532-OD600)-0.56×OD450[10]。
1.4.3 叶绿素含量采用李合生等的方法进行[11]称取0.5 g新鲜幼苗叶片用丙酮浸提获得色素提取液,然后以80%丙酮为对照,分别测定663 nm、645 nm处的光密度值。根据测量得到的光密度值代入公式计算叶绿素a和叶绿素b的含量。
1.4.4 酚酸类化合物含量 酚酸类化合物提取与测定参照文献[12]的方法 以水杨酸为对照品。采用folin-ciocaiteu比色法;测定A763 nm处吸光度,根据线性方程求酚酸类类化合物含量。
1.4.5 酶活性测定 POD和 SOD提取:称取1 g幼苗,加入5 mL提取缓冲液,在冰浴条件下研磨成匀浆于4℃,4000 r/min离心15 min,收集上清液低温保存备用,测量提取液总体积[14]。还原型谷胱甘肽提取:称取1 g幼苗,置于研钵中,加入5 mL经4℃预冷的50 g/L三氯乙酸溶液(含5 mmol/L Na2-EDTA),在冰浴条件下研磨成匀浆,于4℃、10000 r/min离心20 min。收集上清液,测量提取液总体积[14]。酶液活性测定方法及药品的配置均按照李玲等的方法[14]备用。
1.5 数据分析
对以上所获得的数据用DPS数据处理系统进行统计分析[15]。
2 结果与分析
2.1 大青叶酚酸类化合物含量
不同剂量的碳离子束辐照处理后,其大青叶内酚酸类化合物含量的变化趋势见图1。0~80 Gy剂量范围内大青叶叶片内酚酸类化合物含量随辐照剂量增大而增加,对照组酚酸类含量为0.16 mg/mL,80 Gy时为0.24 mg/mL达最大;说明不同剂量的重离子束辐照都有利于大青叶片内酚酸类化合物的积累。
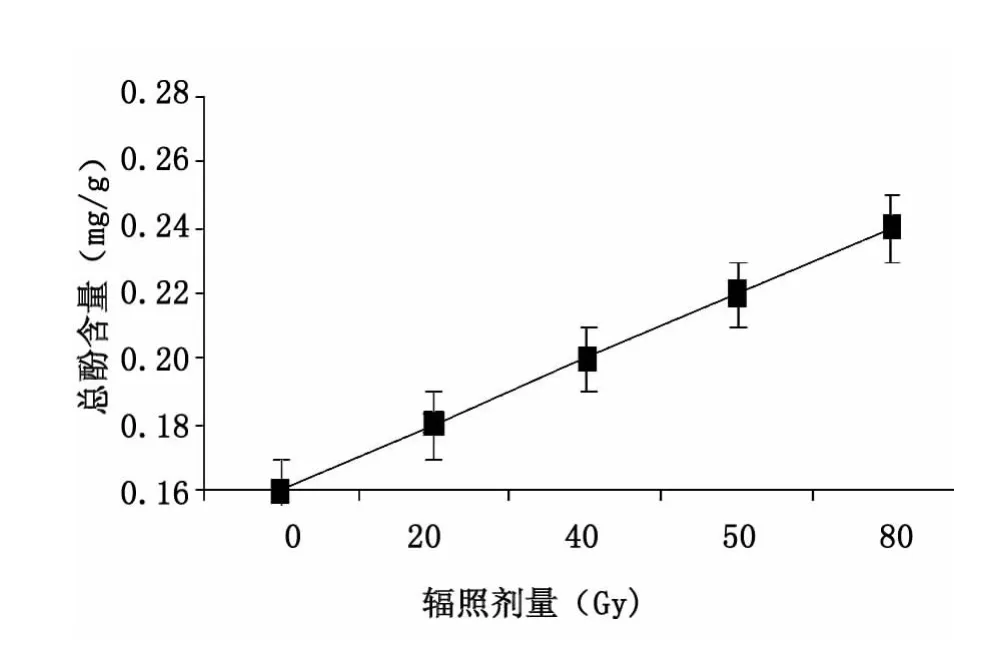
图1 碳离子辐照对酚酸类化合物含量的影响Fig.1 Effect of12C6+ion irradiation on phenolic content
2.2 辐照对大青叶幼苗根系活力与生长的影响
大青叶根系是吸收养分和水分的主要器官,并进行一系列有机化合物的合成反应,对地上部的形态形成及新陈代谢过程起着极其重要的作用。不同辐照处理对大青叶幼苗根系活力的影响见图2。由图2可见,随着剂量的增加大青叶根系TTC的还原强度均呈现下降的趋势。特别是80 Gy处理极显著地降低大青叶的根系活力。由此表明,80 Gy高剂量辐照处理对大青叶幼苗根系活力产生较大的抑制作用。
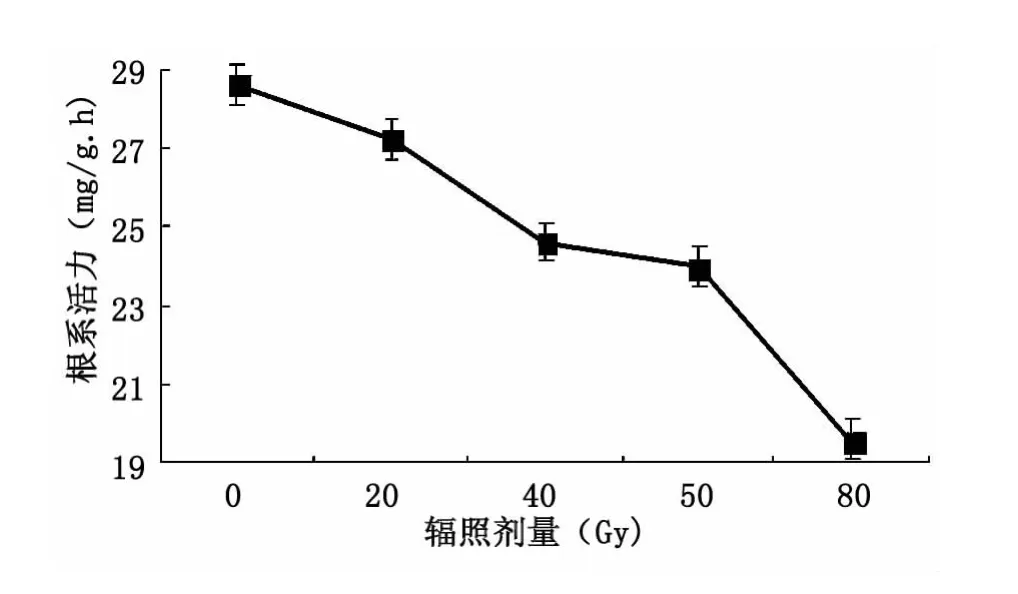
图2 碳离子辐照对根系活力的影响Fig.2 Effect of irradiation on root vigor of seedlings
2.3 大青叶可溶性糖含量
图3是12C6+离子辐照对可溶性糖含量的影响,在0~40 Gy,含糖量随辐照剂量增大大幅增加,对照组的可溶性糖含量为0.867%,40 Gy时为2.98%,为最大值;40~80 Gy间随辐照剂量增大而下降。这表明大青叶的含糖量随碳离子辐照剂量增大,但辐照剂量高于40 Gy不利于可溶性糖的积累。
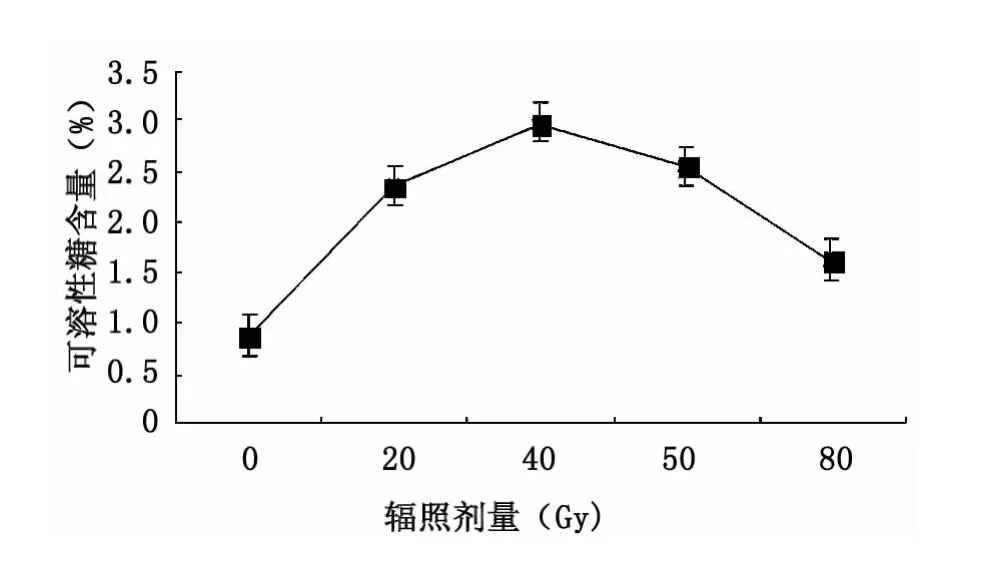
图3 碳离子辐照对可溶性糖含量的影响Fig.3 Effect of12C6+ion irradiation on soluble sugar content
2.4 叶绿素含量
光合作用是植物合成碳水化合物的一个重要生理过程,而叶绿素是植物光合作用的基础。不同剂量的12C6+离子束辐照处理后,其大青叶片内叶绿素a和叶绿素b含量的变化情况见图4。两种色素的变化趋势基本一致,在0~50 Gy变化不大,略有降低,对照组叶绿素a和叶绿素b的含量分别为1.92和1.02 mg/g,50 Gy 时三者的含量分别为 1.71 和0.81 mg/g;到80 Gy色素含量降到最低分别为1.31和 0.60 mg/g。
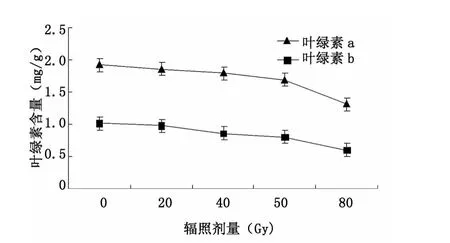
图4 碳离子辐照对叶绿素含量的影响Fig.4 Effect of12C6+ion irradiation on chlorophyll content
2.5 大青叶丙二醛(MDA)含量
丙二醛(MDA)是植物受环境胁迫后引起细胞膜脂过氧化而产生的副产物,其在细胞内积累量与细胞膜氧化损伤的程度密切相关。MDA的含量变化反映了质膜受损伤的程度。如图5所示,随着照剂量的增大,大青叶的MDA含量先升高,在40 Gy辐照处理组达到最大值,与对照组相比升78%(P<0.01);50和80 Gy辐照处理组的MDA含量有所降低,分别比对照组升高了 51.6%和 43.9%(P <0.01)。
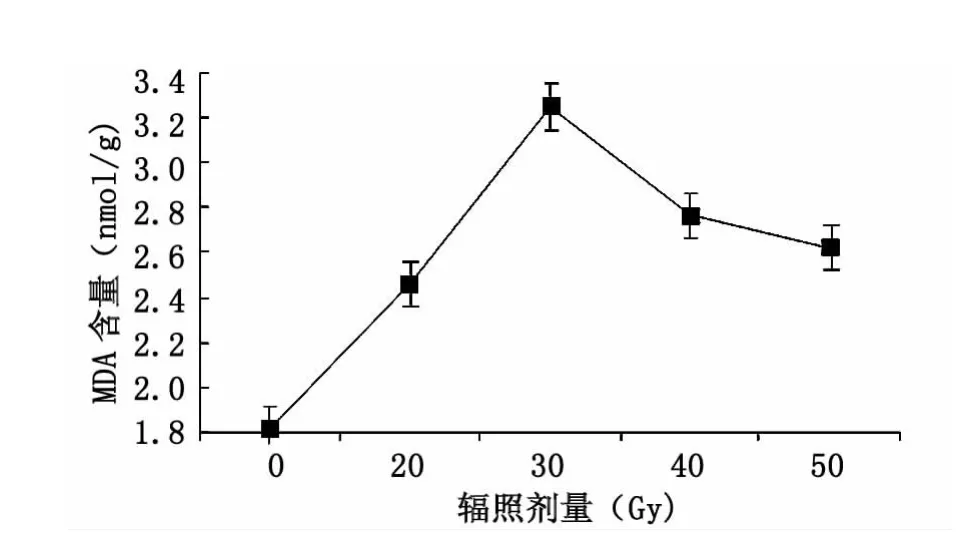
图5 碳离子辐照对MDA含量的影响Fig.5 Effect of12C6+ion irradiation on MDA content
2.6 大青叶细胞抗氧化酶活性
不同剂量12C6+离子束辐照组的大青叶SOD活性均明显高于对照组(P<0.05)(图6)。随着0,20,40,50和80 Gy辐照剂量的增高,辐照组SOD活性先增高后降低,在40 Gy时达到最大值,为对照组的138%(P<0.01)。50和80 Gy辐照组的POD活性有所升高,但仍明显高于对照组。如图6所示。
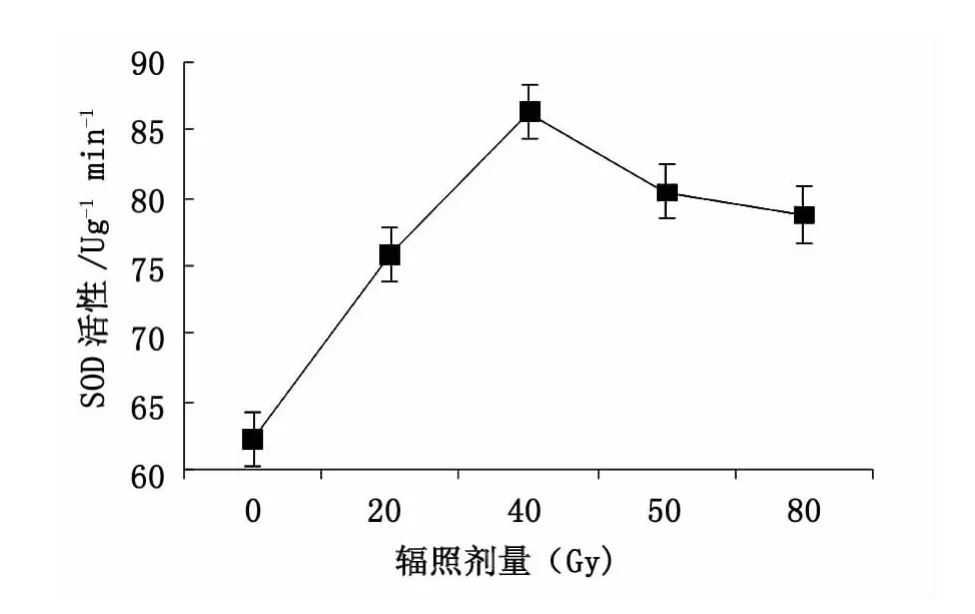
图6 碳离子辐照对SOD活性的影响Fig.6 Effect of12C6+ion irradiation on SOD content
12C6+离子束辐照处理大青叶的POD活性随辐照剂量增大呈先增后降的类“抛物线”趋势(图7),40 Gy 时 SOD 活性达最大值(93.6 μg/g),这表明碳离子辐照有利于提高SOD活性的积累。
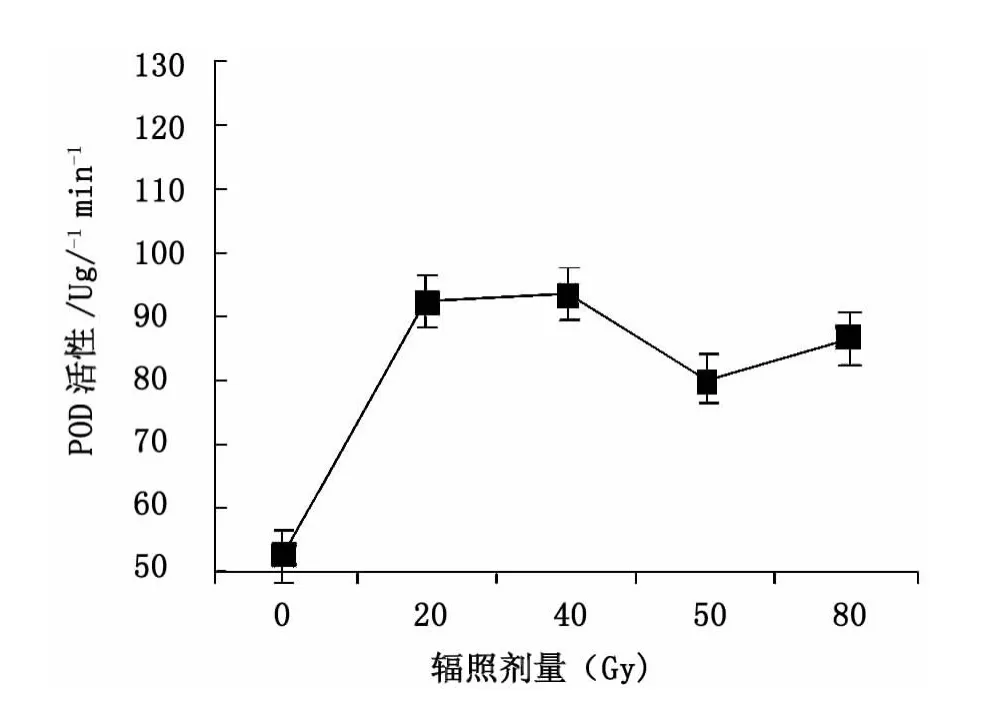
图7 碳离子辐照对POD活性的影响Fig.7 Effect of12C6+ion irradiation on POD content
3 讨论
辐射诱变育种首先要确定适宜的辐照剂量,才可获得有效的诱变。一般而言,随着辐照剂量的增加,突变频率也会相应的提高,但过高的剂量会干扰生物体正常的代谢,增加畸变率[16,17]。同时,每种生物体都有自身的生物学特性,它们对辐照处理的敏感性也各不相同。因此,开展大青叶干种子的辐照敏感性试验是非常必要的,它是开展大青叶辐射育种的基础。
在逆境条件下,植物体内可溶性糖会积累,以降低渗透势和冰点,适应外界环境条件的变化,可溶性糖含量的变化在一定程度上可反映植物的抗逆性[2]。本实验中,大青叶可溶性糖含量都有明显积累,在40 Gy时达最大值,而50和80 Gy时反而下降。这可能是因为重离子束作为一种新型的诱变源,有较大的能量和质量沉积效应。当带有一定电荷态的重离子作用于种胚时,其物理、化学和生物学综合作用有可能引发种胚的突变[18],进而导致植物相关生理特性发生不同程度的改变。
植物体内有许多酚酸类化合物,它们有抗氧化和抗菌等多种生理功能[19]。多酚在植物生理、生态上,尤其是抗虫生理中也发挥着重要作用[20]。本研究中,0~80 Gy剂量范围内大青叶内酚酸类化合物含量随辐照剂量增大而增加,这可能是由于在中、低剂量重离子对样品产生的伤害小[21],有刺激效应,引发种胚发生突变,提高了它的抗逆性、抗氧化和抗病虫害能力。
现在普遍认为,植物体内自由基的积累首先攻击膜系统,使得膜脂脂肪酸的不饱和键被氧化,造成MDA含量的增加,损伤膜结构,严重时导致植物死亡,产生MDA,其积累量反映了植物受逆境伤害的程度[22-23]。本研究中,辐照处理组的MDA含量明显高于对照组,产生大量 MDA,处理剂量40 Gy时,MDA含量高于对照.辐照剂量为40~80 Gy,MDA含量呈下降趋势。这说明低剂量C离子辐射对生物膜造成损伤,中能重离子束辐照对大青叶能产生一定伤害,辐照剂量增大则可激活相关保护酶系统,减轻了重离子束辐照对自身的伤害。
植物根系是活跃的吸收器官和合成器官,根的生长状况和活力水平直接影响植株生长和营养状况及产量水平。根系活力大小一定程度上反映了植株吸收养分能力的强弱[24]。武振华等[3]研究发现,12C6+离子束辐照紫苏种子后植株矮化、成活率降低。司婧等[1]发现辐照组的种子正常萌发后,其幼根停止生长,幼苗和幼根逐渐腐烂导致死亡,推测番茄种子根生长点是重离子辐照的敏感区域。本研究中也发现随着剂量的增加大青叶根系活力均呈现下降的趋势,充分证明了辐照损伤主要抑制了根的生长。辐照大青叶片内色素类化合物叶绿素a、叶绿素b等随辐照剂量增大而略有降低,在叶片颜色上呈现暗绿,推断是根受到损伤从而造成植株营养不良所致。
SOD和POD是植物体内2种重要的膜保护酶,能对细胞的伤害作出响应,同时消除自由基产生的伤害而起保护作用,对维持植物细胞自由基处于较低水平有重要作用。因此可认为,相应酶系的活性可作为作物辐照敏感性的测定指标。本试验结果表明SOD活性表现为先上升后降低,处理剂量为20~40 Gy,二者活性逐渐增大,在40 Gy处有最大值,后又随辐照剂量增大,活性显著下降。这与周利斌等[25](80 MeV/u的12C6+离子和50 keV的电子辐照沙打旺干种子)和薛林贵等[2](12C6+离子束辐照紫苏)的研究结果中MDA含量变化趋势相同,都表现为先上升后降低。
总之,碳离子束辐照大青叶种子有利于大青叶中的可溶性糖、丙二醛和酚酸类类化合物含量的积累,40 Gy左右的辐照剂量有利于酚酸类化合物及抗逆性物质的积累。对大青叶抗逆性的提高和新品种的选育有重要意义。在辐射育种的后续研究中,还可将现代分子生物学研究技术引入到诱变育种工作中,以提高对有利变异的筛选与利用效率。
[1]司婧,张红.12C6+离子束辐照番茄种子当代效应[J].原子核物理评论,2011,28(3):93-97.SI Jing,ZHANG Hong.Effects of irradiation with12C6+ion beam on M1 characters of Lycopersicon esculentum Mill[J].Nuclear Physics Review,2011,28(3):93-97.
[2]薛林贵,徐俊泉,张红,等.12C6+离子束辐照对紫苏生理特性的影响[J].核技术,2011,31(4):267-272.XUE Lingui,XU Junquan,ZHANG Hong,et al.Effect of12C6+ion beam irradiation on physiological characteristics of Perilla[J].Nuclear Techniques,2011,31(4):267-272.
[3]武振华,张红,王新宇.12C6+离子束辐照紫苏干种子当代效应[J].原子核物理评论,2010,27(3):335-340.WU Zhenhua,ZHANG Hong,WANG Xinyu.Effects of irradiation with12C6+Ions on M1 characters of Perilla frutescens(L.)Britt[J].Nuclear Physics Review,2010,27(3):335-340.
[4]卫增泉,颉红梅,梁剑平,等.重离子束在诱变育种和分子改造中的应用[J].原子核物理评论,2003,20(1):38-41.WEI Zengquan,XIE Hongmei,LIANG Jianping,et al.Application of heavy ion beams in induced mutation breeding and molecular modification[J].Nuclear Physics Review,2003,20(1):38-41.
[5]柳继锋,张雪梅,薛多清,等.大青叶的化学成分研究[J].中国中药杂志,2006,31(23):1961-1965.LIU Jifeng,ZHANG Xuemei,XUE Duoqing,et al.Studies on flavonoid constituents from herbs of Artemisia ordosica[J].China JournalofChineseMateriaMedica, 2006, 31 (23):1961-1965.
[6]武彦文,高文远,肖小河.大青叶的研究进展[J].中草药,2006,37(5):793-796.WU Yanwen,GAO Wenyuan,XIAO Xiaohe.Advances in studies on Folium Isatidis[J].Chinese Traditional and Herbal Drugs,2006,37(5):793-796.
[7]张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2005,39-41.ZHANG Zhiliang,QU Weijing.Experimental guide for plant physiology[M].Beijing:High Education Press,2005,39-41.
[8]王忠华,陈小坚,包旭升,等.辐照处理对Bt水稻苗期生理生化特性的影响[J].核农学报,2011,25(1):174-178.WANG Zhonghua,CHEN Xiaojian,BAO Xusheng,et al.Effect of irradiation on physiological and biochemical properties of Bt rice seedlings[J].Journal of Nuclear Agricultural Sciences,2011,25(1):174-178.
[9]DHINDSA R S,MATOWE W.Drought tolerance in two mosses:correlated with enzymatic defense against lipid peeroxidation[J].J Exp Bot,1981,32(1):79-91.
[10]QUAN R,SHANG M,ZHANG H.Improved chilling tolerance by transformation with betA gene for the enhancement of glycinebetaine synthesis in maize[J].Plant Sci,2004,166:141-149.
[11]李合生,孙群,赵世杰.植物生理生化实验原理和技术[M].北京:高等教育出版社,2004,134-137 LI Hesheng,SUN Qun,ZHAO Shijie.Plant physiological and biochemical principles and techniques[M].Beijing:High Education Press,2004,137-137.
[12]张军,李江遐,陆翠珍,等.Folin-ciocalteu比色法测桑叶中多酚含量[J].激光生物学报,2012,21(2):131-135.ZHANG Jun,LI Jiangxia,LU Cuizhen,et al.Determination of the total content of polyphenols in the leaf of Mulbery by Folin-ciocalteu colorimetry[J].ACTA LASER BIOLOGY SINICA,2012,21(2):131-135.
[13]聂少平,谢明勇,罗珍.用清除有机自由基DPPH法评价茶叶多糖的抗氧化活性[J].食品科学,2006,27(3):34-36.NIE Shaoping,XIE Mingyong,LUO Zhen.Antioxidative activity evaluation study on tea polysaccharide by scavenging DPPH[J].Food Science,2006,27(3):34-36.
[14]李玲.植物生理学[M].北京:科学出版社,2011,95-102.LI Ling.Plant Physiology[M].Beijing:Science Press,2011,95-102.
[15]唐启义,冯明光.实用统计分析及其DPS数据处理系统[M].北京:科学出版社,2002:159-163.TANG Qiyi,FENG Mingguang.DPS data processing system for practical statistics[M].Beijing:Science Press,2002:159-163.
[16]WU J L,WU C,LEI C,et al.Chemicaland irradiation-induced mutants of indica rice IR64 for forward and reverse genetics[J].Plant Molecular Biology,2005,59(1):85-97.
[17]MELKI M,MAROUANI A.Effects of gamma rays irradiation on seed germination and growth of hard wheat[J].Environ Chem Lett,2010,8(4):307-310.
[18]苏一,李毅,辛华.绿豆种胚中离子注入深度的研究[J].核技术,1997,20(12):718-721.SU Yi,LI Yi,XIN Hua.Ion implantation depth in embryos of mung bean[J].Nuclear Technique,1997,20(12):718-721.
[19]MANACH C,WILLIAMSON G,MORAND C,et al.Bioavailability and bioefficacy of polyphenols in humans.I.Review of 97 bioavailability studies[J].The American Journal of Clinical Nutrition,2005,81(Suppl 1):230-242.
[20]程春龙,李俊清.植物多酚的定量分析方法和生态作用研究进展[J].应用生态学报,2006,17(12):2457-2460.CHENG Chunlong,LI Junqing.Research advances in ecological significance and quantification of plant polyphenols[J].Chinese Journal of Applied Ecology, 2006, 17(12):2457-2460.
[21]薛建明,王宇刚,卢希庭.低剂量离子在物体样品中透射行为的研究[J].核技术,1999,22(8):449-453.XUE Jianming,WANG Yugang,LU Xiting.Transmission measurement of low dose rate ions in biological samples[J].Nuclear Techniques,1999,22(8):449-453.
[22]PRASAD T K,ANDERSON M D,MARTIN B A.Evidence for chilling-induced oxidative stress in maize seedlings and a regulatory role for hydrogen peroxide[J].The Plant Cell,1994,6:65-74.
[23]许凯扬,叶万辉,沈浩.低温胁迫下喜旱莲子草幼苗膜脂过氧化及保护酶活性的变化[J].生态科学,2006,25(2):139-142.XU Kangyang,YE Wanhui,SHEN Hao.Changes in membrane lipid peroxidation and activities of cell protective enzyme in leaves of Alternanthera philoxeroides seedling under low temperature stress[J].Ecologic Science,2006,25:139-142.
[24]陈雄伟,郑春梅,李晓丹,等.不同氮营养水平对水葫芦根系活力的影响[J].安徽农业科学,2012,40(3):1657-1659 CHEN Xiongwei,ZHENG Chunmei,LI Xiaodan,et al.Effect of different concentrations of nitrogen nutrition on root activity in Eichhornia crassipes[J].Journal of Anhui Agri Sci,2012,40(3):1657-1659.
[25]周利斌,李文建,李强,等.重离子及电子辐照沙打旺干种子的辐射生物学效应[J].激光生物学报,2003,12(5):350-354.ZHOU Libin,LI Wenjian,LI Qiang,et al.Radiobiological effect of12C6+ion and electron beams with different fluence on Astragalus adsurgens pall dry seeds[J].Acta Laser Biology Sinica,2003,12(5):350-354.

