广西红水河流域壮族长寿家系子女ACAT1 rs1044925基因多态性与血脂水平的相关性
宋 臻,吕泽平,罗 桓,潘尚领,胡才友,杨 铭,杜丽丽,彭均华,罗晓秋,周小玲,尹瑞兴,刘承武
(1广西医科大学病理生理学教研室,南宁530021;2广西壮族自治区江滨医院;3广西医科大学心血管研究所)
胆固醇酰基转移酶(ACAT)是细胞内催化胆固醇和长链脂肪酸合成胆固醇酯的酶[1],存在ACAT1和ACAT2。ACAT1在人体各种组织和细胞中广泛表达,主要作用是维持细胞内外胆固醇的平衡[2,3];ACAT2目前发现只在小肠和肝脏中表达,主要参与胆固醇的吸收和极低密度脂蛋白(VLDL)的装配[4,5]。目前研究发现,ACAT 与动脉粥样硬化及阿尔茨海默病等老年病的发生密切相关[6]。文献报道,ACAT1 rs1044925的多态性可以影响血脂水平[7]。广西红水河一带因长寿老人众多,称为广西红水河流域长寿带。2010年12月~2012年7月,我们对采集的样本进行相关研究,旨在探讨该流域壮族长寿家系子女ACAT1 rs1044925基因多态性与血脂水平的关系,了解ACAT1基因在长寿人群中的作用。
1 资料与方法
1.1 研究资料 广西红水河流域壮族长寿家系第1代子女473例,年龄51~72岁;第2代子女311名,年龄31~50岁。同一地区壮族非长寿家系对照组年龄段同上,分别是346例和213例。采样前排除冠心病、糖尿病、老年痴呆等老年相关性疾病。长寿家系指家庭成员中至少有1名年龄≥90岁老人,非长寿家系指家庭成员3代内无超过90岁老人。上述研究对象均知情同意参加该项研究。
1.2 方法
1.2.1 标本采集及处理 抽取研究对象空腹12 h晨起肘静脉血8 mL,其中3 mL用ACD抗凝处理,以常规酚/氯仿法提取白细胞中基因组DNA,紫外分光光度法测定DNA含量,-20℃保存;另外5 mL分离血清,用于检验血脂、血糖水平。
1.2.2 ACAT1 rs1044925多态性检测 采用 PCRRFLP法。上游引物序列:5'-TAT ATT AAG GGG ATC AGA AGT-3',下游引物:5'-CCA CCT AAA AAC ATA CTA CC-3'(中国上海生工公司合成),20μL PCR反应体系含有 DNA 0.5μg,上下游引物各0.2 μmol/L,dNTP 200 μmol/L,10 × PCR 缓冲液(100 mmol/L Tris-HCl,pH 8.3,500 mmol/L KCl,20 mmol/L MgCl2)2.0 μL 和 Taq多聚酶 1.0 U。PCR扩增条件:95℃预变性5 min;95℃变性45 s,53℃退火30 s,72℃延伸50 s,共35个循环;72℃延伸10 min。取扩增产物5μL在3.0%的琼脂糖凝胶电泳30 min,并在紫外灯下观察目的产物(389 bp)。10μL酶切体系含有PCR产物5μL、RsaI(NEB公司)5 U和10×NEB缓冲液1μL将酶切体系在37℃水浴箱内酶切过夜(>8 h),酶切产物电泳(条件同上),并鉴定。
1.2.3 一般指标及血脂测定 流行病学调查血压、身高、体重等,并计算身体质量指数(BMI)。血脂水平在广西壮族自治区江滨医院检验科检测。血清TC、TG水平测定采用酶方法,HDL和LDL采用酶联免疫一步法,试剂盒均购自中国上海申能试剂公司。血脂检测的参考正常值:TC:3.10~5.17 mmol/L,TG:0.56 ~1.70 mmol/L,HDL-C:0.91 ~1.81 mmol/L,LDL-C:2.70 ~3.20 mmol/L。
1.2.4 统计学方法 采用SPSS19.0统计软件。计量资料以¯x±s表示,基因频率用直接计数法计算;Hardy-Weiberg平衡检验采用拟合优度χ2检验,样本均数比较采用协方差分析(ANCOVA),ANCOVA分析以消除年龄分布差异的影响,分类资料组间比较采用χ2检验,以P≤0.05为有统计学差异。
2 结果
2.1 PCR结果 基因型AA只出现389 bp片段,基因型AC出现3个片段分别是389 bp、279 bp和110 bp,基因型CC出现2个片段分别是279 bp和110 bp。见图1。
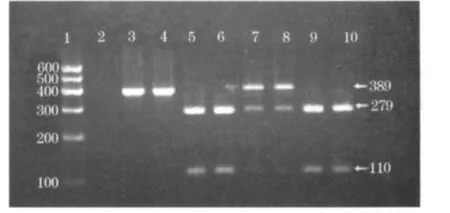
图1 ACAT1 rs1044925酶切产物凝胶电泳图
2.2 基因型分布 随机抽取部分样本行DNA序列测定(中国上海生工公司),结果与基因分型一致,表明分型结果稳定可靠。见图2。长寿家系各年龄段子女与对照组之间的等位基因和基因型频率比较差异均无统计学意义(P均>0.05)。
2.3 一般情况及血脂水平比较 长寿家系子女的收缩压(133.82 ±19.33)mmHg,TC(5.04 ±0.91)mmol/L,LDL(2.77 ±0.82)mmol/L,对照组分别为(131.55 ±19.72)mmHg、(4.87 ±0.95)mmol/L 和(2.60 ±0.85)mmol/L,P <0.05;第 1 代子女与对照组在收缩压、舒张压、TC、TG、LDL水平上比较差异有统计学意义(P均<0.05);长寿家系第2代与对照组比较LDL水平差异有统计学意义(P<0.05),其余指标差异无统计学意义(P均>0.05)。
2.4 ACAT1 rs1044925基因型对血脂水平的影响因CC基因型的个体很少,故与AC合并后再与野生纯合型AA比较。结果显示,广西红水河流域长寿家系子女中等位基因C携带者TC水平为(5.17±0.88)mmol/L,高于不携带者的(5.00 ± 0.92)mmol/L(F=5.073,P <0.05);分层后比较得出,长寿家系第2代子女组中携带等位基因C的个体TC水平(5.22±0.93)mmol/L比不携带者(4.98±0.96)mmol/L 也有更高(F=4.276,P <0.05),第 1代子女中血脂与基因型比较差异无统计学意义(P>0.05);非长寿家系子女中,除了第1代子女组中携带等位基因 C的个体HDL水平(1.80±0.37)mmol/L比不携带者的(1.67±0.42)mmol/L均更高(F=6.526,P <0.05)外,其余组间基因型和血脂之间比较差异则无统计学意义(P均>0.05)。
3 讨论
广西红水河流域巴马地区以长寿著称,因此我们对本地区长寿壮族家系子女的一般情况进行了研究。本次研究结果得出,该地区长寿家系长寿老人子女的收缩压、TC、LDL水平均高于对照组,分层后发现第1代子女血压、TC、TG、LDL水平均高于对照组,而第2代子女除了LDL水平高于对照组外,其余指标差异无统计学意义。这与Vaarhorst小组[8]研究的莱顿长寿人群子女有低的TG水平不同,和Barzilai等[9]研究的长寿子女血脂水平也不一致。长寿是基因和环境多因素产生的结果,不同的长寿人群在长寿机制上存在一定特异性。广西红水河流域特殊的地理环境、饮食和文化背景,可能是导致长寿家系拥有高的血脂水平但长寿的原因所在。
ACAT1基因位点rs1044925突变存在明显的种族差异,据文献报道,国内外主要群体突变C等位基因频率存在差异。Wollmer等[10]研究的中部和南部欧洲人的突变频率是35.4%;Wu等[7]研究的中国广西白裤瑶族的突变频率是21.0%,明显高于本次研究壮族长寿子女的突变频率的11.7%和12.7%,与我们研究结果一致的有 Wu等[7]报道广西南丹汉族人群突变频率是12.7%。本次研究结果显示,长寿子女组与对照组的基因型和等位基因频率比较差异无统计学意义(P均>0.05),这与赵发国等[11]研究的中国汉族北方正常人群和阿尔茨海默病人群的突变频率(分别是9.7%、9.3%)及李琴等[12]研究的中国汉族成都地区健康人群和高脂血症人群的突变频率(分别是13.7%、15.3%)均无差异性一致。这表明该基因位点对长寿影响较小,突变频率的可能与不同和种族、地域、饮食、文化等多因素有关。
高血脂是导致冠心病、脑卒中、糖尿病等老年性疾病的重要危险因素,进而可影响人类寿命。ACAT1在调节机体胆固醇酯代谢中的起着重要作用。到目前为止,国内外报道的ACAT1多态性位点最常见的有 3个,分别是 R526G、-77G>A、rs1044925。Ohta等[13]报道的日本人群中R526G的变异不会影响血脂水平,而-77G>A的变异个体有更高的 HDL-C和 ApoA1水平;相比而言,位点rs1044925对血脂的影响不同实验室得出结果不一。本次研究结果显示,对照组第1代子女中等位基因C携带者比不携带者有更高的HDL水平,这与Wu等[14]研究的高脂血症患者男性等位基因C携带者比不携带者有更高的HDL水平一致,不同于李琴等[12]报道的中国汉族内源性高甘油三酯血症患者AA基因型携带者比C等位基因携带者有更高的HDL-C水平和Wu等[14]报道中国广西白裤瑶族女性等位基因C携带者有更低的TC、LDL-C水平。而本次研究的长寿总人群和分层后第2代子女中等位基因C携带者比不携带者则有更高的TC水平,和上述研究群体的结果均不一致,血脂水平受多种因素影响,不同的地理环境、饮食和生活习惯对血脂也有极大影响。广西红水河流域巴马地区自古以来以长寿著称,特殊的地理环境、饮食和生活习惯可能是造成研究结果的特殊性的原因所在,需要我们进一步加大样本数量、多因素综合分析以及增加多重对照是我们后续研究的方向。
综上所述,ACAT1 rs1044925多态性与广西红水河流域壮族长寿家系子女无相关性,但是此基因多态性可以影响血脂水平,可能通过影响血脂水平来影响人类寿命。
[1]Chang TY,Chang CC,Cheng D.Acyl-coenzyme A:cholesterol acyltransferase[J].Annu Rev Biochem,1997,66(1):613-638.
[2]Coses S,Novak S,Zheng Y,et al.ACAT-2,a second mammalian acyl-CoA:Cholesterol acyltransferase[J].J Biol Chem,1998,273(41):26755-26764.
[3]Anderson RA,Joyce C,Davis M,et al.Identification of a form of acyl-CoA:cholesterol acyltransferase specific to liver and intestine in nonhuman primates[J].J Biol Chem,1998,273(41):26747-26754.
[4]Chang CCY,Sakashita N,Ornvold K,et al.Immunological quantitation and localization of ACAT-1 and ACAT-2 in human liver and small intestine[J].J Biol Chem,2000,275(36):28083-28092.
[5]Lee RG,Willingham MC,Davis MA,et al.Differential expression of ACAT1 and ACAT2 among cells within liver,intestine,kidney,and adrenal of nonhuman primates[J].J Lipid Res,2000,41(12):1991-2001.
[6]Bryleva EY,Rogers MA,Chang CCY,et al.ACAT1 gene ablation increases 24(S)-hydroxycholesterol content in the brain and ameliorates amyloid pathology in mice with AD[J].Proceedings of the National Academy of Sciences,2010,107(7):3081-3086.
[7]Wu DF,Yin RX,Aung LH,et al.Polymorphism of rs10449925 in the acyl CoA:cholesterol acyltransferase-1 gene and serum lipid levels in the Guangxi Bai Ku Yao and Han populations[J].Lipids Health Dis,2010(9):139.
[8]Vaarhorst AAM,Beekman M,Suchiman EHD,et al.Lipid metabolism in long-lived families:the Leiden Longevity Study[J].Age,2011,33(2):219-227.
[9]Barzilai N,Atzmon G,Schechter C,et al.Unique lipoprotein phenotype and genotype associated with exceptional longevity[J].JAMA,2003,290(15):2030-2040.
[10]Wollmer MA,Streffer JR,Tsolaki M,et al.Genetic association of acyl-coenzyme A:cholesterol acyltransferase with cerebrospinal fluid cholesterol levels,brain amyloid load,and risk for Alzheimer's disease[J].Mol Psychiatr,2003,8(6):635-638.
[11]赵发国,王荫华,陈彪,等.乙酰辅酶A:胆固醇乙酰转移酶基因单核苷酸多态性与散发性阿尔茨海默病的相关性研究[J].中国神经免疫学和神经病学杂志,2005,12(5):283-286.
[12]李琴.正常中国人及内源性高甘油三酯血症患者酰基辅酶A:胆固醇酰基转移酶基因多态性的研究[J].中华医学遗传学杂志,2008,25(2):206-210.
[13]Ohta T,Takata K,Katsuren K,et al.The influence of the acyl-CoA:cholesterol acyltransferase-1 gene(-77G→A)polymorphisms on plasma lipid and apolipoprotein levels in normolipidemic and hyperlipidemic subjects[J].Biochim Biophys Acta,2004,1682(1):56-62.
[14]Wu DF,Yin RX,Aung LHH,et al.Sex-specific association of ACAT-1 rs1044925 SNPand serum lipid levels in the hypercholesterolemic subjects[J].Lipids Health Dis,2012,11(1):9.

