SD大鼠骨髓基质干细胞体外诱导成骨分化实验研究
曾铁功,赵晋英,黄泽智
(邵阳医学高等专科学校,邵阳市分子生物学重点实验室,湖南邵阳422000)
伤残肢体的完美修复,一直是人类的梦想,以干细胞工程为代表的现代组织工程学无疑为人类提供了新的期望[1]。骨髓基质干细胞(BMSCs)是存在于骨髓中的一类具有自我更新和多向分化潜能的干细胞,在体内外适当的诱导条件下可分化为骨、软骨、脂肪、神经等多种组织。BMSCs移植具有简单、实用、费用低和无免疫排斥等优点,成为目前解决大块骨缺损修复最有前景的手段之一[2]。2012年1~8月进行本实验,旨在探讨BMSCs这类种子细胞成骨分化的条件,为后期骨组织修复工程研究提供实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 4周龄清洁级SD大鼠8只,由南华大学实验动物中心提供。
1.1.2 主要试剂 DMEM-LG培养基(美国 Gibco公司),胎牛血清(FBS,杭州四季青生物公司),胰酶(北京鼎国生物公司),BCIP/NBT碱性磷酸酶(ALP)染色试剂和MTT试剂(北京鼎国生物公司),茜素红(天津大茂化学试剂厂)。
1.2 方法
1.2.1 BMSCs的分离及体外培养 运用全骨髓贴壁法。清洁级4周龄SD大鼠,脱颈处死;75%乙醇浸泡10 min,剥离双股骨表面组织;无菌DMEM冲洗,剪断骨两端后,大号注射器吸取DMEM液(10%FBS,100 U/mL青霉素、100μg/mL链霉素和20 U/mL肝素)冲洗髓腔;收集骨髓于一离心管,反复吹打,180 g×5 min离心;下层细胞层经DMEM液混匀后接种于25 mL培养瓶,置于37℃、5%CO2、饱和湿度培养。48 h首次换液,以后3 d换液1次。待细胞密度达80%,弃培养液;用PBS轻冲3遍,加入2.5 g/L胰蛋白酶消化、传代。传代时细胞接种密度1×104/cm2,收集第3代细胞备用,随机分为实验组及对照组。
1.2.2 成骨诱导液配制 在DMEM培养液中加入地塞米松(Dex)1×10-7mol/L、β-甘油磷酸钠10 mmol/L和Vit-C 1×10-6mol/L,诱导实验组BMSCs向成骨细胞分化。
1.2.3 细胞生长观察 在倒置显微镜下观察细胞形态,镜检拍照。
1.2.4 细胞爬片ALP染色 在6孔板上每孔滴少量培养基,无菌操作每孔放入1张预处理的盖玻片;按1×104/cm2接种第3代BMSCs,补足含10%FBS的DMEM培养液2.5 mL/孔;待贴壁2 d后,实验组换成骨诱导液继续培养,以后3 d换液1次。分别在第3、6、10天,取出玻片经预冷 PBS洗2遍,冷4%多聚甲醛固定20 min;PBS冲洗后,用BCIP/NBT试剂37℃染色30 min;水洗,脱水透明,中性树胶封片后镜检。蓝色颗粒为阳性染色,镜检拍照。对照组不加诱导液,细胞爬片染色同实验组。
1.2.5 MTT比色法绘制细胞生长曲线 哺乳动物活细胞与噻唑蓝作用后产生紫色结晶,用二甲基亚砜溶解结晶后,在波长570 nm处测定该溶液光吸收值,可间接反映活细胞增殖能力。以1×104/cm2接种细胞于96孔板,实验组每孔加入200μL诱导液,对照组加等量基础培养液。置5%CO2孵箱中培养,3 d换液1次。每天取1板,用MTT法测每孔吸光度值,共8 d。以时间为横坐标,吸光度均值为纵坐标绘制细胞生长曲线。
1.2.6 成骨钙化茜素红染色 6孔板上实验组与对照组连续培养13 d后,细胞爬片行茜素红染色。4%多聚甲醛固定30 min,水洗;茜素红染色30 min,脱水透明,封片后镜检。矿化结节被染成深红色。
1.2.7 统计学方法 采用SPSS11.5统计软件。数据用±s表示,计量资料组间比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 细胞生长增殖、形态变化 培养的大鼠原代BMSCs 24~36 h开始贴壁,48~72 h贴壁细胞呈短梭形;4~5 d时细胞集落明显,细胞主要为短梭形成纤维样细胞,部分为多边形上皮样细胞,另外混杂圆形的非贴壁细胞,经换液逐渐清除。原代细胞生长较慢,10 d后细胞汇合达80%以上。传代细胞4~6 h迅速贴壁、伸展,恢复梭形,10 h左右细胞呈均匀生长,形态较为一致,以细长梭形为主。5~6 d后融合为单层,长满瓶底,培养过程中未见明显白色结节形成。实验组在成骨诱导条件下,细胞在培养过程中向梭性、多角形转化,有的带有数个突起,排列渐变不规则。细胞生长逐渐密集融合成团,10 d左右呈复层生长,形成多层细胞;以后逐渐形成多个散在的岛状致密细胞群,呈旋涡状,中间细胞排列紧密模糊,逐渐形成白色钙化结节。插页Ⅱ图4。
2.2 细胞生长曲线 对照组BMSCs传代接种第1天后细胞数量即开始增加,第4天增加幅度最大,至第7天细胞数量最大,以后数量略有下降,未出现指数增长期。传代培养对数增殖期为2~6 d,第7天细胞生长缓慢,进入平台期。实验组经成骨诱导的BMSCs增殖速度明显落后于前者,也未出现指数增长期。见图1。
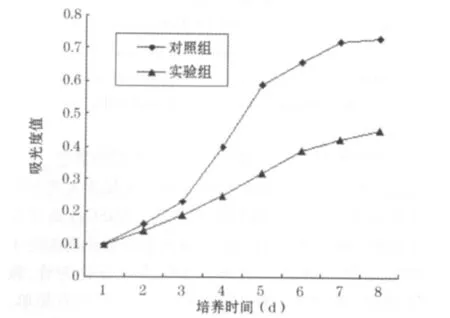
图1 细胞生长曲线
2.3 细胞爬片ALP染色 对照组阳性细胞较少,呈稀疏条索状;而实验组诱导后阳性细胞数随时间的延长明显增多,镜下见大部分细胞质内有蓝色颗粒状或片状沉淀,见封三图5。第10天,随机取10个视野计算结果显示,实验组ALP染色阳性率为88.34% ±8.65%,而对照组为28.14% ±5.38%,P <0.01。
2.4 成骨钙化茜素红染色情况 实验组第13天可见橘红色的钙结节,为茜素红与钙盐形成的橘红色复合物。对照组几乎无色。见封三图6。
3 讨论
本实验通过对大鼠BMSCs分离纯化、体外培养和诱导分化的研究,为BMSCs作为骨组织工程的种子细胞提供实验室依据。目前分离纯化BMSCs的方法主要有4种,即全骨髓贴壁法、密度梯度离心法、流式细胞仪和免疫磁珠法[3,4]。本实验采用全骨髓贴壁法,该法操作简便,仅通过换液和传代筛选,便可获得较多BMSCs,且早期保留了骨髓中的其他成分,可为BMSCs的生长创造了良好的环境。在本实验中,培养的原代细胞8~10 d便可贴壁生长连接成片,形态主要为短梭形成纤维样细胞。原代细胞生长较慢,传代细胞生长快,细胞形态较为一致。传代5~6 d后可融合为单层,长满瓶底。BMSCs原代和传代培养细胞生长特性,与国内外文献报道基本一致[5,6]。
部分体外培养的BMSCs能自发分化为成骨细胞,但大部分不表达或低表达ALP,分泌的钙含量也很低,要想其稳定地向成骨分化,需加以诱导[7]。本实验参考Coelho等的方法,通过加入Dex、β-甘油磷酸钠、Vit-C对BMSCs进行体外诱导[8]。实验发现,常规培养BMSCs增殖较快;经诱导后增殖速度显著下降,细胞汇合时间明显延长,进一步证明了适当浓度的Dex抑制BMSCs的增殖[9]。这也提示要想获得分化细胞的稳定增长,接种细胞的基数要有保证。本实验中诱导后细胞大多向梭性、多角形转化,排列渐变不规则,细胞生长逐渐密集;10 d左右呈复层生长,以后逐渐形成多个散在的岛状致密细胞群,中间细胞排列紧密模糊,形成白色钙化结节。其原因可能为诱导液中Dex促进胞外胶原合成[10];β-甘油磷酸钠可为BMSCs分化和增殖提供磷原子,促进生理性钙盐沉积;Vit-C也促进胶原合成,增加钙盐沉积等[11]。但本实验中钙结节形成时间与文献报道有差异[8],这可能与细胞接种密度及3种诱导剂浓度差异有关。
在细胞培养中,ALP是成骨细胞分化的早期指标,是成骨细胞标志酶之一[12];而骨矿化结节可作为成骨细胞分化的中期指标,被认为在维持正常骨钙化率和抑制软骨钙化中起作用[11]。因此,本实验采用这两项基本指标,考察分化细胞的成骨特性。在实验时发现,常规培养BMSCs仅有少量ALP阳性细胞,培养10 d时仅占28.14% ±5.38%,茜素红染色未发现钙化结节;而诱导的BMSCs,ALP阳性细胞随时间的延长明显增多,10 d阳性率达88.34% ±8.65%,在13 d时有显著密集的钙化结节。这表明Dex、β-甘油磷酸钠、Vit-C体外诱导BMSCs向成骨细胞分化良好,并已获得成熟成骨细胞的表型特征。
综上所述,本实验所采用的体外分离培养法,经Dex、β-甘油磷酸钠、Vit-C 联合诱导后,BMSCs能稳定地向具有成骨细胞特征的细胞分化,并能体外成骨,可作为成骨细胞的一种来源,但在真正应用于临床之前还有许多亟待解决的问题[13,14],仍需进一步通过动物体内实验来证实它的稳定性和安全性。
[1]Shekkeris AS,Jaiswal PK,Khan WS.Clinical applications of mesenchymal stem cells in the treatment of fracture non-union and bone defects[J].Curr Stem Cell Res Ther,2012,7(2):127-133.
[2]Aldahmash A,Zaher W,Al-Nbaheen M,et al.Human stromal(mesenchymal)stem cells:basic biology and current clinical use for tissue regeneration[J].Ann Saudi Med,2012,32(1):68-77.
[3]刘巧云,易黎.骨髓基质细胞分离培养、体外向神经细胞诱导分化及其在中枢神经系统疾病中的研究进展[J].神经损伤与功能重建,2010,5(2):139-142,146.
[4]Srouji S,Ben-David D,FromiguéO,et al.Lentiviral-mediated integrinα5 expression in human adult mesenchymal stromal cells promotes bone repair in mouse cranial and long-bone defects[J].Hum Gene Ther,2012,23(2):167-172.
[5]李雪峰,刘亮,王东.大鼠骨髓间充质干细胞体外向成骨细胞分化培养的生物学特性[J].中国组织工程研究与临床康复,2011,15(23):4185-4188.
[6]Grässel S,Stöckl S,Jenei-Lanzl Z.Isolation,culture,and osteogenic/chondrogenic differentiation of bone marrow-derived mesenchymal stem cells[J].Methods Mol Biol,2012,879:203-267.
[7]Abdallah BM,Kassem M.Human mesenchymal stemcells:frombasic biology to clinical applications[J].Gene Ther,2008,15(2):109-116.
[8]Coelho MJ,Fernandes MH.Human bone cell cultures in biocompatibility testing.Part Ⅱ:effect of ascorbic acid,beta-glycerophosphate and dexamethasone on osteoblastic differentiation[J].Biomaterials,2002,21(11):1095.
[9]Rickard DJ,Sullivan TA,Shenker BJ,et al.Induction of rapid osteoblast differentiation in rat bone marrow stromal cell cultures by dexamethasone and BMP-2[J].Dev Biol,1994,161(1):218-228.
[10]Kumar S,Ponnazhagan S.Mobilization of bone marrow mesenchymal stem cells in vivo augments bone healing in a mouse model of segmental bone defect[J].Bone,2012,50(4):1012-1018.
[11]Hicok KC,Thomas T,Gori F,et al.Development and characterization of conditionally immortalized osteoblast precursor cell lines from human bone marrow stroma[J].JBone Miner Res,1998,13(2):205-217.
[12]Marom R,Shur I,Solomon R,et al.Characterization of adhesion and differentiation markers of osteogenic marrow stromal cells[J].JCell Physiol,2005,202(1):41-48.
[13]郑瑜谦,袁芳,闫福华,等.冻存骨髓基质细胞复合材料体内成骨基质的合成能力[J].中国组织工程研究与临床康复,2011,15(12):2275-2278.
[14]Kodama A,Kamei N,Kamei G,et al.In vivo bioluminescence imaging of transplanted bone marrow mesenchymal stromal cells using a magnetic delivery system in a rat fracture model[J].JBone Joint Surg Br,2012,94(7):998-1006.

