抗人结缔组织因子人源单链抗体的筛选、表达及活性鉴定
周 云,包 林,金 秋,张 黎,蔡雪婷,卢悟广,曹 鹏,焦永军,张建平
(1南京医科大学第二附属医院,南京210011;2卫生部肠道病原微生物重点实验室,江苏省疾病预防控制中心病原微生物研究所;3江苏省中医药研究院细胞与分子生物学实验室)
结缔组织生长因子(CTGF)是典型CCN家族(Cyr61,CTGF,Nov)中的一员,其主要功能有促进细胞的迁徙、黏附、细胞外基质(ECM)的生成以及调节细胞周期、分化、伤口的愈合[1]。CTGF存在于许多人体组织中,主要由皮肤成纤维细胞、肾小球系膜、肝星状细胞、肺成纤维细胞、血管平滑肌细胞等合成分泌[2]。CTGF具有明显的有丝分裂原性和趋化性,可以调节成纤维细胞和系膜细胞外基质的分泌,在多种组织器官(如肾、肝、肺、皮肤等)纤维化的进程中起重要作用[3~5]。除了促进一些组织器官纤维化外,CTGF在恶性肿瘤的发生、发展和侵袭、转移中发挥重要作用[6~9]。目前,针对 CTGF的单克隆抗体治疗胰腺癌已应用于裸鼠的体内实验,其对糖尿病肾病的治疗也进入一期临床试验,都取得了良好的效果。因此,CTGF的特异性抗体应用于临床治疗具有广阔的前景。2012年4~10月,我们通过噬菌体展示技术筛选出了高亲和力的抗CTGF单链抗体,为临床CTGF相关疾病的研究和靶向治疗奠定基础。
1 材料与方法
1.1 材料 人源ScFv抗体文库由本实验室建立并保存;重组人源TGF(rh-CTGF)购自英国PeproTech公司,大肠杆菌XLI-Blue、Top10F'、辅助噬菌体VCSM13购自Stratagene公司;HRP标记的抗M13抗体购自GE Healthcare公司,质粒抽提试剂盒购自德国Qiagen公司,SV40 MES13(小鼠肾小球系膜细胞)购自中科院细胞库,MHCC97H肝癌细胞系购自复旦大学医学院肝癌研究所。Millicell(8μm,24孔细胞培养板)购自美国Millipore公司,基质胶购自美国BD公司。
1.2 方法
1.2.1 抗CTGF噬菌体抗体的筛选 将含有人源ScFv基因的抗体库质粒 ScFv-pComb3xSS电转化XL1-Blue大肠杆菌,加辅助噬菌体M13KO7超感染制备噬菌体抗体文库;把该文库加入到包被有rh-CTGF酶标板中,37℃孵育2 h;PBST充分洗涤后,用Glycine-HCl(pH 2.2)洗脱。扩增阳性噬菌体抗体克隆,并进行下一轮筛选。共进行3轮筛选。计算每一轮筛选的洗脱与投入克隆的比例,观察筛选的富集程度。
1.2.2 CTGF特异性抗体克隆的鉴定 第3轮筛选后获得的噬菌体抗体克隆感染XLI-Blue后直接铺板(含氨苄青霉素),37℃培养过夜。次日共挑200个单克隆分别置于LB培养基中,加入VCSM13辅助噬菌体超感染制备单克隆噬菌体抗体。离心后把含噬菌体抗体的上清液加入包被有rhCTGF的96孔酶标板,37℃孵育2 h;洗涤后加入HRP标记抗M13二抗,37℃孵育1 h;充分洗涤后加入HRP底物,室温作用30 min;每孔加H2SO4终止反应,于450 nm测吸光度。阳性克隆抽提噬粒DNA,对其编码ScFv的基因片段测序。
1.2.3 ScFv阳性克隆的表达、纯化 经 Phage-ELISA和DNA测序鉴定的阳性克隆,将其噬粒转化大肠杆菌Top10F'进行表达。挑单菌落置10 mL LB培养基(含氨苄青霉素)37℃培养过夜。次日用1 000 mL LB培养基1∶100稀释过夜培养物,37℃培养约6 h至A600nm=1.0,加入终浓度为1 mmol/L的IPTG,25℃ 诱导过夜。离心收集菌体沉淀,用6His亲和层析Binding buffer重悬后置超声波破碎菌体;离心取上清,过0.45μm微孔滤膜,进行镍柱亲和层析纯化。纯化的蛋白行SDS-PAGE观察纯度。用含8 mol/L尿素的Binding buffer重悬后,置超声波破碎菌体;超声裂解后,加1%Triton-100乳化;再次离心后收集上清,上His Trap亲和层析柱进行纯化;将洗脱目的蛋白稀释10倍后,用含有尿素的透析液进行透析复性,复性的尿素浓度梯度依次为 4、2、1、0.5、0.25、0.125 mmol/L(pH 7.5);透析完成后超滤管3 000 g浓缩蛋白,测定浓度后进行SDS-PAGE分析。
1.2.4 ScFv结合活性的鉴定 采用ELISA法。用rhCTGF包板,加入重组ScFv抗体分子,同时用肠道病毒71型病毒(EV71)特异性ScFv作为阴性对照,于37℃孵育2 h;充分洗涤后,加入HRP标记的抗6His标签抗体(表达的抗 rhCTGF和抗 EV71的ScFv均带有6His标签),37℃孵育1 h;充分洗涤后,加底物室温显色30 min,加入1 mol/L H2SO450 μL/孔终止反应。以空白孔调零,在酶标仪读A450nm值。
1.2.5 Millicell迁移和侵袭实验 大量研究表明,肾小球系膜细胞可在多种因素影响下改变CTGF的表达量,且其细胞膜表面的CTGF受体使其对胞外活化CTGF的浓度相当敏感[10,11]。因此,我们选用小鼠肾小球系膜细胞的Millicell迁移实验来验证胞外活化CTGF浓度。小鼠肾小球系膜细胞SV40 MES13在不含血清的DMEM/F12(3∶1)培养基内饥饿12 h,胰酶消化后用含0.1%FBS DMEM/F12培养基重悬细胞,按1.0×105/100μL加入上室。下室加入 600μL含 rhCTGF(550 ng/mL)+CTGF ScFv抗体(0、10、50、100 μg/mL)的 0.1%FBS DMEM/F12培养基,以EV71 ScFv作为抗体的阴性对照,以BSA作为CTGF的空白对照,常规培养20 h。棉签拭去上室内细胞,把膜风干,0.1%结晶紫染色10~30 min;显微镜下计数迁移细胞,计算迁移率(rhCTGF刺激组迁移率计为100%)。将基质胶按40μL/孔均匀地铺在 Millicell膜上,37℃成胶30 min,置紫外灯照射过夜。待培养的肿瘤细胞消化、计数,分别用空白、含EV71 ScFv 50μg/mL、含CTGF ScFv 50μg/mL DMEM无血清培养液(含0.1%BSA)稀释处理;2.0×105个细胞分别接种到铺有基质胶的上室内,下室加入5%FBS/DMEM,常规培养24 h,其余步骤同迁徙实验。
2 结果
2.1 抗体文库的筛选 以rhCTGF包板进行3轮循环的吸附—洗脱—扩增,其洗脱与投入克隆的比例在逐轮升高(表1),说明CTGF特异性抗体克隆在不断地富集。
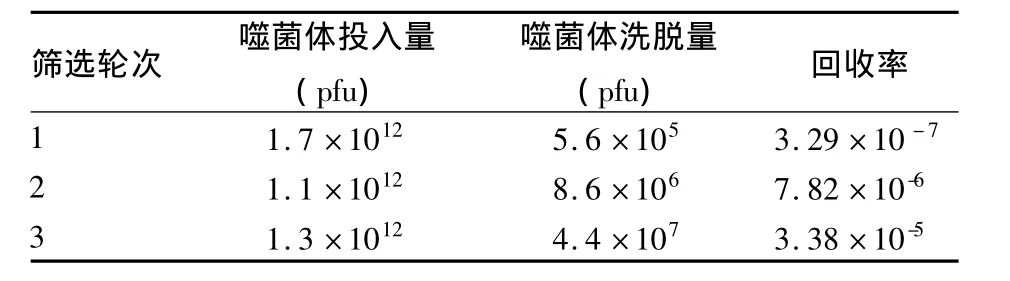
表1 ScFv抗体文库对rhCTGF的富集筛选
2.2 Phage-ELISA和阳性克隆测序 随机挑取的200个克隆,第3轮筛库洗脱克隆中有8个克隆Phage-ELISA 阳性,分别 1C5、1B9、1E2、2B4、2C10、2E9、2F5、2H1,其 A450nm值分别为 1.3、1.0、1.1、1.1、0.9、0.8、1.3、1.1,阴性对照为 0.1;DNA 测序结果表明这8个克隆为同一个克隆,被命名为1C5,其序列具有单链抗体特点。
2.3 单链抗体1C5的表达、纯化 1C5的可溶性表达只存在于菌体中,用硫酸镍亲和层析柱进行纯化,在SDS-PAGE上其相对分子量约为34 kD,其最终表达产量可达5 mg/L。见插页Ⅱ图1。
2.4 ELISA检测1C5与CTGF的结合活性 与空白及阴性对照(A450nm分别为0.08和0.14)相比,1C5的A450nm为1.33,说明其能与CTGF有很好的结合。
2.5 1C5 ScFv对CTGF功能的抑制作用 经过饥饿12 h的小鼠肾小球系膜细胞在rhCTGF的诱导下可以增强迁徙性而向下室移动。下室中1C5 ScFv在3个浓度梯度下中和rhCTGF活性,与空白对照相比,10、50、100 μg/mL 依次降低至 54.3%、14.7%、13.3%,确定1C5 ScFv浓度50 μg/mL 为小鼠肾小球系膜细胞Millicell迁移实验适宜浓度。
2.6 Millicell迁移实验 将下室含rhCTGF 550 ng/mL的迁移率定为100%,而空白对照(BSA)的迁移率仅为3.5% ±0.5%。1C5 ScFv(50 μg/mL)抑制了rhCTGF对细胞的刺激作用,其迁移率降为14.7% ±2.6%,而抗 EV71的 ScFv对 rhCTGF则无抑制作用,细胞迁移率为80.1% ±5.6%,说明1C5对CTGF具有中和作用。
3 讨论
CTGF最早由Bradham等[12]用亲和色谱法在人脐静脉内皮细胞条件培养基中发现的,是一种相对分子量为38 kD的富含半胱氨酸分泌性生长因子,属于即刻早期基因、高度保守的CCN多肽家族。CTGF有4个主要蛋白结构区:胰岛素样生长因子结合蛋白区、von Willebrand因子C型重复区、血小板反应蛋白1型重复区以及生长因子半胱氨酸群[13],由多个功能单位组成。CTGF通过截断不同结构域而在体内有多种存在形式,且多种因素调节CTGF的表达[14],因此,其发挥生物学作用的机制较为复杂。
大量研究表明,CTGF在肿瘤的生长和转移中主要通过TGF-β通路发挥作用[15],但这并非其所有机制。CTGF的其他结构域通过与各种生长因子及细胞表面受体之间的相互作用,促进肿瘤的生长和转移。结构域Ⅰ可以结合胰岛素样生长因子Ⅰ/Ⅱ,结构域Ⅱ可以结合VEGF,结构域Ⅳ可以结合类肝素硫酸蛋白聚糖和结合素类。因此,CTGF作用于其他生长因子及细胞表面受体而影响肿瘤的发生与发展。我们前期的研究发现,高转移的肝细胞肝癌细胞系MHCC97H表达较高的CTGF[15],其Millicell侵袭实验显示对照组细胞侵袭率为97% ±6.1%,而处理组显著下降至36% ±4.7%(空白对照侵袭能力设为100%)。通过体内、体外实验抑制CTGF的表达可以降低肝细胞肝癌的增殖,进而纯化CTGF特异性抗体做进一步研究。本研究中我们通过体外实验证实纯化出的ScFv结合CTGF的特定结构域,以抑制其促细胞迁徙能力。下一步研究将通过鉴定本株ScFv针对的结构域来确定CTGF促细胞迁徙的具体结构域。
抗体介导的靶向治疗,是肿瘤生物治疗最具潜能的治疗手段。目前,单纯依赖抗体的靶向治疗主要机制有拮抗作用、抗体依赖的细胞介导的细胞毒性作用(ADCC)、补体依赖的细胞毒性作用(CDC);体外的Millicell迁移实验证实,纯化的ScFv具有拮抗活性,通过对ScFv全分子化可以刺激机体产生免疫应答,通过ADCC和CDC等多种机制协同效应特异性杀伤肿瘤细胞。由于肿瘤的抗体靶向治疗需要多次给药,人体对鼠源、嵌合抗体极易产生抗体,从而影响单克隆抗体治疗效果;我们筛选人源ScFv抗体文库得到全人源抗体,由其得到的全分子化抗体将很好地解决了这一问题。
本研究通过体外实验验证了制备的单链抗体可以特异性靶向CTGF,且能中和其活性,具有应用于临床治疗的潜能。但能否通过特异性抗CTGF抗体降低组织器官微环境中CTGF的表达,进而阻碍组织器官纤维化的进展和影响肿瘤的转移侵袭,还需要接下来的动物实验及临床病例对照试验来进一步研究。
[1]Braig S,Wallner S,Junglas B,et al.CTGF isoverexpressed in malignant melanoma and promotes cell invasion and migration[J].Br J Cancer,2011,105(2):231-238.
[2] Chaqour B,Goppelt-Struebe M.Mechanical regulation of the Cyr61/CCN1 and CTGF/CCN2 proteins[J].FEBS J,2006,273(16):3639-3649.
[3]Ponticos M,Holmes AM,Shi-Wen X,et al.Pivotal role of connective tissue growth factor in lung fibrosis:MAPK-dependent transcriptional activation of type I collagen[J].Arthritis Rheum,2009,60(7):2142-2155.
[4]Cheng O,Thuillier R,Sampson E,et al.Connective tissue growth factor is a biomarker and mediator of kidney allograft fibrosis[J].Am JTransplant,2006,6(10):2292-2306.
[5]Paradis V,Dargere D,Vidaud M,et al.Expression of connective tissue growth factor in experimental rat and human liver fibrosis[J].Hepatology,1999,30(4):968-976.
[6]Lai KB,Sanderson JE,Yu CM.The regulatory effect of norepinephrine on connective tissue growth factor(CTGF)and vascular endothelial growth factor(VEGF)expression in cultured cardiac fibroblasts[J].Int JCardiol,2013,163(2):183-189.
[7]De Marco P,Bartella V,Vivacqua A,et al.Insulin-like growth factor-I regulates GPER expression and function in cancer cells[J].Oncogene,2013,32(6):678-688.
[8]Pi L,Shenoy AK,Liu J,et al.CCN2/CTGF regulates neovessel formation via targeting structurally conserved cystine knot motifs in multiple angiogenic regulators[J].FASEB J,2012,26(8):3365-3379.
[9]Chien W,O'Kelly J,Lu D,et al.Expression of connective tissue growth factor(CTGF/CCN2)in breast cancer cells is associated with increased migration and angiogenesis[J].Int JOncol,2011,38(6):1741-1747.
[10]李学刚,刘海英,柳刚,等.高糖环境对人肾小球系膜细胞表达结缔组织生长因子及其受体蛋白的影响[J].山东大学学报(医学版),2011,49(6):99-102,106.
[11]张俊,刘晓城,周文祥,等.姜黄素对大鼠肾系膜细胞结缔组织生长因子表达的影响[J].华中科技大学学报(医学版),2006,35(1):99-102.
[12] Bradham DM,Igarashi A,Potter RL,et al.Connective tissue growth factor:a cysteine-rich mitogen secreted by human vascular endothelial cells is related to the SRC-induced immediate early gene product CEF-10[J].JCell Biol,1991,114(6):1285-1294.
[13]Holbourn KP,Acharya KR,Perbal B.The CCN family of proteins:structure-function relationships[J].Trends Biochem Sci,2008,33(10):461-473.
[14]杨敏,黄海长,王海燕.结缔组织生长因子促纤维化作用及其表达调节的研究进展[J].中国病理生理杂志,2005,21(1):199-202,208.
[15]Jia XQ,Cheng HQ,Li H,et al.Inhibition of connective tissue growth factor overexpression decreases growth of hepatocellular carcinoma cells in vitro and in vivo[J].Chin Med J(Engl),2011,124(22):3794-3799.

