利用PCB碱性蚀刻废液制备高纯度纳米铜粉
罗小虎,陈世荣, *,杨琼,汪浩,谢金平,吴耀程,梁韵锐
(1.广东工业大学轻工化工学院,广东 广州 510006;2.广东致卓精密金属科技有限公司,广东 佛山 528300)
与普通铜粉相比,纳米级铜粉具有高导电率、较强的催化能力以及较强的光效应等优越性能,其用于复合材料也表现出优越的物理和化学性能,因此受到研究者的普遍关注,并成为用途广泛的无机材料之一。另外,由于纳米铜价格低廉,因此在导电浆料行业中,纳米铜已经慢慢取代了银、金、钯等一些传统的纳米贵金属。目前,纳米铜的制备方法很多,有激光辐射法[1]、乳液合成法[2]、超临界合成法[3]、真空沉积法[4]、液相还原法[5-6]等。液相还原法的应用最广,因该法工艺简单、条件易控、合成效率高,且对设备要求不高。
目前,绝大多数印制电路板(PCB)线路都是利用蚀刻液按工程的设计进行蚀刻而成的,故产生大量的蚀刻废液。在碱性蚀刻废液中含有大量铜,其主要是以[Cu(NH3)4]2+形式存在,同时也含有大量NH3·H2O、Cl-等。随意丢弃蚀刻废液不仅严重污染环境,而且浪费大量的铜[5]。近几年来,研究者针对PCB 制造过程中产生的蚀刻废液有用物质的回收已经提出一些有效的方法,例如电沉积法、化学沉淀法、萃取-电沉积法等,然而这些方法普遍存在工艺复杂、回收率不高、耗费较高以及回收物性价比不高等缺点,限制了其在该行业的大规模使用。据此,本文以PCB 碱性蚀刻废液为原料,采用液相化学还原法制备高纯度超细纳米铜。
1 实验
1.1 主要试剂
所用试剂均为分析纯;NaOH,成都市科龙化工试剂厂;KBH4,成都市科龙化工试剂厂;N2H4·H2O 质量分数为80%,成都市科龙化工试剂厂;聚乙烯吡咯烷酮(PVP,分子量5 000~10 000),天津市大茂化学试剂厂;十六烷基三甲基溴化铵(CTAB),天津市大茂化学试剂厂;二次蒸馏水(自制);碱性蚀刻废液,广东某电路板制造有限公司;真空旋转蒸发仪,江苏姜堰市新康仪器厂。
1.2 纳米铜粉的制备
(1) 取10 mL 碱性蚀刻废液进行过滤,除去悬浮物和沉淀杂质,将滤液转移到100 mL 烧杯中作反应溶液A。
(2) 根据需要配制不同浓度的KBH4、N2H4·H2O溶液各100 mL,作还原溶液B,再向B 溶液中加0.2 g CTAB 和0.3 g PVP。即反应液组成为:PVP 0.003 g/L,CTAB 0.002 g/L,KBH4或N2H4·H2O 适量。
(3) 将混合B 溶液放入恒温水浴中,开启磁力搅拌。
(4) 将A 溶液缓慢滴加到B 溶液中,控制每分钟加10 mL,待反应完全(60 min)后,离心过滤得到铜粉。
(5) 先用蒸馏水将铜粉洗4~5 次,再用无水乙醇洗涤数次,最后用旋转蒸发仪干燥。
1.3 性能测试
用GGX-698 型原子吸收分光光度计(AAS,日本津岛)测定碱性废液和反应后滤液中铜的质量浓度。
用Ultima III X-射线衍射仪(XRD,日本理学)分析试样的构相,Cu 靶,Kα 辐射。根据Schemer 公式计算铜粉的粒径(d):
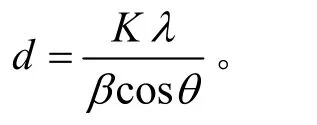
式中,λ=1.540 5 Å,为本实验的衍射角辐射波长;K=0.89 为常量;β为半波高的线宽;θ为衍射角。
用S-3400 扫描电镜(SEM,日本理学)观察产品的形貌;用 STA-409-PC 热重分析仪(TG,德国NETZSCH)、UV2450 紫外可见分光光度计(UV,日本岛津)和Vertex70 红外可见分光光度计(FT-IR,德国BRUKER)对产物组成进行表征。
2 结果与讨论
2.1 碱性蚀刻废液中的铜含量
采用原子吸收分光光度法测定碱性蚀刻废液中铜含量时,由于铜是以[Cu(NH3)4]2+形式存在,因此要先对其进行硝化,使其以Cu2+状态存在,再将原溶液稀释20 万倍,测得的标准曲线见图1。由图1得到标准曲线方程:
y=0.068 4x+ 0.010 2。
式中,y为吸光度,x为铜的质量浓度。按上式算得同一批样品中铜含量的5 次测量值为:136.000、142.000、126.000、138.133 和140.200 g/L。为减少相对误差,取平均值136.467 g/L 作为碱性废液中的铜含量。
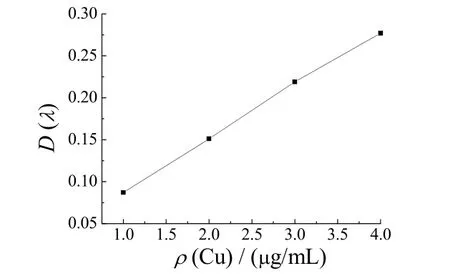
图1 碱性蚀刻废液中铜离子含量的标准曲线Figure 1 Standard curve for copper ion content in spent alkaline etching solution
2.2 制备条件对反应产物的影响
2.2.1 还原剂种类
图2是以KBH4作还原剂时,在不同温度下反应60 min 所得试样的XRD 谱图。其中,n(KBH4)∶n{[Cu(NH3)4]2+}=1∶4。
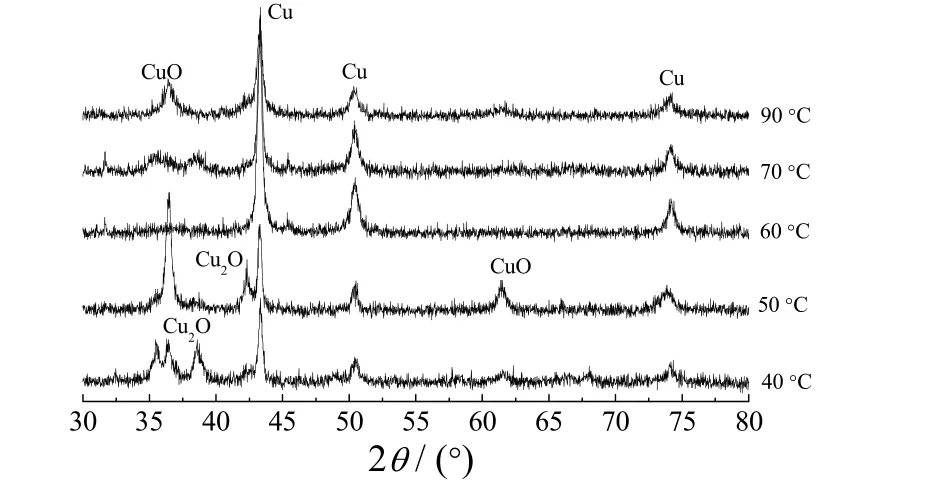
图2 以KBH4为还原剂时在不同温度下所得试样的XRD 谱图Figure 2 XRD patterns for the samples obtained at different temperatures using KBH4 as reductant
从图2可知,以硼氢化钠作还原剂时,在40~90 °C温度范围内制得的粉体中,除含单质铜外,还含有氧化铜或氧化亚铜。随反应温度升高,氧化亚铜、氧化铜的含量均不断减少,但这2 种物质始终存在。因此,在此体系中用KBH4作还原剂制得的物质不是纯单质铜。
图3是以水合肼为还原剂,且n(N2H4·H2O)∶n{[Cu(NH3)4]2+}=1∶2 时,在不同温度下所得试样的XRD 谱图。
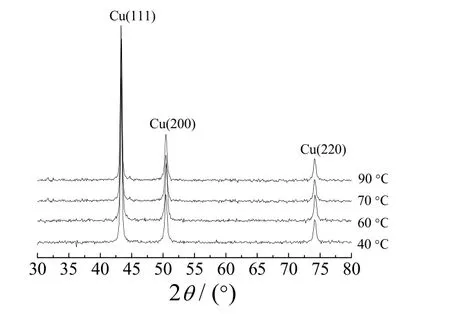
图3 以N2H4·H2O 为还原剂时在不同温度下所得试样的 XRD 谱图Figure 3 XRD patterns for the samples obtained at different temperatures using N2H4·H2O as reductant
从图3可知,以水合肼作还原剂时,最终产物是纯铜粉,不含CuO、Cu2O 等杂质。从图3还可看出,不同温度下所得试样XRD 谱图中的3 个特征衍射峰对应金属铜晶体的(111)、(200)、(220)特征晶面,与JPCDS 给出的标准值非常吻合;衍射峰很尖锐,说明制备的粉体结晶性很好,颗粒的尺寸也很小。根据衍射峰半波高的线宽度β,采用Schemer 公式算得铜粉粒度为40~100 nm,因此,在40~90 °C 下得到的产物均为纯相纳米铜。下文均以水合肼为还原剂制备纳米铜粉。
2.2.2 反应温度
图4为n(N2H4·H2O)∶n{[Cu(NH3)4]2+}=1∶2 时,在不同温度下所得铜粉的形貌。从图4可知,虽然在不同反应温度下产物的纯度都非常高,但颗粒的形貌相差很大。对比可知,体系反应温度为70 °C 时,得到的颗粒均为球状,且尺寸均一性最好。

图4 不同反应温度下所得纳米铜粉的SEM 照片Figure 4 SEM images of copper nanoparticles obtained at different temperatures
2.2.3 还原剂用量
还原剂用量对产物颗粒度、分散性和形貌的影响如图5所示。随还原剂比例增大,颗粒直径减小,分散性也变好。当还原剂水合肼与碱性蚀刻废液的摩尔比高于1∶3 时,纳米铜的粒径也达到稳定。这是因为体系的还原速率影响原子之间的成核关系。体系中只有少量原子存在时,原子的运动必定会使原子之间发生碰撞而形成一个稳定核心,但这种状态很不稳定,核与核之间碰撞会形成更稳定、更大的核。体系一旦成核,核之间的生长优先朝核晶生长而形成晶体。且在给定反应体系中含有分散剂,在分散剂作用下所有核基本上同时以相同速率生长。因此,还原反应初期的核数目决定了晶核尺寸和晶核数。水合肼含量较小时,碱性蚀刻废液中的[Cu(NH3)4]2+在反应初期被还原的速率较慢,形成的核也不多,反应后期无新核生成,核之间呈团聚生长。水合肼含量高时,[Cu(NH3)4]2+的还原速率远远大于成核速率,在Cu 原子成核之前,[Cu(NH3)4]2+中的二价铜几乎已全部生成Cu 原子,故增大还原剂用量,成核速率不会增大,核数目保持不变,即使水合肼与[Cu(NH3)4]2+的摩尔比继续增大,铜颗粒的尺寸也变化不大。因此,n(N2H4·H2O)∶n{[Cu(NH3)4]2+}以1∶3~1∶1 为宜。

图5 溶液中还原剂N2H4·H2O 与[Cu(NH3)4]2+的摩尔比不同时所得纳米铜粉的SEM 照片Figure 5 SEM images of copper nanoparticles obtained from the solution at different molar ratio of N2H4·H2O as reductant to [Cu(NH3)4]2+
2.2.4 反应时间
图6为70 °C下,体系反应时间对纳米铜颗粒尺寸、分散性和形貌的影响。

图6 反应不同时间所得纳米铜粉的SEM 照片Figure 6 SEM images of copper nanoparticles with different reaction time
反应30 min 时,颗粒的尺寸、分散性都较好,而且随反应时间延长,颗粒由单一的球状变成含有片状的颗粒。这是因为,当反应时间延长时,体系中晶核在不断相互碰撞中长大。实验中还发现,当反应时间低于30 min 时,反应得到产物中有少量Cu2O,这是由于在反应初期,整个反应未进行完全,部分已还原得到的纳米铜又与未反应的Cu2+反应生成Cu2O。
2.3 产物的紫外、红外、TG/DTA 分析
在70 °C、n(N2H4·H2O)∶n{[Cu(NH3)4]2+}=1∶1下反应30 min,对产物进行分析。
图7为产物的UV 谱图。从图7可知,产物的UV谱图只在波长510 nm 处有一个较小的吸收峰,可直观地认为反应得到的物质只有纯相铜粉,不存在其他杂质。上述紫外特征吸收峰与有关文献[7]报道的纳米铜颗粒标准吸收峰在570 nm 处有一定偏差,可能因为在纳米铜表面包裹了一层有机分散剂PVP 和CTAB,造成吸收峰发生蓝移。
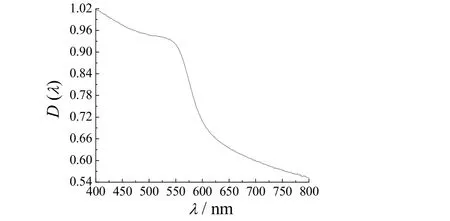
图7 产物的UV 谱图Figure 7 UV spectrum for the product
为进一步求证体系中的表面分散剂、保护剂是否吸附在纳米铜颗粒表面,对制备得到的铜粉进行红外表征,结果见图8。从图8可知,3 440 cm-1波长处的吸收峰对应N─H 的伸缩振动,1 630 cm-1处的吸收峰对应N─H的弯曲振动,1 300 cm-1为C─N的伸缩振动,在2 920 cm-1和2 840 cm-1处的吸收峰为C─H 伸缩振动,1 150 cm-1处的吸收峰为C─OH 伸缩振动。可见PVP 和CTAB 确实吸附于纳米铜表面。这2 种物质在纳米铜的制备过程中既起分散颗粒的作用,也有保护铜颗粒表面的作用,阻止纳米铜被空气中的氧所氧化。
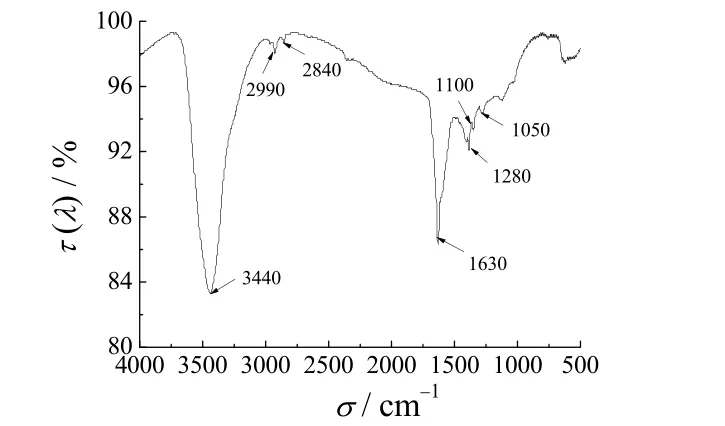
图8 产物的FT-IR 谱图Figure 8 FT-IR spectrum for the product
图9为产物的TG/DTA曲线,升温速率为10 °C/min。
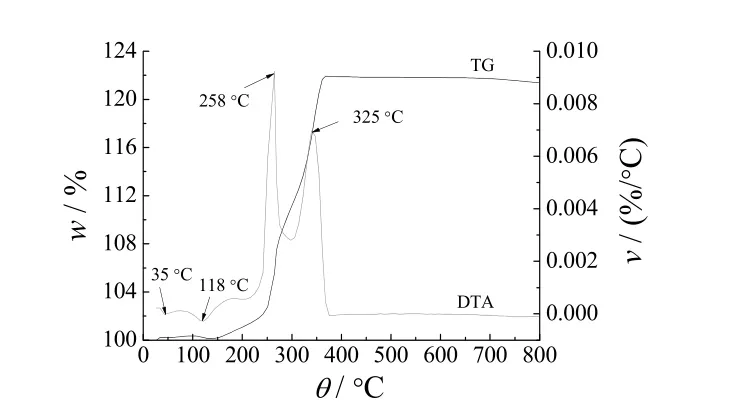
图9 产物的TG/DTA 曲线Figure 9 TG/DTA curves for the product
从图9可知,250 °C 之前,样品质量的增加较慢,250 °C 后质量迅速增大,400 °C 后质量达到稳定。约50 °C 时,产物有一个很小的吸热峰,由加热过程中产物含有的微量无水乙醇吸热挥发所产生;125 °C 左右时,产物又有一个较小的吸热峰,是由吸附在纳米铜颗粒表面的有机物吸热挥发而产生;在260 °C 附近有一个大的放热峰产生,是Cu 在加热时与空气中的氧反应生成Cu2O 所致;325 °C 附近的放热峰,其产生的原因之一是Cu2O 与空气中的氧继续反应生成稳定的CuO,另一原因是纳米Cu 与空气中氧反应直接生成CuO。由此可见,制备出来的纳米铜有较高的抗氧化性能。
2.4 对碱性蚀刻废液的处理效果
表1为反应前、后滤液中的铜含量及其回收率。
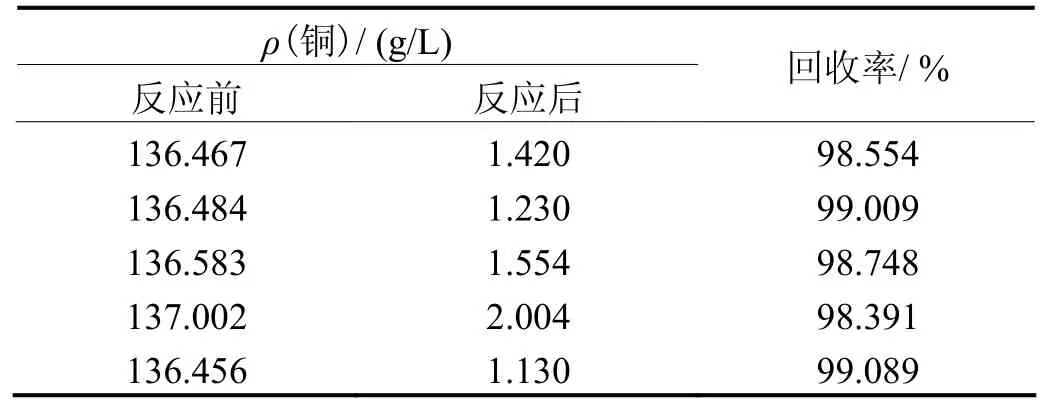
表1 反应后滤液中铜的浓度Table 1 Concentration of copper in filtrate after reaction
从表1可知,采用化学还原法回收蚀刻废液中的铜,回收率在98%以上且稳定性较好,远远高于采用其他回收方法,未出现大的误差。反应后滤液中的铜含量基本上都在2 mg/L 以下,滤液均无色澄清。
3 结论
(1) 以碱性蚀刻废液为原料,采用液相化学还原法制备出高纯度、高抗氧化性能的超细纳米铜粉,对蚀刻废液中铜的回收率为98%以上。
(2) 制备纳米铜粉的最佳还原剂为水合肼,最优工艺条件为:PVP 0.003 g/L,CTAB 0.002 g/L,n(N2H4·H2O)∶n{[Cu(NH3)4]2+}=1∶3,反应温度70 °C,反应时间30 min。该工艺条件下制得的纳米铜为球状,粒径在100 nm 范围内,纯度高,抗氧化性好。
[1]HU W P,MATSUMURA M,FURUKAWA K,et al.Oxygen plasma generated copper/copper oxides nanoparticles [J].The Journal of Physical Chemistry B,2004,108 (35):13116-13118.
[2]HUANG K,GUO J,XU Z M.Recycling of waste printed circuit boards:A review of current technologies and treatment status in China [J].Journal of Hazardous Materials,2009,164 (2/3):399-408.
[3]CHEN T Y,CHEN S F,SHEU H S,et al.Reactivity of laser-prepared copper nanoparticles:Oxidation of thiols to disulfides [J].The Journal of Physical Chemistry B,2002,106 (38):9717-9722.
[4]TANORI J,PILENI M P.Control of the shape of copper metallic particles by using a colloidal system as template [J].Langmuir,1997,13 (4):639-646.
[5]DHAS N A,RAJ C P,GEDANKEN A.Synthesis,characterization,and properties of metallic copper nanoparticles [J].Chemistry of Materials,1998,10 (5):1446-1452.
[6]VITULLI G,BERNINI M,BERTOZZI S,et al.Nanoscale copper particles derived from solvated Cu atoms in the activation of molecular oxygen [J].Chemistry of Materials,2002,14 (3):1183-1186.
[7]WU S H,CHEN D H.Synthesis of high-concentration Cu nanoparticles in aqueous CTAB solutions [J].Journal of Colloid Interface Science,2004,273 (1):165-169.

