FHIT 在宫颈上皮内瘤变和宫颈癌中的表达
戈丽薇,王月,高志安
(辽宁医学院,辽宁 锦州 121000)
在女性恶性肿瘤中,宫颈癌已经成为危害全球妇女健康的主要杀手,其发病率和病死率仅次于乳腺癌,位居世界水平第二位。因此,提高宫颈癌患者的早期诊断、预后判断和治疗的准确性,是目前妇科临床工作的重点和难点。1992 年WHO 宣布人乳头瘤病毒(HPV)是引起宫颈癌的首要因素,然而大量临床病例也证实并非全部HPV 感染者都会发展成为宫颈上皮内瘤变或者宫颈癌。其中仅有少数会发生上皮内瘤变;发展到宫颈癌的则更少。不仅如此,宫颈癌的发病年龄高峰远迟于HPV 感染者年龄高峰。因此,在HPV 感染的基础之上,宫颈癌的发生仍然具有选择性。宫颈癌的发生还会有一些因素与HPV 感染起到协同作用。脆性组氨酸三联体基因(Fragile histidine triad,FHIT)是ohta 等[1]在1996 年利用定位克隆技术及外显子捕获法,在染色体3p 区域找到一个新的抑癌基因。该基因覆盖染色体3p 上的脆性位点FRA3B,肾细胞癌相关性断裂点t (3;8)以及HPV16 整合位点,位于染色体3p14.2 区域,FHIT 基因在众多的人类肿瘤组织和细胞系中,FHIT 表现为高频缺失或者异常转录,其作用途径可能是参与DNA 的修复、细胞凋亡和细胞周期调控。一些学者,如Hendricks[2]Greenspan[3]以及Wistuba[4]等研究预测FHIT 基因缺失或者异常转录与HPV 感染可能对宫颈癌发生起协同作用的,其实验结果均表明FHIT 基因与致瘤型HPV 感染有着明显的相关性。然而也有一些学者在研究中并没有发现HPV 感染状态与FHIT 基因异常之间存在明显相关性。因此,宫颈癌中HPV 感染与FHIT 基因异常之间的相关情况,目前并没有一致性意见。本实验采用免疫组化法以及原位杂交法分别检测宫颈癌及其癌前病变组织中FHIT 蛋白和HPV16/18 DNA表达情况及其相关性。
1 材料与方法
1.1 材料
1.1.1 标本来源 10 例正常宫颈组织,39 例上皮内瘤变(cervical intraep ithelial neoplasia,CIN),50例原发性浸润性宫颈鳞癌(invasive cervical neoplasia,ICC)病例全部选自辽宁医学院附属第一医院病理科存档的2009 年1 月至2011 年12 月的石蜡标本。其中,ICC 病例全部是资料完整、术前未经治疗的病例。患者年龄32~65 岁,平均年龄46.8 岁。CIN 各级均选取10 例,对照组为因子宫肌瘤等行子宫全切术,术后病理证实为正常宫颈者。
1.1.2 主要试剂 兔抗人FHIT 多克隆抗体、柠檬酸抗原修复液(0.01 M,pH6.0)、浓缩型DAB试剂盒、S-P 染色试剂盒、磷酸盐缓冲液(0.01 M,pH7.2~7.4)、HPV16/18 原位杂交检测试剂盒等试剂均购自北京中杉金桥生物有限公司。
1.2 方法
1.2.1 免疫组织化学检测 以PBS 代替一抗为阴性对照,以已知蛋白表达阳性的组织作为阳性对照。
1.2.2 原位杂交法 以PBS 代替HPV16/18DNA探针作为阴性对照,以已知正常宫颈组织作为阳性对照。
1.2.3 免疫组化实验步骤严格按照试剂盒要求操作 原位杂交步骤如下:原位杂交试剂盒为北京中杉金桥有限公司产品。切片常规脱蜡,乙醇逐级脱水干燥,PBS 缓冲液冲洗;胃酶37 ℃孵育30 min,PBS 冲洗3 次,每次3 min;加DNA 探针,加盖玻片,95 ℃变性5 min,37 ℃杂交12 h,PBS 缓冲液浸泡10 min,去盖玻片;除外阳性对照,切片加杂交后洗液,37 ℃孵育30 min,PBS 冲洗3 次,每次3 min;加辣根酶标记抗地高辛抗体,37 ℃孵育30 min,PBS 冲洗,每次3 min;DAB 显色,苏木素复染,乙醇逐级脱水后透明、封片。
1.3 结果判断
1.3.1 免疫组化结果判定 FHIT 蛋白免疫组化染色阳性产物呈棕黄色颗粒,定位于细胞核中。按照Mattern 等提到的方法,从两方面进行半定量评分:(1)按染色细胞的百分比评分。未见染色细胞为0分,染色细胞<25% 为1 分,染色细胞25%~50%为2 分,染色细胞>50%为3 分; (2)按染色深浅度评分:无显色为0 分,浅棕黄色为1 分,棕黄色为2 分,棕褐色为3 分;将这两方面评分相加记总分(0~6 分)。每例评分均为高倍(400×)镜下观察10 个视野求得的平均分。评分1~2分为“+”,3~4 分为“+ +”,5~6 分为“+ ++”。>2 分者为阳性表达,≦2 分者为阴性表达。
1.3.2 原位杂交结果判定 HPV 阳性病毒颗粒染成棕黄色于细胞核内,连续观察10 个高倍视野,计数细胞核呈棕黄色的阳性细胞,以阳性细胞数>10%判断为阳性。
1.4 统计学处理 应用SPSS12.0 软件,χ2检验,Spearman 等级相关性分析进行统计学分析处理。
2 结 果
2.1 FHIT 蛋白表达、HPV16/18 DNA 在宫颈病变中的表达 FHIT 蛋白定位于细胞核中,呈棕色或者棕黄色,弥漫性表达,尤其明显见于上皮细胞。HPV16/18 DNA 也定位于细胞核中,FHIT 及HPV16/18 在各级组织中的表达情况见表Ⅰ。不同宫颈病变组织中组间两两比较见:FHIT 蛋白阳性表达正常组与CINⅠ之间没有明显的差异(P =0.481);正常组与CINⅡ~Ⅲ之间具有明显差异(χ2=4.012,P=0.045);正常组与ICC 有明显差异(χ2=18.989,P =0.000);CINⅠ与CINⅡ~Ⅲ组之间没有明显的差异(P =0.269);CINⅠ与ICC 之间有明显的差异(χ2=13.630,P=0.000);CINⅡ~Ⅲ与ICC 有明显差异(χ2=10.690,P =0.001)。HPV 病毒阳性表达率在不同宫颈病变组织中组间两两比较见:正常组织与CINⅠ之间没有明显的差异(P =0.096);正常组织与CINⅡ~Ⅲ之间有明显的差异(χ2=4.012,P =0.045);正常组织与ICC 组间有明显的差异(χ2=5.182,P=0.023);而宫颈病变各组间并无明显差异(χ2=0.464,P=0.793)。
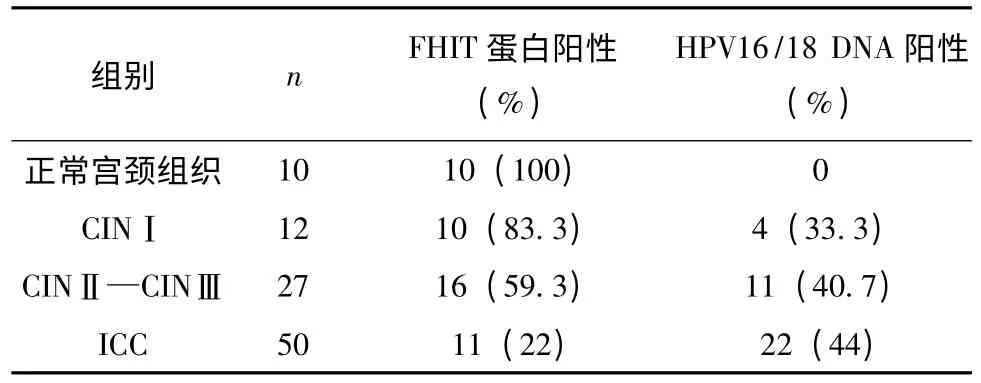
表1 不同宫颈组织中FHIT 蛋白、HPV16/18 DNA 表达
2.2 FHIT 蛋白表达与HPV16/18 DNA 检测 宫颈病变组织中FHIT 蛋白与HPV16/18 病毒表达关系见表2。经过Spearman 等级相关性分析,FHIT 蛋白表达与HPV16/18 病毒感染呈现明显负相关关系,随着宫颈病变的不断加深,在伴有HPV 阳性感染的情况下,FHIT 蛋白表达明显减少(r =-0.446,P=0.006)。

表2 宫颈病变组织中FHIT 蛋白与HPV16/18 病毒表达关系
3 讨 论
在1996 年FHIT 被发现以来,大量的研究发现FHIT 在正常上皮组织表现为强表达。而在大量上皮性肿瘤中却存在着表达缺失或者是异常表达,尤其在与环境致癌因素关系密切的恶性肿瘤中存在明显异常。FHIT 可能参与DNA 的修复、细胞凋亡和细胞周期调控。在宫颈癌组织中,人们也进行了大量的研究,FHIT 位于染色体3p14.2 区域,覆盖染色体3p 上的脆性位点FRA3B,肾细胞癌相关性断裂点t (3;8)以及 HPV16 整合位点。Hendricks等[2]2112-2115学者应用RT-PCR 技术研究宫颈癌细胞,检测到有63%的细胞系出现异常的FHIT 转录产物,多为多个外显子的缺失,mRNA 长度缩短。在其相关实验中,在DNA 水平发现80%的异常细胞存在FHIT 结构异常。Greenspan 等[3]4692-4698学者研究也显示,高达6/7 宫颈癌细胞系和68%的原发宫颈癌检测不到FHIT 转录产物,亦或是检测到异常产物,在免疫组化试验中也显示出近有76%的原发癌FHIT 蛋白表达明显缺失或减弱,蛋白表达与异常转录之间有很好的相关性。因此,FHIT 的异常表达在宫颈癌中是频发事件,提示FHIT 基因改变是宫颈癌的发生发展中的频发事件。本实验的研究结果也表明,随着正常宫颈组织-CIN 各级-宫颈癌的发展演变,FHIT 蛋白阳性表达率明显降低。
引起皮肤粘膜的多种增生性病变,是一组具有高度特异性的嗜上皮性DNA 病毒。在宫颈癌病变的发生过程中,HPV 感染途径开始于宫颈鳞状上皮的基底层,通过损伤粘膜或微缺损进入基底细胞。HPV DNA 在宿主细胞中常常以两种状态存在:在癌前期组织中,病毒常位于染色体之外,形成整合状态。在癌细胞中,病毒DNA 则形成染色体外的附加体状态,以单拷贝或多拷贝串联方式整合于宿主细胞DNA 中,引起HPVE2 基因缺失。由于HPVE2 基因具有抑制HPVE6、E7 基因启动的功能,从而导致E6、E7 基因表达异常,细胞生长失控。钱建华等通过对大量病例的研究认为HPV 感染还存在着总感染率的地区、优势型别以及种属的差异性,其中高危型HPV (HPV16/18 型等)感染是引发宫颈癌的重要原因之一。这在本实验资料中也显示HPV16/18 DNA 阳性多见于CIN 各级及宫颈癌中。
Wistuba 等[4]3154通过对大量宫颈癌及宫颈上皮内瘤变病例的研究发现,FHIT 基因的缺失不仅见于56%的浸润癌,还见于20%的高级别CIN 中,并随着级别的增高其缺失所占有的比例上升。张文淼等实验中也发现FHIT 蛋白的表达情况在宫颈CIN 和宫颈癌中均有表达下降或者缺失情况的存在。他们还发现,HPV16 阳性的CIN 及宫颈浸润癌病例中,65%存在FHIT 基因的杂合性缺失(Loss of Heter LOH),同时有87%的FHIT 蛋白表达减弱或缺失的病例为HPV16 阳性,从而推测FHIT 基因表达与HPV16/18 感染之间具有一定相关性。本次实验结果也表明,经过Spearman 等级相关性分析,FHIT 蛋白表达与HPV16/18 病毒感染呈现明显负相关关系(r=-0.446,P=0.006)。
[1]Ohta M,Inoue H,Cotticelli MG,et al.The FHIT gene,spanning the chromosome3p14.2 fragile site and renal carcinomaassoc iated t (3;8)breakpoint,is abnormalin digestive tractcancers[J].Cell,1996,84:587-597.
[2]Hendricks DT,Taylor R,Reed M,et al.FHITgene expression in human ovarian,endometrial,and cervical cancer cell lines[J].Cancer Res,1997,57:2112-2115.
[3]Greenspan DL,Connolly DC,Wu R,et al.Loss of FHIT expression in cervical carcinoma cell lines and primary tumors[J].Cancer Res,1997,57:4692-4698.
[4]Wistuba Ⅱ,Motellano FD,Milchgrub S et al.Deletions of chromosome 3p are frequent and darly events in the pathogenesis of uterine cervical caicinoma [J].Cancer Res,1997,57(15):3154

