三种腰椎后路椎间融合植骨材料的临床对比研究
任东林,林 飞,胡天翼,胡晓亮,陈德玉
后路腰椎椎间融合术是当今腰椎融合术的主 流[1-6],但对其植骨材料的选择久未达成统一。据统计,各种材料融合成功率为40%~100%[7-8]。本文回顾分析使用3 种常用植骨材料行腰椎椎间融合手术患者1 121 例,通过长期随访,在植骨融合率、融合时间、椎间高度变化、内固定失败等方面进行比较,并对其中骨质疏松患者180 例进行专门对比分析。
1 资料与方法
1.1 临床资料
本研究录入2001 年3 月~2011 年4 月,行腰椎后路椎间植骨融合患者共1 121 名,男692 例,女429 例,年龄为22~69 岁,平均56.3 岁(基本资料见表1)。其中腰椎椎间盘突出症778 例,腰椎椎滑脱症102 例,腰椎椎管狭窄症(不伴腰椎滑脱)241例。756 例患者为单节段,276 例为双节段,89 例为3 个节段或以上。患者均有不同程度的根性症状,790 例有腰部和下肢疼痛,294 例主诉间歇性跛行,186 例有不同程度肌肉萎缩,48 例出现马尾症状。
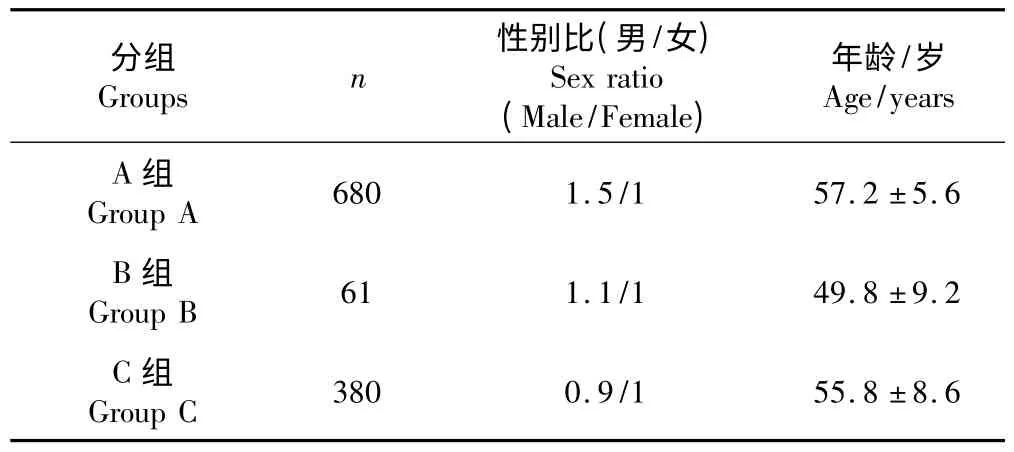
表1 3 组患者临床资料Tab.1 Clinical materials of patients in 3 groups
所有病例按椎间植骨材料分为:自体三面皮质髂骨块680 例(A 组),同种异体骨块61 例(B 组),融合器(Cage)+ 自体松质骨颗粒380 例(C 组)。骨质疏松患者诊断方法:根据术前检查时尿钙升高程度及骨密度分析报告诊断是否为骨质疏松症或严重骨质疏松症。共计180 例患者伴有骨质疏松症:A 组有79 例,B 组19 例,C 组82 例。
1.2 影像学分析
术前常规行X 线(正侧位、过伸过屈位)及MRI检查,结合病史明确诊断。X 线检查评估腰椎稳定性、滑脱程度、椎间高度等;通过MRI 评价椎间盘突出的程度方向,黄韧带增生等情况,结合病史、查体所见确定责任节段。
1.3 手术技术
手术适应证包括:①非手术治疗3~6 个月无效;②疼痛难以忍受,严重影响生活质量;③肌力下降明显,逐渐加重;④马尾综合症;患者俯卧位,常规腰后路暴露,所有患者均行病变节段椎弓根螺钉钉棒系统固定。依据患者病情选择腰椎后路椎间融合(posterior lumbar interbody fusion,PLIF)或经椎间孔入路椎体间融合术(transforaminal lumbar interbody fusion,TLIF),PLIF 减压范围包括双侧全椎板减压(切除至双侧小关节内侧缘)、单侧开窗、扩大开窗。高位节段患者及椎间孔狭窄者采用切除患侧小关节的TLIF。充分减压后,选择上述3 种植骨材料之一行椎间融合,C 形臂X 线透视机确认内固定及植骨位置良好后,常规逐层缝合,关闭切口。
手术所用椎弓根螺钉钉棒系统由美国枢法模公司或法国Eurios 公司提供;椎间融合器(Cage)采用枢法模公司产品,融合器内填充骨颗粒取自手术切除的椎板或关节突;自体骨块为取自患者本人髂嵴三面皮质骨,同种异体骨为征得患者及伦理委员会同意后取自其他手术患者。
1.4 随访及评价
术后第3 天行正侧位X 线检查;术后3 个月首次复诊,常规行正侧位、过伸过屈位X 线检查,并判断如下情况:①植骨融合情况;②内固定断裂、移位、塌陷、脱落情况;③测量椎间高度。对于X 线下植骨显影不清者进一步行CT(三维重建)检查以明确植骨融合情况。3 个月随访未融合者,此后每个月复诊,达到融合者,则此后6 个月、1 年定期随访。
植骨融合标准:过伸过屈位X 线片提示无椎间活动、并可见植骨块或Cage 上下界面及周边有骨桥形成。2 mm 薄层CT 扫描,冠状位及矢状位重建确认有连接上下终板的骨桥形成。
1.5 统计学方法
利用SPSS 软件(13.0 版本)进行统计学分析。采用χ2检验分析植各组骨融合率、并发症发生率差异,采用方差分析评价各组椎间高度及融合时间差异。
2 结 果
所有患者平均随访2.8 年,各组平均随访时间:A 组3.5 年,B 组2.8 年,C 组2.1 年。各组骨质疏松患者平均随访时间:A 组3.7 年,B 组2.9 年,C组2.5 年。
植骨融合、内固定失败、椎间高度丢失、植骨融合时间等情况见表2。B 组(见图1)61 例中,11 例患者(18.5%)出现植骨不融合,断钉6 例,断棒2例;该组在植骨融合率、内固定失败率、椎间高度丢失、融合时间等方面较其他2 组差(P<0.05)。A组(见图2)和C 组(见图3)2 组间比较,前者在植骨融合率、内固定失败率、植骨融合时间方面占优,后者在维持椎间高度方面占优,但2 组间差异并无统计学意义(P >0.05)。
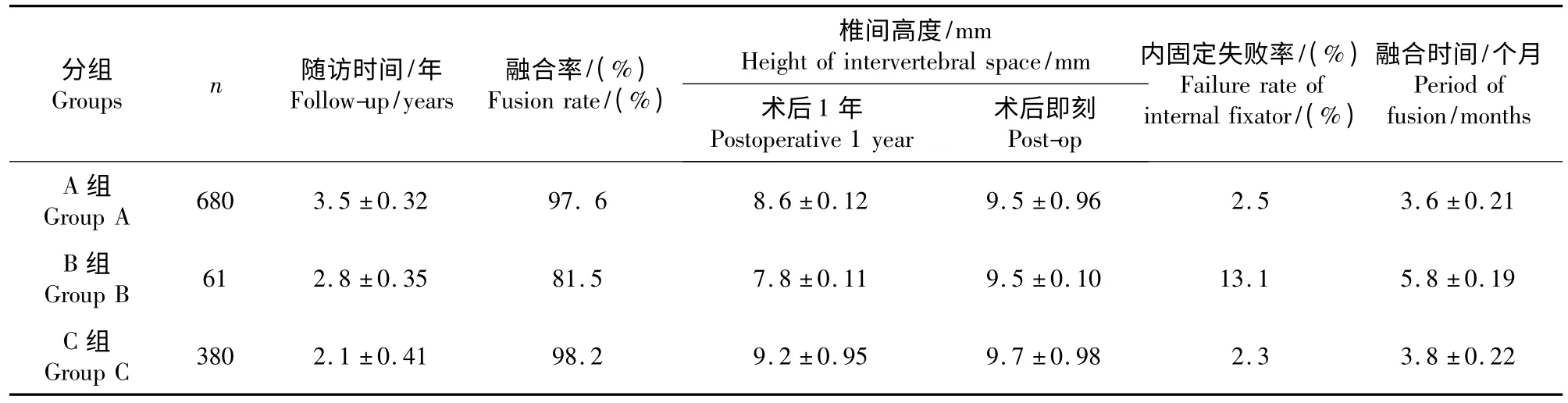
表2 3 组结果比较Tab.2 Comparsion of outcomes of patients in 3 groups

图1 B 组典型病例影像学资料(L5 峡部裂;椎间异体骨植骨术后4 个月断棒,仅翻修更换内固定)Fig.1 Radiologic data of a typical patient in Group B(L5 spondylolithesis;rod was broken 4 months after PLIF with allogeneic bone;a secondary operation was performed replacing instruments)

图2 A 组典型病例影像学资料(L4 峡部裂I 度滑脱,椎间自体髂骨块植骨)Fig.2 Radiologic data of a typical patient in Group A(L4 spondylolisthesis accepting PLIF with autologous iliac bone)
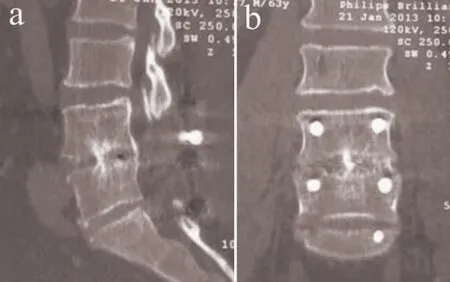
图3 C 组典型病例影像学资料(L4/L5 椎间盘突出)Fig.3 Radiologic data of a typical patient in Group C(L4/L5 disc herniation)
在骨质疏松患者中(见表3),B 组各随访指标均最差(与其他2 组比较,P<0.05),A 组与C 组相比融合时间(A 组5.4 个月,C 组6.3 个月)更短,融合率更高(A 组90.3%,C 组84.6%),差异有统计学意义(P<0.05)。
3 讨 论
3.1 现状及争议
腰椎椎间融合术始于20 世纪40 年代[9-10],之后得以广泛应用。相比椎板间、横突间植骨,椎体间植骨可同时提供前、中柱的支持,植骨融合率更高,且容易在X 线片上辨别,具有不可比拟的优势[1,3,11-12],是腰椎融合的首选。通过PLIF 或TLIF 2 种方式实现椎体间融合已经成为目前最常用的手术方式。
虽然对于腰椎椎间植骨方式的认识已取得原则上的统一,但是在植骨材料的选择上一直争议不断。对常用的椎间植骨材料包括同种异体骨、自体髂骨块及Cage+自体松质骨,报道植骨融合成功率差异很 大(40%~100%不等)[7-8,13-14],其主要原因是前期研究普遍样本量较小,缺乏大宗的多中心对照研究;另外争议的重要原因与植骨融合标准不统一有关[5,15-16],早期研究大多采用FDA 的X 线标准:即伸屈位活动<5°,植骨界面无透光带,无植骨块移位。此标准只能说明植骨稳定,并不能完全确认植骨融合,且由于X 线本身的精确度限制,某些透光缝隙难以发现。三维CT 分辨率更加精确,但大多只能反映静态情况,对伸屈位的动态观察不够;此外,年龄、骨质疏松、是否应用内固定、是否加入骨诱导因子等“干扰”因素造成对比基线的不均衡也是造成争议的原因。针对以上问题,本研究协同其他2 家医院,回顾11 年来1 121 例患者的临床及影像学资料,利用X 线及CT 检查随访,探讨不同材料对椎间植骨成功率的影响,并对骨质疏松患者进行专门对比分析。通过大样本量研究,为解决相关争议提供有力的证据支持,对于指导临床个体化选择手术方案具有一定参考价值。
3.2 植骨材料的选择
理想的植骨材料具有3 种属性。①骨传导性:既要为血管的再生和新骨的形成提供一个静态、牢靠的支架,又要对骨组织保持适当的压力负载,以促进骨小梁的重塑。②骨诱导性:具有活力的成骨诱导蛋白,能够刺激植骨区周围的间充质干细胞向软骨细胞或成骨细胞分化,形成新骨;③成骨作用:内含足够数量的骨原细胞(成骨细胞或者骨祖细胞),在合适的条件下能够生长增殖。
同种异体骨在一定的历史阶段有其重要的使用价值。在椎间融合器出现之前,常作为椎间植骨材料[17-18],可有效避免自体骨供骨区并发症。但相比自体骨,异体骨常见免疫排斥、易诱发炎症反应是其先天不足;经储存加工后使用,骨诱导活性降低;骨吸收发生率高,负载能力较差。本研究结果显示,同种异体骨在植骨融合率、融合时间皆差于其他2 组,与之相应的,内固定失败率最高(P<0.05)。同种异体骨融合效率较为低下,并发症较多,且有材料来源不足、移植环节繁琐,加工费用较高等局限性,因此现阶段不推荐临床应用。

表3 3 组中骨质疏松患者结果比较Tab.3 Comparsion of outcomes of patients with osteoporosis in 3 groups
自体骨移植是一种经典的的椎间植骨方式,自20 世纪40 年代即被应用,其优点为[1,9,19-21]:①术中活体取骨,无加工存储环节,方便快捷。②无排异反应。③材料新鲜,骨诱导活力较强,④弹性模量最接近生理状态。⑤造价省、费用低。其缺点主要为供区疼痛、出血、髂骨骨折等。有学者报道供骨区并发症发生率高达50%,但其不良后果轻微,大多可通过改进取骨技术解决[22-23]。
自1988 年,人工椎间融合器(Cage)逐渐出现。几十年来,Cage 在工学设计、材质应用等方面历经数代改进,得以广泛应用。其优点有[5,15,24-25]:①机械强度高,可提供强大的支撑力及摩擦力,对于术中提拉复位和加压固定等操作,可更加坚强牢靠的支撑力和把持力。②Cage 使用自体松质骨颗粒填塞其中,切除的椎板可作为良好的植骨来源,不需要另行切口取骨,取材方便,创伤小。③自体松质骨颗粒,相比结构性植骨块在骨形成、骨诱导、血管再生方面更有优势。其缺点有费用较高、操作技术要求高等。
本研究的结果显示:自体髂骨块与Cage +自体骨2 种方式安全可靠,临床效果满意,可作为一线选择应用临床。对于腰椎滑脱等力学强度要求高的病例,建议行Cage+自体骨移植。自体髂骨块移植无组织相容性问题,且造价省、费用低,适合于经济不宽裕的患者。
3.3 骨质疏松者椎间融合
文献中对于骨质疏松患者行腰椎融合报道不多。Okuyama 等[26]对52 例接受PLIF+椎弓根钉棒固定患者进行分析,发现融合者的骨密度明显高于不融合者,其研究结果证明骨密度与融合成功率高度相关,骨质疏松是导致不融合的重要危险因素。另有一些研究也发现老年患者椎间塌陷、延迟融合、不融合较年轻人多见,并认为其主要原因与骨质疏松有关[27-29]。针对骨质疏松患者、不同融合材料对比的研究,目前尚未见报道。
本研究对骨质疏松患者3 种不同植骨材料进行研究,结果显示:3 组椎体间高度丢失,融合时间、内固定失败率均明显高于骨质正常者,这与前期研究一致。3 种材料者之间比较,同种异体骨融合率最低,自体髂骨块相对于Cage +自体松质骨椎体塌陷更少、融合速度更快、融合成功率更高(P<0.05),对于骨质疏松患者,自体髂骨块更优于Cage +自体松质骨。
理论上说,椎体间高度的维持受3 个因素的影响:力学负荷、接触面积、密度差异。腰椎融合术后,椎间高度不同程度的丢失几乎不可避免[24-25],这在骨质疏松患者或无钉棒内固定情况中尤为明显。与自体髂骨块相比,Cage 的材质密度、弹性模量与椎体骨质差异更大,由此带来更高的椎体塌陷度。另外,在术后影像学随访中发现,在明显椎体塌陷的情况下使用Cage 达到椎间融合的病例,其骨桥形成大多位于Cage 内部,而在Cage 周边骨桥形成的情况很少。笔者认为,更大的弹性模量差异导致更高的椎体塌陷度、进而导致融合面积减少、周边骨桥形成率降低,可能是Cage+自体松质骨在骨质疏松患者中融合成功率低于自体髂骨块的重要原因。其具体影响机制,尚待更进一步临床研究。
综上所说,3 种材料应用于后路腰椎椎间融合,同种异体骨组融合率最低,内固定失败、椎间隙塌陷发生率最高;自体髂骨块与Cage +自体松质骨2 种方式植骨融合率高,内固定失败发生率低,二者比较在各方面无明显差异,可依据患者情况个体化选择。对于骨质疏松者,自体髂骨块在融合时间和融合率方面更佳。
[1]Mummaneni PV,Haid RW,Rodts GE.Lumbar interbody fusion:state-of-the-art technical advances.Invited submission from the Joint Section Meeting on Disorders of the Spine and Peripheral Nerves,March 2004[J].J Neurosurg Spine,2004,1(1):24-30.
[2]Brantigan JW,Neidre A,Toohey JS.The Lumbar I/F Cage for posterior lumbar interbody fusion with the variable screw placement system:10-year results of a Food and Drug Administration clinical trial[J].Spine J,2004,4(6):681-688.
[3]DiPaola CP,Molinari RW.Posterior lumbar interbody fusion[J].J Am Acad Orthop Surg,2008,16(3):130-139.
[4]Periasamy K,Shah K,Wheelwright EF.Posterior lumbar interbody fusion using cages,combined with instrumented posterolateral fusion:a study of 75 cases[J].Acta Orthop Belg,2008,74(2):240-248.
[5]Rihn JA,Kirkpatrick K,Albert TJ.Graft options in posterolateral and posterior interbody lumbar fusion[J].Spine (Phila Pa 1976),2010,35(17):1629-1639.
[6]Seong JH,Lee JW,Kwon KY,et al.Comparative Study of Posterior Lumbar Interbody Fusion via Unilateral and Bilateral Approaches in Patients with Unilateral Leg Symptoms[J].J Korean Neurosurg Soc,2011,50(4):363-369.
[7]Thomsen K,Christensen FB,Eiskjaer SP,et al.1997 Volvo Award winner in clinical studies.The effect of pedicle screw instrumentation on functional outcome and fusion rates in posterolateral lumbar spinal fusion:a prospective,randomized clinical study[J].Spine (Phila Pa 1976),1997,22(24):2813-2822.
[8]Sengupta DK,Truumees E,Patel CK,et al.Outcome of local bone versus autogenous iliac crest bone graft in the instrumented posterolateral fusion of the lumbar spine[J].Spine (Phila Pa 1976),2006,31(9):985-991.
[9]Cloward RB.Posterior lumbar interbody fusion updated[J].Clin Orthop Relat Res,1985 (193):16-19.
[10]Mooney B.Spondylolisthesis[J].Can Med Assoc J,1932,26(1):16-18.
[11]Dehoux E,Fourati E,Madi K,et al.Posterolateral versus interbody fusion in isthmic spondylolisthesis:functional results in 52 cases with a minimum follow-up of 6 years[J].Acta Orthop Belg,2004,70(6):578-582.
[12]何志敏,卢旭华,陈德玉.腰椎椎间融合术临床应用进展[J].国外医学(骨科学分册),2005,26(6):30-32.
[13]Csécsei G,Klekner A,Sikula J.Posterior lumbar interbody fusion (PLIF)using the bony elements of the dorsal spinal segment[J].Acta Chir Hung,1997,36(1-4):54-56.
[14]Reid JJ,Johnson JS,Wang JC.Challenges to bone formation in spinal fusion[J].J Biomech,2011,44(2):213-220.
[15]Zdeblick TA,Phillips FM.Interbody cage devices[J].Spine(Phila Pa 1976),2003,28(15 Suppl):S2-7.
[16]张绍东,唐天驷,吴小涛,等.腰椎椎间融合器的翻修手术[J].中华骨科杂志,2004,24(9):21-24.
[17]Bridwell KH,Lenke LG,McEnery KW,et al.Anterior fresh frozen structural allografts in the thoracic and lumbar spine.Do they work if combined with posterior fusion and instrumentation in adult patients with kyphosis or anterior column defects?[J].Spine (Phila Pa 1976),1995,20(12):1410-1418.
[18]Molinari RW,Bridwell KH,Klepps SJ,et al.Minimum 5-year follow-up of anterior column structural allografts in the thoracic and lumbar spine[J].Spine (Phila Pa 1976),1999,24(10):967-972.
[19]Haid RW Jr,Branch CL Jr,Alexander JT,et al.Posterior lumbar interbody fusion using recombinant human bone morphogenetic protein type 2 with cylindrical interbody cages[J].Spine J,2004,4(5):527-538.
[20]Ito Z,Matsuyama Y,Sakai Y,et al.Bone union rate with autologous iliac bone versus local bone graft in posterior lumbar interbody fusion[J].Spine (Phila Pa 1976),2010,35(21):E1101-5110.
[21]Ito Z,Matsuyama Y,Sakai Y,et al.Bone union rate with autologous iliac bone versus local bone graft in posterior lumbar interbody fusion[J].Spine (Phila Pa 1976),2010,35(21):E1101-1105.
[22]Simmons JW.Posterior lumbar interbody fusion with posterior elements as chip grafts[J].Clin Orthop Relat Res,1985(193):85-89.
[23]Banwart JC,Asher MA,Hassanein RS.Iliac crest bone graft harvest donor site morbidity.A statistical evaluation[J].Spine(Phila Pa 1976),1995,20(9):1055-1060.
[24]Lee JH,Jeon DW,Lee SJ,et al.Fusion rates and subsidence of morselized local bone grafted in titanium cages in posterior lumbar interbody fusion using quantitative three-dimensional computed tomography scans[J].Spine (Phila Pa 1976),2010,35(15):1460-1465.
[25]Marino JF.Subsidence of metal interbody cage after posterior lumbar interbody fusion with pedicle screw fixation.Orthopedics.2010 Apr;33(4):226-7.
[26]Okuyama K,Abe E,Suzuki T,et al.Influence of bone mineral density on pedicle screw fixation:a study of pedicle screw fixation augmenting posterior lumbar interbody fusion in elderly patients[J].Spine J,2001,1(6):402-407.
[27]Yone K,Sakou T,Kawauchi Y,et al.Indication of fusion for lumbar spinal stenosis in elderly patients and its significance[J].Spine (Phila Pa 1976),1996,21(2):242-248.
[28]Endres S.Instrumented posterolateral fusion-clinical and functional outcome in elderly patients[J/OL].Ger Med Sci,2011,9:Doc09[2011-04-06].http://www.egms.de/static/en/journals/gms/2011-9/000132.shtml.
[29]Okuda S,Oda T,Miyauchi A,et al.Surgical outcomes of posterior lumbar interbody fusion in elderly patients.Surgical technique[J].J Bone Joint Surg Am,2007,89 Suppl 2 Pt.2:310-320.