组织工程化同种异体椎间盘移植的动物实验研究
辛洪奎,张 超,王德利,吴剑宏,王超峰,何 勍,阮狄克
椎间盘退行性疾病是临床常见病、多发病,严重影响患者日常工作及生活。传统治疗手段存在一定不足,同种异体椎间盘移植是目前正在尝试的探索性治疗手段。但临床研究证实异体椎间盘移植后会出现不同程度的退行性改变,这将影响椎间盘移植的远期临床效果。如能通过合适的技术手段延缓移植椎间盘的退行性改变,将有可能使椎间盘退变性疾病的治疗达到更好的疗效。
本研究借鉴组织工程的理念来审视同种异体椎间盘移植,将同种异体椎间盘视作椎间盘组织工程的天然支架材料,并以组织工程的技术手段来优化同种异体椎间盘的生物活性,通过复合具有生物活性的种子细胞使之组织工程化。在体外成功构建组织工程化异体椎间盘的基础上,拟通过大动物实验研究细胞干预技术是否可有效延缓同种异体椎间盘移植后的退行性改变。
1 材料与方法
1.1 同种异体椎间盘的收集与冷冻保存
1 岁龄比格犬3 只,麻醉后处死,无菌切取胸段及腰段脊柱。自终板上下两侧锯断椎体,保留约3 mm终板下骨。标本取出后置于50 mL 离心管,加入含10%FBS 和DMSO 的DMEM/F12(1∶1)的培养基后逐级冷冻:4℃过夜,-20℃放置2 h,-40℃放置2 h,-80℃放置2 h,液氮保存。
1.2 犬髓核细胞的体外培养
8 周龄幼犬,麻醉处死后无菌切取脊柱,水平切开椎间盘,刮取胶冻状髓核置于15 mL 离心管中,2 g/L 胶原酶(Gibco,美国)消化2 h 后1 000 r/mim离心5 min,PBS 冲洗2 次,收集细胞接种于100 mL培养瓶,加入含10%胎牛血清(Gibco)F12 培养基(Gibco),37℃,5% CO2,饱和湿度下培养。
1.3 同种异体椎间盘的体外组织工程化
传2 代髓核细胞,细胞达到单层融合后,胰酶消化后PKH-26 标记,制备成5 ×106/mL 细胞悬液。使用16G 注射针头的1 mL 注射器吸入细胞悬液备用。将12 个椎间盘随机分为2 组,实验组注入5 ×106/mL 细胞悬液25 μL(A 组);对照组注射入等量生理盐水并体外培养(B 组)。将构建完成的细胞-同种异体椎间盘支架复合体置于50 mL 离心管,加入15 mL 含10%胎牛血清F12 培养基,37℃,5%CO2,饱和湿度下培养。
1.4 组织工程化同种异体椎间盘比格犬原位移植手术
12 月龄比格犬12 只分为2 组,分别植入2 组同种异体椎间盘,目标间隙为L4/L5。肌肉注射全身麻醉后常规消毒,铺无菌单。沿肋弓下缘自后上斜向前下切开皮肤及皮下组织,切口长约8 cm。分离腹膜并向前方牵开。将腰大肌牵向后方,显露腰椎椎体及椎间盘。Caspar 撑开器撑开椎间隙,切除椎间盘,刮除上下软骨终板,将修整好的同种异体椎间盘植入L4/L5间隙。逐层缝合切口,术后连续3 d肌注青霉素160 万单位预防感染。
1.5 移植椎间盘转归的影像学观察分析
术后即刻及4、8、12 周行正侧位X 线及MRI 检查,观察各组移植椎间盘同宿主椎体愈合情况、移植椎间盘形态、高度保持情况。根据X 线检查结果测量椎间盘高度变化,椎间隙高度取椎间隙前、中、后部高度的平均值;根据MRI 检查结果测量椎间盘T2相信号强度。使用Photoshop version 7.0(Adobe,San Jose,CA,USA)图像处理软件测量MRI T2 加权像中手术节段髓核的灰度值,并与同节段椎管内脑脊液的灰度值进行比较,得出手术节段髓核的比灰度值,用以判断髓核的含水量,每项测量均由有经验的临床医师测量3 次,取平均值进行统计。
1.6 生物力学分析
手术后12 周麻醉状态下处死实验动物,取L1~7段脊柱标本,骨水泥包埋。将标本连接到生物力学实验机MTS 858 Mini BionixⅡ,加载1.0 N·M 的扭矩触发标本左右旋转运动,测量L4,5椎体的相对位移动度;使用三维运动加载系统加载3.0 N·M 的扭矩触发标本进行屈伸及左右侧曲运动,测量L4,5椎体的相对位移动度。各向运动均测量5 次,取平均值进行统计比较。
1.7 组织学观察
线锯将L4/L5椎间盘从脊柱标本中取出,保留L4下终板及L5上终板,每组各取2 个椎间盘行冰冻切片后激光共聚焦显微镜观察PKH-26 标记细胞。其余椎间盘标本福尔马林固定24 h,脱钙液脱钙2 周后石蜡包埋,常规切片HE 染色,显微镜下观察。
1.8 统计学分析
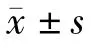
2 结 果
2.1 犬髓核细胞的分离培养及荧光标记
幼犬髓核呈半透明胶冻状。髓核细胞接种48 h即可贴壁伸展。镜下可见细胞胞质丰富,胞体饱满,呈短梭形。随传代次数增加,细胞极性逐渐增强,呈长梭形,似成纤维细胞,生长变缓。使用PKH-26 标记细胞后,荧光显微镜观察可见髓核细胞膜呈现出均匀的红色荧光,细胞-同种异体椎间盘复合体植入体内后12 周可于椎间盘内部观察到红色荧光细胞(见图1)。
2.2 动物手术
所有动物手术均顺利完成(见图2)。平均手术时间65 min,出血量为40 mL。所有实验犬切口愈合良好。
2.3 X 线检查
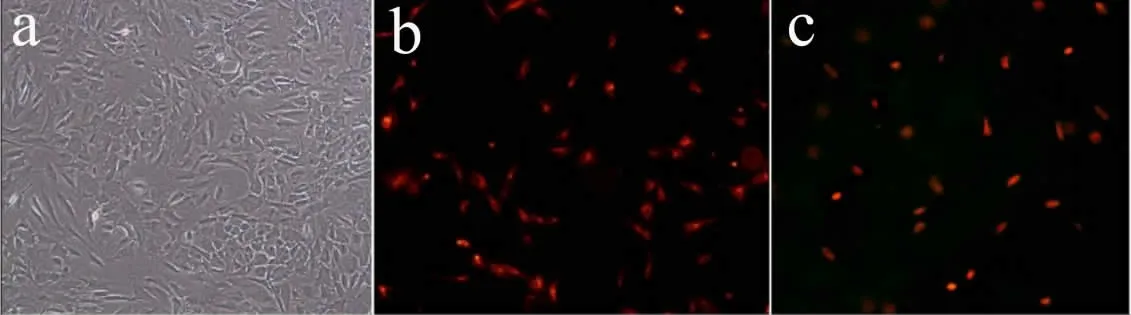
图1 传2 代犬髓核细胞Fig.1 Second passage of nucleus pulposus cells
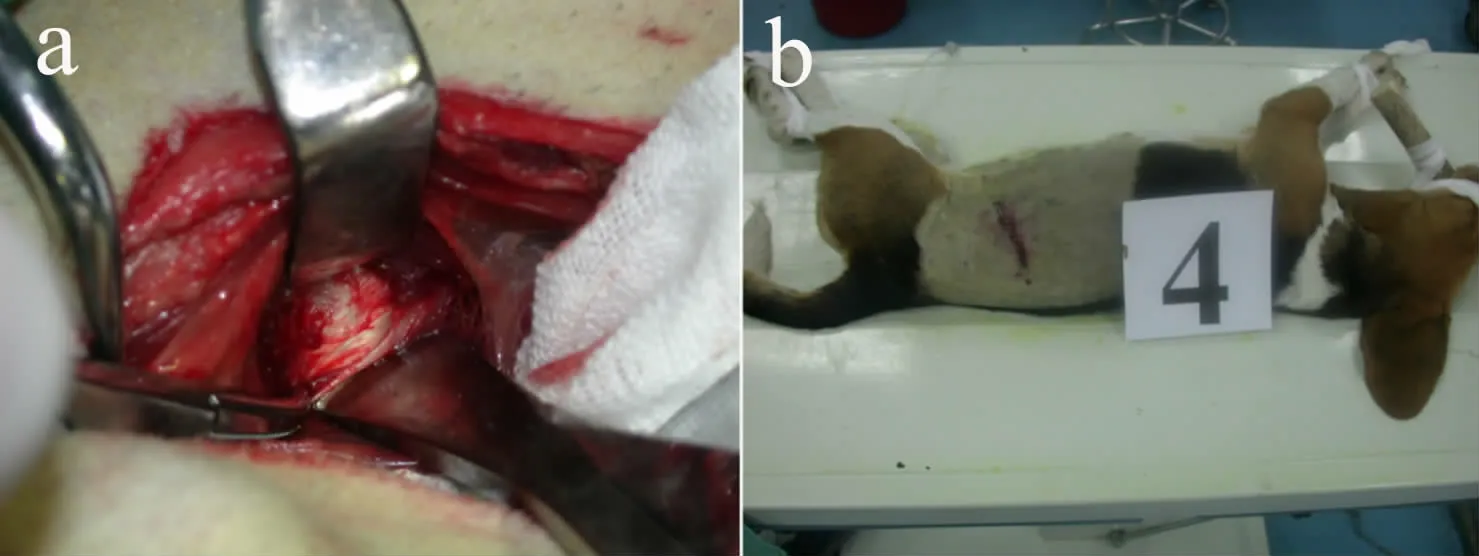
图2 手术操作Fig.2 Operative procedure
X 线检查结果显示移植椎间盘与宿主椎体均实现了良好的骨性融合。B 组4 周即出现了椎体前缘骨赘形成、椎间隙狭窄等退行性改变,且在第8 周及第12 周表现出进展趋势。A 组在各观察点未出现上述典型退行性改变(见图3)。术后2 组动物椎间隙高度均呈下行趋势,B 组下降幅度较为明显,至移植后8 周其高度已明显低于A 组,差异有统计学意义(P<0.05,见图4)。
2.4 MRI 观察分析
MRI 观察结果显示移植后2 组椎间盘均呈现不同程度的退行性改变,B 组尤为明显。12 周时,其移植椎间盘术前典型的髓核结构形态及信号特点消失不见,髓核信号显著降低,呈典型的“黑间盘”样改变;A 组动物移植椎间盘虽然髓核信号有部分降低,但仍较好的保持了髓核的形态结构及T2 像高信号的影像学特点(见图5)。对髓核T2信号比灰度值的动态对比表明,术后2 组椎间盘信号比灰度值均呈下行趋势。术后4 周,B 组髓核T2 信号比灰度值已明显低于A 组,差异有统计学意义(P<0.05,见图6)。
图3 术后12 周移植椎间盘侧位X 线片Fig.3 Lateral roentgenograph of intervertebral disc at 12 weeks after implantation
2.5 生物力学分析
生物力学测试结果显示2 组移植椎间盘在左右侧曲活动度上无明显区别。而对于屈伸及旋转稳定性的保持,A 组于术后12 周明显优于B 组,差异有统计学意义(P<0.05,见图7)。
2.6 组织学观察
对移植椎间盘行切片后HE 染色组织学观察发现A 组移植椎间盘结构保持较好,外形类似软骨细胞的髓核细胞,数量较多,排列较为规则;而B 组髓核形态保持欠佳,结构较为紊乱,髓核细胞数量明显减少,细胞形态欠饱满,退行性改变明显(见图8)。
3 讨 论
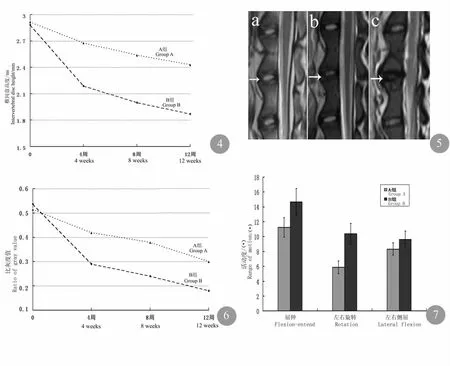
图4 术后2 组移植椎间盘高度比较图5 术后12 周移植椎间盘MRI图6 术后2 组移植椎间盘髓核信号比灰度值比较图7 2 组间不同方向活动度的生物力学比较Fig.4 Compare of intervertebral disc height in 2 groups after implantationFig.5 MRI of intervertebral disc at 12 weeks after implantationFig.6 Compare of nucleus gelatinosus signal ratio of gray value in 2 groups after implantationFig.7 Biomechanics compare of range of motion in 2 groups at different direction

图8 组织学观察Fig.8 Histology observation
本研究小组于2007 年报道了同种异体椎间盘移植治疗颈椎椎间盘退行性疾病的临床研究,5 年随访的结果发现移植的椎间盘可以存活并且部分保留移植节段的稳定性以及活动度[1]。研究结果表明同种异体椎间盘移植的确有望成为修复椎间盘退变的方法之一。随访中观察到移植椎间盘含水量下降以及高度降低等退行性改变,这些退行性改变的进展有可能再次导致神经压迫以及继发性椎管狭窄等病理改变,从而影响椎间盘移植的远期临床效果。因此,如何延缓椎间盘移植后的退变是本研究要探索的内容。从椎间盘组织工程的研究中受到启发[2],本研究拟将组织工程技术应用于同种异体椎间盘移植,将其视为天然椎间盘组织工程支架材料,通过与髓核细胞的复合以期达到增强异体椎间盘活性、实现延缓移植后退变的目的。椎间盘内的高应力作用和营养缺乏对种子细胞的存活、增值及功能发挥提出严峻的挑战。移植后12 周本研究A 组髓核区域内发现了PKH-26 阳性细胞的大量存在,这为种子细胞的存活提供了直接的证据。成年后椎间盘组织无血供来源,营养供给主要依靠上下软骨终板中的微孔来维持[3-4],本研究认为在体内条件下,髓核内种子细胞的营养供给通过微孔的渗透效应来实现,实验中保留近2 mm 的终板下骨,可以保证营养物质通过终板下骨达到终板并完成渗透效应。椎间盘组织内环境的特点为低氧高张力,在这种内环境下,细胞代谢活动相对缓慢,所需营养物质较少,渗透效应可以保证种子细胞的正常代谢。
组织工程技术具有2 大核心要素,即种子细胞与支架材料。对于种子细胞的选择,最新医学研究成果表明髓核细胞、软骨细胞、骨髓间充质干细胞及脂肪干细胞等均具有修复椎间盘退行性改变的潜力[5-8],诸多可供选择的细胞来源让人目不暇接。本研究认为在现有技术手段条件下,任何非髓核细胞来源的种子细胞均无法完整模拟髓核细胞的代谢特点及功能表达。这是本研究选择髓核细胞作为种子细胞原因所在。髓核细胞所表达的Ⅱ型胶原及蛋白多糖成分正是延缓椎间盘退变所必需的重要细胞外基质成分,并且髓核细胞可以实现其表达量及二者之间的比例同天然椎间盘接近。实验中观察到复合至异体椎间盘内的髓核细胞不但可在体内存活,并且可以有效地保持移植椎间盘的形态及结构特点,同时维持手术节段的高度及稳定性,这表明髓核细胞的确具有良好的抗退变效应。此外,在组织学观察中2 组椎间盘内均未见到明显的免疫反应及炎细胞浸润现象,这也间接证明了髓核组织的免疫豁免性[9]。
本研究的主要目的是通过比格犬腰椎原位植入实验探讨髓核细胞的介入是否可以实现延缓移植后同种异体椎间盘的退变进程。X 线及MRI 检查结果显示术后通过细胞干预手段有效地保持了移植椎间盘的高度以及移植椎间盘髓核的形态及信号强度;生物力学分析证实细胞干预在保持脊柱功能单元稳定性方面具有明显优势;同时,组织学发现复合了种子细胞的异体椎间盘移植后其形态、结构及髓核细胞表型得到了更好地保持。上述研究结果证明髓核细胞干预可以有效延缓同种异体椎间盘移植后的退行性改变。
虽然本研究结果提示髓核细胞植入椎间盘内的确可以起到延缓退变的效果,但在移植后的动态观察中同样发现了复合了髓核细胞的异体椎间盘存在着一定程度的退行性改变,表现为椎间盘高度的轻微降低以及髓核含水量的小幅下降。究其原因,可能是由髓核细胞增殖能力的有限性及其体外培养的去分化现象[10-11]所决定的。这一定程度上限制了髓核细胞在这一领域的应用前景,但其天然髓核细胞表型的固有优越性是其他细胞来源,如骨髓间充质干细胞、脂肪干细胞,无法比拟的,如能通过适当的技术手段促进髓核细胞的活性及其增殖能力,将极大拓展其在椎间盘退变生物治疗中的作用空间。
本实验通过比格犬体内原位植入观察异体椎间盘体内植入转归及髓核细胞的抗退变效应。结果表明异体椎间盘移植后可与宿主椎体良好愈合,种子细胞可存活并有效保持椎间盘高度、髓核含水量,维持了脊柱节段的稳定性及生理活动功能。本研究提示组织工程技术的运用可以有效延缓同种异体椎间盘移植后的退行性改变。
[1]Ruan D,He Q,Ding Y,et al.Intervertebral disc transplantation in the treatment of degenerative spine disease:a preliminary study[J].Lancet,2007,369(9566):993-999.
[2]Ruan DK,Xin H,Zhang C,et al.Experimental intervertebral disc regeneration with tissue-engineered composite in a canine model[J].Tissue Eng Part A,2010,16(7):2381-2389.
[3]Rodriguez AG,Rodriguez-Soto AE,Burghardt AJ,et al.Morphology of the human vertebral endplate[J].J Orthop Res,2012,30(2):280-287.
[4]Grunhagen T,Shirazi-Adl A,Fairbank JC,et al.Intervertebral disk nutrition:a review of factors influencing concentrations of nutrients and metabolites[J].Orthop Clin North Am,2011,42(4):465-477.
[5]Orozco L,Soler R,Morera C,et al.Intervertebral disc repair by autologous mesenchymal bone marrow cells:a pilot study[J].Transplantation,2011,92(7):822-828.
[6]Gruber HE,Deepe R,Hoelscher GL,et al.Human adiposederived mesenchymal stem cells:direction to a phenotype sharing similarities with the disc,gene expression profiling,and coculture with human annulus cells[J].Tissue Eng Part A,2010,16(9):2843-2860.
[7]Smith LJ,Chiaro JA,Nerurkar NL,et al.Nucleus pulposus cells synthesize a functional extracellular matrix and respond to inflammatory cytokine challenge following long-term agarose culture[J].Eur Cell Mater,2011,22:291-301.
[8]Meisel HJ,Siodla V,Ganey T,et al.Clinical experience in cellbased therapeutics:disc chondrocyte transplantation A treatment for degenerated or damaged intervertebral disc[J].Biomol Eng,2007,24(1):5-21.
[9]Nomura T,Mochida J,Okuma M,et al.Nucleus pulposus allograft retards intervertebral disc degeneration[J].Clin Orthop,2001(389):94-101.
[10]Kluba T,Niemeyer T,Gaissmaier C,et al.Human anulus fibrosis and nucleus pulposus cells of the intervertebral disc:effect of degeneration and culture system on cell phenotype[J].Spine(Phila Pa 1976),2005,30(24):2743-2748.
[11]Hu MH,Hung LW,Yang SH,et al.Lovastatin promotes redifferentiation of human nucleus pulposus cells during expansion in monolayer culture[J].Artif Organs,2011,35(4):411-416.

