MACC1基因干扰对卵巢上皮性癌细胞增殖和顺铂耐药的影响
郑州大学第一附属医院妇产科,河南 郑州 450052
MACC1基因干扰对卵巢上皮性癌细胞增殖和顺铂耐药的影响
邓佑兴 史惠蓉 李霞 张瑞涛
郑州大学第一附属医院妇产科,河南 郑州 450052
背景与目的:有研究发现,结肠癌转移相关基因1(metastasis-associated in colon cancer-1,MACC1)在多种肿瘤中高表达,其通过调节细胞外信号激酶(extracellular signal-regulated kinase,ERK)1/2信号通路影响肿瘤细胞的增殖、凋亡等过程。而对于MACC1在卵巢癌中的作用研究甚少。本研究应用RNA干扰(RNAi)技术逆转卵巢上皮性癌耐药细胞中MACC1基因的表达,并探讨MACC1基因表达与卵巢癌细胞顺铂耐药的关系。方法:前期设计的针对MACC1 mRNA的小发卡状RNA(shRNA)转染卵巢癌顺铂耐药细胞系SKOV3/DDP细胞,RT-PCR及Western blot检测MACC1 mRNA和蛋白表达的变化;四甲基偶氮唑蓝法检测转染前后SKOV3/DDP细胞的增殖及对顺铂的半数抑制浓度(IC50),流式细胞仪测定顺铂处理前后各组细胞凋亡率。Western blot检测ERK1/2及p-ERK1/2蛋白的变化。实验分3组:空白组为未经处理的SKOV3/DDP细胞,阴性对照组转染空质粒p-super-EGFP-1,实验组转染重组质粒p-super-EGFP-MACC1 shRNA。结果:与其他两组细胞相比,实验组细胞MACC1 mRNA及蛋白降低,对顺铂的IC50较低(26.094 vs 47.501/47.089 μmol/L,P<0.05),p-ERK1/2蛋白表达下降(0.3979 vs 0.6712/0.6681,P<0.05),顺铂处理前、后凋亡率增加(1.32% vs 0.66%/0.48%,P<0.05;36.70% vs 18.53%/16.60%,P=0.000)。结论:MACC1基因表达下调能在一定程度上恢复SKOV3/DDP细胞对顺铂的敏感性,可能与ERK1/2通路有关。
结肠癌转移相关基因1;卵巢癌;顺铂;细胞外信号激酶
已有研究[1-2]表明,结肠癌转移相关基因1(metastasis-associated in colon cancer-1,MACC1)可作为细胞外信号激酶(extracellular signal-regulated kinase,ERK)1/2信号通路的上游调控因子,而卵巢癌的顺铂耐药与ERK1/2信号通路密切相关。因此,推测MACC1基因可能参与卵巢癌顺铂耐药的调控。本研究旨在通过RNAi技术沉默人卵巢癌耐药细胞系SKOV3/ DDP细胞中MACC1表达,并观察MACC1基因干扰前后卵巢癌顺铂耐药细胞相关生物学行为的变化,探讨MACC1与卵巢癌细胞顺铂耐药的关系。
1 材料和方法
1.1 主要材料
人卵巢癌细胞系SKOV3/DDP购自中国医学科学院肿瘤细胞库;真核荧光表达载体p-super-EGFP-1由郑州大学基础医学院组织胚胎学教研室张钦宪教授惠赠;重组质粒p-super-EGFP-MACC1 shRNA由本课题组前期构建;RevertAid Frist Strand cDNA购自加拿大Formentas公司;DNA&siRNA InterferinTM转染试剂购于美国Polyplus Transfection公司;MTT购自Sigma公司;细胞培养试剂购自Hyclone公司;顺铂购自云南生物谷制药公司;Annexin V-FITC凋亡检测试剂盒购自凯基公司;兔抗人MACC1抗体购自Abcam公司、兔抗人β-actin抗体及羊抗兔单克隆IgG购自CST公司,兔抗人ERK1/2、p-ERK1/2抗体购自北京博奥森公司。
1.2 方法
1.2.1 细胞培养和转染
SKOV3/DDP细胞在含10%胎牛血清的RPMI1640培养液中培养、传代。培养条件为37 ℃,CO2体积分数为5%,饱和湿度。分为3组:空白组为未经处理的SKOV3/DDP细胞,阴性对照组转染空质粒p-super-EGFP-1,实验组转染重组质粒p-super-EGFP-MACC1 shRNA。重组质粒按北京康为世纪有限公司质粒小量提取试剂盒说明进行提取,并利用Nano Drop 2000软件鉴定质粒纯度和浓度。采用DNA&siRNA InterferinTM转染试剂进行细胞转染,具体操作按说明书进行。转染48 h后,以含800 μg/mL G418的选择培养液进行筛选。
1.2.2 逆转录聚合酶链反应(RT-PCR)
检测SKOV3/DDP细胞中MACC1 mRNA的表达:TRIzol分别提取3组细胞总RNA,逆转录成cDNA第一链,以其为模板分别以MACC1、β-actin cDNA上、下游引物分管扩增目的基因及内参对照,MACC1上游引物序列:5’-CCTTCGTGGTAATA ATGCTTCC-3’,下游引物序列:5’-AGGGCTTCCATTGTATTGAG GT-3’,产物696 bp;β-actin上游引物序列:5’-GGCGGCACCACCATGTACCCT-3’,下游引物序列:5’-AGGGGCCGGAC TCGTCATACT -3’,产物220 bp。MACC1引物参照参考文献[9]引物序列,由生工生物(上海)工程技术有限公司合成;β-actin引物购自宝生物工程(大连)有限公司。PCR反应条件:94 ℃3 min,94 ℃ 30 s,53 ℃ 30 s和72 ℃ 30 s,循环35次,最后,72 ℃ 5 min,4 ℃终止。PCR反应产物经1.5%琼脂糖凝胶电泳,GENE GENIUS凝胶成像系统中观察和拍照,ImageJ软件分析处理PCR图像,以MACC1与β-actin灰度值的比值代表MACC1 mRNA的相对表达水平。实验重复3次。
1.2.3 Western blot检测MACC1、ERK1/2及p-ERK1/2 蛋白表达
分别提取3组细胞总蛋白,Bradford法行蛋白定量。蛋白变性后,10%SDS-PAGE电泳,45 V恒压湿转至硝酸纤维素膜,5%脱脂奶粉TBST封闭2 h,加入一抗(兔抗人MACC1 1∶500,兔抗人ERK1/2 1∶100,兔抗人p-ERK1/21∶100,兔抗人β-actin 1∶1 000),4 ℃过夜,加入二抗(羊抗兔1∶1 000)室温1 h,ECL化学发光法显色。采用ImageJ软件分析特异性蛋白条带灰度值,β-actin设为内参,以目标蛋白与β-actin条带灰度值的比值代表目标蛋白的相对表达水平。
1.2.4 MTT法检测细胞增殖
3组细胞以5×103/孔传至96孔板,于37 ℃,CO2体积分数为5%的条件下培养。每组设6复孔,结果取均值。分别培养24、48、72 h后加入5 mg/mL MTT 10 μL,继续温育4 h。弃上清液,加入二甲亚砜100 μL,摇床振荡10 min,用Bio-Rad酶标仪测定490 nm处的吸光度(A)值,绘制细胞增殖曲线。
1.2.5 MTT法检测细胞对顺铂耐药性
本实验所用顺铂终浓度为10、20、30、40、50、60 μmol/L,每个浓度设3个复孔。加药培养48 h后测定A值。计算不同浓度顺铂对5组细胞的抑制率,细胞抑制率=1-实验组A/空白组A。应用Probit概率回归法计算IC50值。
1.2.6 流式细胞术(FCM)检测细胞凋亡
测定未加顺铂和顺铂用量均为未转染组细胞的IC50时,各组细胞的凋亡率。
1.3 统计学处理
采用SPSS 17.0统计软件包进行统计学分析,所得数据均以表示,多组比较采用方差分析,两样本均数比较采用t检验,多个样本均数两两比较采用LDS法方差分析。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 转染前后各组细胞MACC1 mRNA的表达
稳定转染后,空白组、阴性实验组、实验组中MACC1 mRNA的表达水平分别是0.519 4±0.009 3、0.509 8±0.005 7、0.081 4±0.002 8,实验组明显低于其他两组,差异有统计学意义(F=8796.3,P<0.05);而阴性对照组和空白组比较,差异无统计学意义(P>0.05,图1)。

图 1 RT-PCR鉴定稳定转染前后3组细胞MACC1 mRNA表达效果Fig. 1 MACC1 mRNA expressions in each group by RT-PCR
2.2 转染前后各组细胞MACC1、ERK1/2和p-ERK1/2蛋白的表达
稳定转染后,实验组与其他两组相比,MACC1蛋白表达水平降低,p-ERK1/2蛋白表达水平降低,而ERK1/2蛋白在3组细胞中表达的差异无统计学意义(图2,表1)。
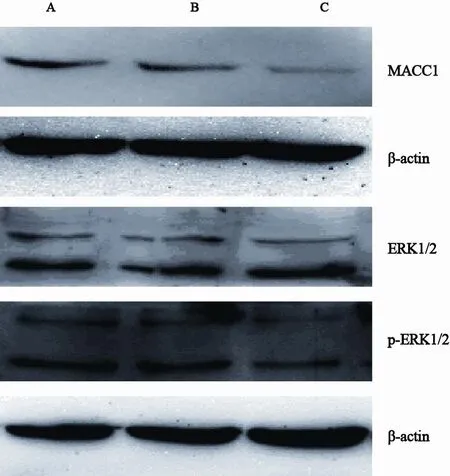
图2 Western blot检测转染前后3组细胞MACC1、ERK1/2和p-ERK1/2蛋白表达Fig.2 MACC1, ERK1/2 and p-ERK1/2 protein expression in each group by Western blot

表 1 各组细胞MACC1、ERK1/2和 p-ERK1/2表达Tab.1 MACC1, ERK1/2 and p-ERK1/2 protein expression in each group
2.3 转染前后各组细胞增殖情况
据MTT检测法显示,实验组细胞的增殖速度明显低于阴性对照组和空白组,差异有统计学意义(P<0.05,图3)。
2.4 转染前后各组细胞顺铂耐药性变化
据MTT检测法显示,实验组对顺铂的IC50为(26.094±0.911)μmol/L,分别低于空白组和阴性对照组[分别为(47.501±0.401)和(47.089±0.451)μmol/L],差异均有统计学意义(F=1 340.2,P<0.05,图4)。
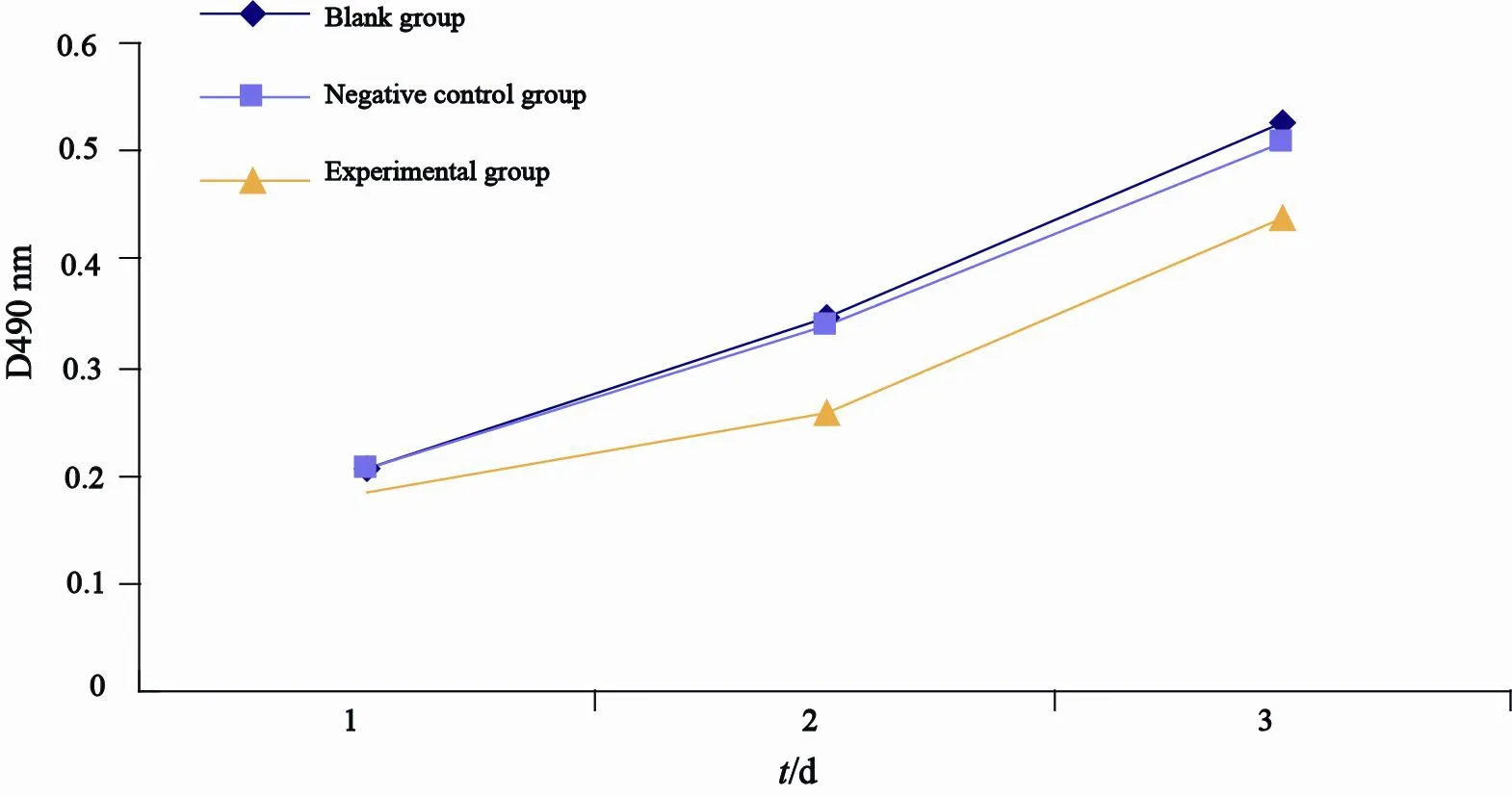
图 3 3组细胞的生长曲线Fig. 3 The growth curve of cells in each group
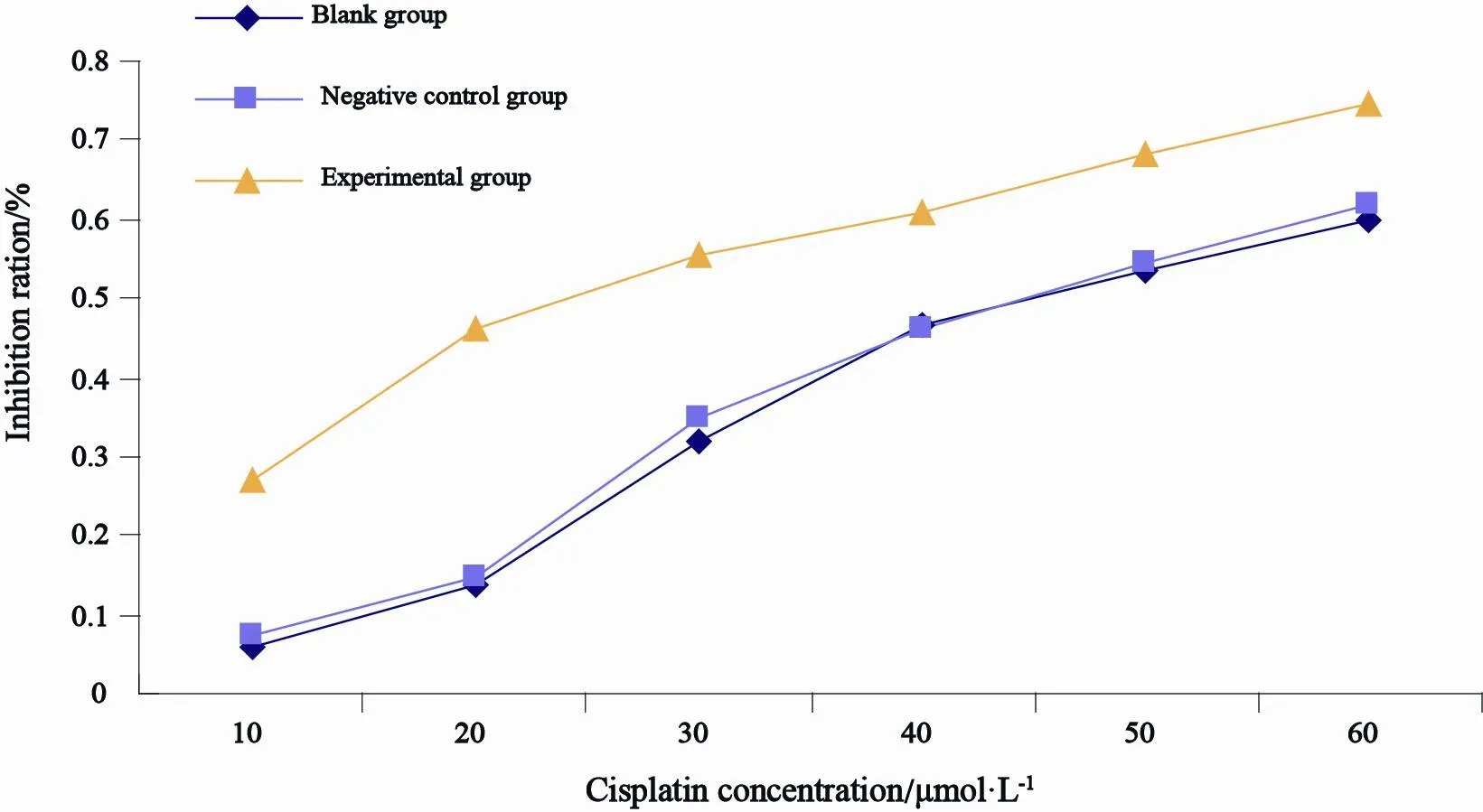
图 4 3组细胞的顺铂敏感性Fig. 4 The chemosensitivity to cisplatin in each group
2.5 细胞凋亡率的变化
顺铂处理前、后实验组细胞的凋亡率高于空白组和阴性对照组(F=22.723,P<0.05;F=256.568,P=0.000)。顺铂处理前实验组细胞凋亡率高于空白组及阴性对照组(P=0.001; P=0.002);顺铂处理后实验组细胞凋亡率也高于空白组及阴性对照组(P=0.000;P=0.000);顺铂处理前后,阴性对照组和空白组比较,差异无统计学意义(P=0.224;P=0.096,图5,表2)。
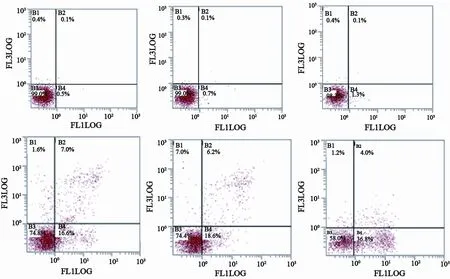
图 5 MACC1沉默对SKOV3/DDP细胞凋亡率的影响Fig. 5 The effect of MACC1 silencing on the apoptosis rate in SKOV3/DDP

表 2 MACC1沉默对SKOV3/DDP细胞凋亡率(%)的影响Tab. 2 The effect of MACC1silencing on the apoptosis rate (%) in SKOV3/DDP
3 讨 论
肿瘤的形成因素之一是细胞内原癌基因的激活和(或)抑癌基因的失活,使细胞信号传导通路的失衡、细胞周期调控机制紊乱,而导致细胞过度增生和凋亡减少[3]。MACC1最初是Stein等[1]应用qRT-PCR和数据库分析发现的一个与结肠癌密切相关的新基因,定位于人类染色体7p21.1,包含7个外显子和6个内含子,编码一个含852个氨基酸残基的蛋白。MACC1是细胞生长因子(hepatocyte growth factor,HGF)/ c-Met信号传导通路的重要调节因子,在细胞生长、细胞迁移及细胞侵袭转移中发挥着极其重要的作用[4-5]。
近年研究表明,MACC1在多种恶性肿瘤(如结直肠癌、肝癌、乳腺癌)中常高表达,可作为标志转移和预后判断的指标[6-8],提示MACC1的高表达与肿瘤的发生、发展密切相关。本课题组前期研究发现[9],上皮性卵巢癌组织中存在MACC1的异常高表达;并成功构建了MACC1特异性shRNA真核表达载体,转染卵巢癌OVCAR3细胞使MACC1基因表达降低后,检测到细胞增殖能力减弱、凋亡增加。Gao等[10]在肝细胞癌Huh7中沉默MACC1基因后,细胞的迁移、侵袭能力减弱。Pichorner等[11]构建结直肠癌裸鼠移植瘤模型,转染MACC1 shRNA后,移植瘤生长速度减慢,转移能力减弱,说明在体内试验中MACC1抑制能显著抑制肿瘤生长和转移。本实验应用RNAi技术将重组质粒p-super-EGFP-MACC1 shRNA转染人卵巢癌耐药细胞SKOV3/DDP,采用MTT法观察MACC1基因沉默后细胞的增殖和对顺铂敏感性的变化,流式细胞术检测细胞早期凋亡率。发现MACC1沉默的细胞增殖明显减慢,早期凋亡率增加,对顺铂的IC50降低,敏感性提高。以上研究均提示,在肿瘤细胞中抑制MACC1基因的表达,能使肿瘤细胞生长、侵袭转移能力减弱。
MACC1对肿瘤细胞的这种调节作用可能是通过一系列细胞通路完成的。其中,ERK1/2信号通路可能发挥重要作用。ERK1/2信号通路是丝裂原活化蛋白激酶(MAPK)家族的重要成员,能磷酸化激活多种转录因子和蛋白激酶,调节相关基因的转录,与细胞增殖、分化、细胞形态维持、细胞凋亡和细胞的恶变等多种生物学反应有关[12-13]。近来,许多研究者将ERK通路视为肿瘤治疗的重要靶点,如曹等发现应用ERK1/2通路抑制剂PD98059可增加乳腺癌细胞对表柔比星的敏感性[14]。探讨MACC1与ERK1/2通路的关系时,Stein等[1]研究发现,在结肠癌细胞中,转染外源性MACC1后,HGF介导的结肠癌细胞播散作用可被ERK1/2通路抑制剂PD98059或UO126抑制,提示外源性MACC1高表达可激活ERK1/2信号通路。Wang等[15]在胰腺癌细胞中应用RNAi技术沉默MACC1基因后,发现胰腺癌细胞增殖和迁移能力减弱,对吉西他滨敏感性提高,p-ERK1/2蛋白表达降低。本实验也发现,在卵巢癌耐药细胞中抑制MACC1基因表达后,不仅细胞增殖、凋亡能力及顺铂敏感性发生变化,p-ERK1/2蛋白表达也显著降低。提示MACC1可能通过ERK1/2通路调控卵巢癌耐药细胞的增殖、凋亡及顺铂敏感性。
结合以往研究及本实验结果,猜测MACC1可能作为ERK1/2通路的上游因子,调控卵巢癌的增殖及对顺铂的化疗敏感性。这为下一步构建动物模型,进行体内实验奠定了基础。
[1] STEIN U, WALTHER W, ARLT F, et al. MACC1, a newly identified key regulator of HGF-MET signaling, predicts colon cancer metastasis [J]. Nat Med, 2009, 15(1): 59-67.
[2] WEI S Q, SUI L H, ZHENG J H, et al. Role of ERK1/2 kinase in cisplatin-induced apoptosis in human ovarian carcinoma cells[J]. Chin Med Sci J, 2004, 19(2): 125-129.
[3] JEMAL A, CLEGGL X, WARD E, et al. Annual report to the nation on the status of cancer, 1975-2001, with a special feature regarding survival [J]. Cancer, 2004, 101(1): 3-27.
[4] KOKOSZYŃSKA K, KRYŃSKI J, RYCHLEWSKI L, et al.Unexpected domain composition of MACC1 links MET signaling and apoptosis [J]. Acta Biochim Pol, 2009, 56(2): 317-323.
[5] STEIN U, SMITH J, WALTHER W, et al. MACC1 controls Met: what a difference an Sp1 site makes [J]. Cell Cycle, 2009, 8(15): 2467-2469.
[6] SHIRAHATA A, SHINMURA K, KITAMURA Y, et al. MACC1 as a marker for advanced colorectal carcinoma [J]. Anticancer Res, 2010, 30(7): 2689-2692.
[7] QIU J, HUANG P, LIU Q, et al. Identification of MACC1 as a novel prognostic marker in hepatocellular carcinoma[J]. J Transl Med, 2011, 9: 166.
[8] HUANG Y, ZHANG H, CAI J, et al. Overexpression of MACC1 and its significance in human Breast Cancer Progression [J]. Cell Biosci, 2013, 3(1): 16.
[9] ZHANG R, SHI H, CHEN Z, et al. Effects of metastasisassociated in colon cancer 1 inhibition by small hairpin RNA on ovarian carcinoma OVCAR-3 cells[J]. J Exp Clin Cancer Res, 2011, 30: 83.
[10] GAO J, DING F, LIU Q, et al. Knockdown of MACC1 expression suppressed hepatocellular carcinoma cell migration and invasion and inhibited expression of MMP2 and MMP9[J]. Mol Cell Biochem, 2013, 376(1-2): 21-32.
[11] PICHORNER A, SACK U, KOBELT D, et al. In vivo imaging of colorectal cancer growth and metastasis by targeting MACC1 with shRNA in xenografted mice[J]. Clin Exp Metastasis, 2012, 29(6): 573-583.
[12] RAMOS J W. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells[J]. Int J Biochem Cell Biol, 2008, 40(12): 2707-2719.
[13] KIM E K, CHOI E J. Pathological roles of MAPK signaling pathways in human diseases[J]. Biochim Biophys Acta, 2010, 1802(4): 396-405.
[14] 曹迎明, 王殊, 张嘉庆, 等. MEK抑制剂增加乳腺癌细胞MCF-7对表柔比星的敏感性[J]. 中国癌症杂志, 2008, 18(11): 839-843.
[15] WANG G, KANG M, LU W, et al. MACC1: A potential molecule associated with pancreatic cancer metastasis and chemoresistance [J]. Oncol Lett, 2012, 4(4): 783-791.
欢迎订阅《临床肿瘤学杂志》
《临床肿瘤学杂志》是由国家新闻出版总署和解放军总政治部批准创办的肿瘤专业高级学术期刊,是中国科技论文统计源期刊(中国科技核心期刊)、中国生物医学核心期刊和CSCO团体会员期刊,已被“万方数据-数字化期刊群”、“中国核心期刊(遴选)数据库”、“中国学术期刊综合评价数据库(CAJCED)”、“中国期刊全文数据库(CJFD)”、“中文科技期刊数据库”、“中文生物医学期刊文献/会议论文数据库”等多家数据库收录,还被国际著名的检索系统美国《化学文摘》(Chemical Abstracts,CA)、《乌利希国际期刊指南》(Ulrich’s International Periodicals Directory)及波兰《哥白尼索引》(Index Copernius, IC)收录。
本刊以“突出临床,兼顾基础,中西并蓄”为办刊特色,主要刊登肿瘤临床研究领域的最新研究成果和经验,国内外的最新研究动态与进展,以及与临床密切相关的基础研究等内容。主要栏目有:专家论坛、论著、临床应用、综述与讲座、指南与解读、短篇报道、病例讨论、简讯等。读者对象为广大的肿瘤工作者和相关的医药卫生人员。本刊不仅是广大读者获取新信息的窗口,也是广大作者施展才华的舞台,发行量在国内同类期刊中最高,学术影响广泛。自2009年5月1日起本刊已启用网站在线投稿系统,广大读者和作者可以自由浏览本刊网站,并可免费下载本刊最新一期的部分文献全文,登录网址:www.lczlx.com,我们期待您的积极支持和参与。
本刊为月刊,大16开本,96页,激光照排,随文插放彩图,印刷装帧精美,国内外公开发行。标准刊号:ISSN 1009-0460,CN 32-1577/R,邮发代号:28-267(国内),BM8600(国外)。每期定价10元(包括邮寄费),全年120元。全国各地邮局均可订阅,漏订者请直接汇款至南京市杨公井34标34号《临床肿瘤学杂志》编辑部补订。邮编:210002,电话:025-84400143、80864363,传真:025-84400143,E-mail:lczlx@vip.163.com、lczlx@csco.org.cn。
Effect of MACC1 gene suppression on the proliferation of SKOV3/DDP cells and its chemosensitivity to cisplatin
DENG You-xing, SHI Hui-rong, LI Xia, ZHANG Rui-tao (Department of Obstetrics and Gynecology, the First Affiliated Hospital of Zhengzhou University, Zhengzhou Henan 450052, China)
SHI Hui-rong E-mail: hrshi2011@163.com
Background and purpose: The metastasis-associated in colon cancer-1 (MACC1) is highly expressed in different cancers and has an effect on the proliferation and apoptosis of tumor cells through the regulation of extracellular signal-regulated kinase (ERK)1/2 pathway. However, the role of MACC1 in ovarian cancer has been rarely studied. The study was aimed to suppress MACC1 gene expression by siRNA and explore the relationship between MACC1 expression and chemosensitivity to cisplatin in ovarian cancer cell line SKOV3/DDP. Methods: Empty plasmid p-super-EGFP-1 (negative control group) and p-super-EGFP-MACC1 shRNA (experimental group) were transfected into ovarian cancer cell SKOV3/DDP respectively. SKOV3/DDP cells without transfection were used as blank group. Then, MACC1 mRNA and protein levels were measured by RT-PCR and Western blot, respectively. Cell proliferation and IC50 of cisplatin was determined by methyl thiazolyl tetrazolium test (MTT). Apoptosis rate was determined by flow cytometer (FCM). ERK1/2 and p-ERK1/2 protein levels were determined by Western blot. Results: Compared with those in blank and negative control groups, MACC1 mRNA and protein levels deceased in experimental group. The IC50 of cisplatin in experimental group was lower than that in the other groups (26.094 vs 47.501/47.089 μmol/L, P<0.05). There was a lower expression of p-ERK1/2 in experimental group (0.3979 vs 00.6712/0.6681, P<0.05). Apoptosis rate was significantly higher in the experimental group before and after treatment of cisplatin (1.32% vs 0.66%/0.48%, P<0.05; 36.70% vs 18.53%/16.60%, P=0.000). Conclusion: MACC1 gene may be involved incisplatin resistance phenomenon in SKOV3/DDP cells through ERK1/2 pathway.
Metastasis-associated in colon cancer-1; Ovarian cancer; Cisplatin; Extracellular signal-regulated kinase
10.3969/j.issn.1007-3969.2013.12.006
R737.31
A
1007-3639(2013)12-0967-07
2013-10-09
2013-11-30)
史惠蓉 E-mail:hrshi2011@163.com

