局部晚期头颈部鳞癌的非手术治疗
复旦大学附属肿瘤医院放射治疗科,复旦大学上海医学院肿瘤学系,上海 200032
局部晚期头颈部鳞癌的非手术治疗
孔琳 陆嘉德
复旦大学附属肿瘤医院放射治疗科,复旦大学上海医学院肿瘤学系,上海 200032

孔琳,教授。副主任医师。1993年毕业于江西医学院医疗系,获学士学位;2002年毕业于复旦大学上海医学院,获博士学位。2005年6月至2006年6月在新加坡国立大学医院放射治疗中心从事临床工作和临床研究。擅长鼻咽癌及其他头颈部肿瘤的放射治疗和综合治疗,主要研究方向为鼻咽癌的综合治疗、调强适形放射治疗及放射不良反应。近年以第一作者和(或)通讯作者在Cancer等国外期刊(3篇)和中华系列期刊(6篇)、核心期刊(2篇)发表论文多篇。受邀参与编写由Springer科技出版公司出版的专著3部及其他专著2部。
局部晚期头颈部鳞癌的治疗往往需要包括手术、放疗、化疗参与的综合治疗,治疗应根据肿瘤原发部位、侵犯范围、患者的身体状况、治疗医生的经验等各项条件而采取个体化的多学科综合治疗。对于可手术切除的头颈部鳞癌,手术±术后放疗(或同期放化疗)仍是其主要的治疗方案,而非手术治疗(放化综合治疗)是另一选择,其目的主要是保留器官和功能。对于不能手术的患者,联合放化疗就成为的唯一选择。近年来发表的TAX323和TAX324研究显示,加用紫杉类、烷化类药物的新型诱导化疗较PF诱导化疗方案,可显著延长患者的生存时间。然而,基于新型诱导化疗的治疗策略同标准的同期联合放化疗相比,是否可进一步提高患者的预后,目前尚无设计良好的临床研究结果支持。本研究将探讨局部晚期头颈部鳞癌非手术治疗策略的临床证据和最新进展。
头颈部肿瘤;放射治疗;化疗
[Key words]Carcinoma of the head and neck region; Radiotherapy; Chemotherapy
头颈部肿瘤所处解剖学位置特殊,手术治疗通常会导致严重的外观和功能上的后遗症,甚至丧失正常的言语、吞咽或呼吸功能。头颈部鳞癌对放、化疗的敏感性相对较高,为非手术治疗(放疗为主的综合治疗)提供了契机。目前这种治疗策略主要用于以下3类人群:①原发于口咽、下咽、喉且有器官保留愿望的鳞癌患者,如肿瘤已经造成器官破坏的不在此列;②因肿瘤范围广泛而无法手术切除的头颈部鳞癌患者;③因合并其他内科疾病而无法耐受手术的头颈部鳞癌患者。放化综合治疗方式包括:诱导化疗联合单纯放疗(诱导放化疗)、放疗同期化疗(同期放化疗)以及诱导化疗联合同期放化疗(序贯放化疗)。然而,最佳的治疗策略目前仍未明确。
1 诱导化疗联合单纯放疗(诱导放化疗)
头颈部鳞癌对化疗敏感,以铂类为主的诱导化疗有效率为80%~90%,完全缓解率为20%~40%[1]。在局部治疗前(手术或放射治疗)加用诱导化疗有一定的获益。来自法国的一项多中心随机对照研究[2]入组了300例头颈部肿瘤(口腔癌79例,咽癌106例,喉咽癌115例),患者随机接受单一手术(或放疗)为主的局部治疗或诱导化疗后继续局部治疗。该研究采用的诱导化疗方案是卡铂(400 mg/m2,第1天)+ 5FU (1 000 mg/m2,第1~5天)。患者在第1周期化疗后若肿瘤发生进展或第2周期化疗后肿瘤未达到部分缓解(partial response,PR)即停止化疗并施行手术或放疗。对3个周期化疗后临床完全缓解者(complete response,CR)给予放射治疗(75 Gy);未达CR者,根据肿瘤部位的不同给予相应的根治手术或放射治疗。结果显示,化疗后原发肿瘤和颈部淋巴结的完全缓解率分别为31%和27%,原发肿瘤与颈部淋巴结的总有效率分别为63%和40%。诱导化疗组和局部治疗组4年总生存率(56% vs 48%)与无瘤生存率(33% vs 30%)差异无统计学意义,但诱导化疗组在器官保留方面明显优于局部治疗组(57% vs 24%,P=0.001)。另一项GETTEC多中心Ⅲ期临床研究[3]入组了318例各期口咽部肿瘤,随机分为局部治疗组(手术或放射治疗)与诱导化疗组(2~3个周期PF方案诱导化疗联合局部治疗),结果诱导化疗组和局部治疗组的中位生存期分别为5.1年和3.3年(P=0.03)。
诱导化疗联合单纯放疗这样一种治疗模式最主要是用于可手术头颈部鳞癌患者的非手术器官保留治疗。1987年,Jacobs等[4]报道的一项临床研究结果开创了诱导化疗联合放射治疗可手术切除头颈部肿瘤的先河,30例Ⅲ~Ⅳ期头颈部肿瘤(不含鼻咽癌)先接受3个周期的诱导化疗(顺铂+5-FU,PF方案),达到CR的12例患者随后给予放射治疗,其他患者则给予传统的手术+术后放疗,该组患者的2年无复发生存率达60%。美国退伍军人医院喉癌研究组最早开展了以器官保留为目的非手术治疗喉鳞癌的多中心Ⅲ期临床随机对照研究[5]。这项研究收治了332例Ⅲ~Ⅳ期喉鳞癌(不包括T1N1)患者,随机分为研究组和对照组。研究组患者先给予PF方案诱导化疗,化疗2个周期后评估疗效,对CR或PR患者继以第3个周期化疗和根治性放射治疗(66~76 Gy);对2个周期化疗后原发肿瘤灶无明显反应者则给予挽救性喉切除术。对照组患者则接受传统的手术治疗(全喉切除术+颈清扫术)和术后放疗(50~74 Gy)。研究组化疗的有效率达85%(CR为31%,PR为54%),诱导化疗耐受良好且不影响后续治疗。中位随访期33个月(11~62个月),两组患者的2年总生存率均为68%,诱导化疗组中36%患者接受了挽救性喉切除手术,而另外64%患者的器官则得以保留(喉部)。在这项具有里程碑意义的临床研究之后进行的EORTC 24891 Ⅲ期临床研究结果显示,与传统的手术±术后放疗相比,诱导放化疗在某些头颈部鳞癌患者中能达到类似的疗效,但器官功能保存更优[6-7]。
2 放疗同期化疗(同期放化疗)
多项大样本的Ⅲ期临床随机研究[8-16]和荟萃分析[17]证实,对局部晚期头颈部鳞癌,与单纯放疗相比,加用铂类为主的同期化疗均明显提高了局部区域控制率和总生存率(表1)。其中来自Duke大学的一项多中心临床随机研究[8]入组了116例局部晚期头颈部鳞癌(无法手术者占53%),患者随机接受单纯超分割放疗(总剂量75 Gy,1.25 Gy/次,每天2次)或同期放化疗。同期放化疗组的放射分割方式同单纯放射组,但总剂量略低(70 Gy),化疗采用PF方案(DDP 12 mg/m2·d,快速推注,第1~5天;5-FU 600 mg/m2·d,静脉滴注,第1~5天),在放疗的第1和第6周给药,该组57%的患者还接受了2个周期的PF辅助化疗。中位随访期41个月后分析显示,与单纯放疗组相比,同期放化疗组的3年局部区域性控制率明显提高(70% vs 44%,P=0.01),3年无复发生存率(61% vs 41%)和总生存率(55% vs 34%)也有提高的趋势,但差异无统计学意义,远处转移率(11% vs 10%)差异也无统计学意义。2003年,Adelstein等[11]报道了由美国多家组织联合完成的一项Ⅲ期临床试验,295例无法手术切除的头颈部鳞癌患者被随机分为3组:单纯放疗组(总剂量70 Gy/35次、每天1次);同期放化疗组(放疗与单纯放疗组相同,在放射的第1、22、43天给予DDP 100 mg/m2化疗);分段放射联合化疗组[第1个周期化疗开始时给予第1阶段放射30 Gy,在第3个周期化疗开始时给予第2阶段放射30~40 Gy,化疗采用PF方案(DDP 75 mg/m2,第1天;5-FU 1 000mg/m2,第1~4天),每4周为1个周期]。中位随访期41个月后分析显示,与单纯放射相比,放疗联合同期单药化疗明显提高了3年肿瘤相关生存率(51% vs 33%,P=0.01),但远处转移率类似(18% vs 22%)。分段放射联合化疗较单纯放射并未提高疗效,其原因可能是由于放疗中断5周导致肿瘤细胞加速再增殖。
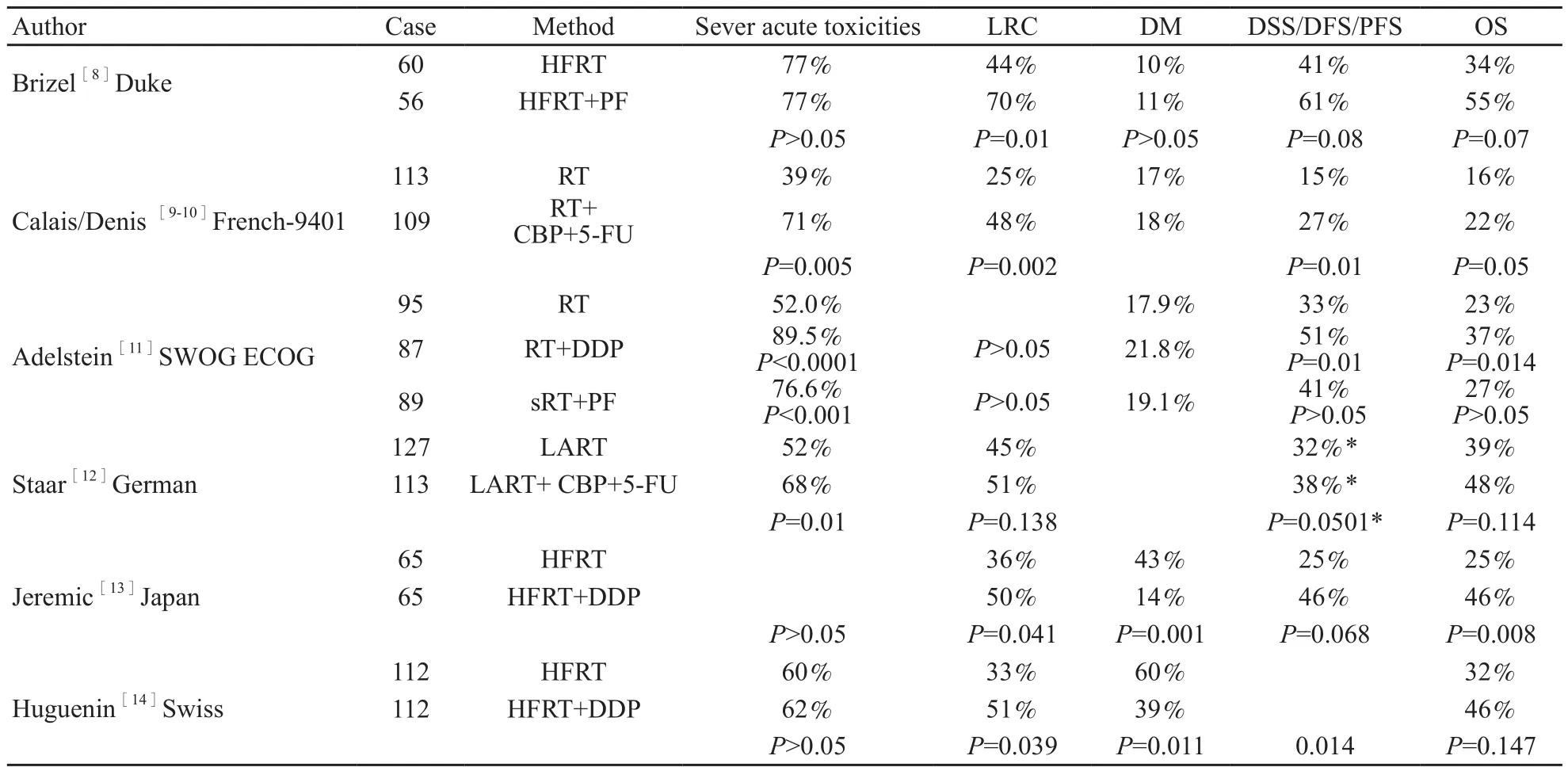
表 1 根治性放疗联合同期化疗的Ⅲ期临床试验结果Tab. 1 Phase Ⅲ studies of concurrent chemoradiotherapy for locally advanced head and neck cancer
INT 9111试验[15-16]是美国学者于1991年开展的多中心Ⅲ期临床试验,旨在探讨同期放化疗对局部晚期喉癌的作用及最佳的非手术治疗方式,研究的首要的观察终点为无喉切除生存率(laryngectomy-free survival,LFS)。该研究于2003年进行了初次报道,2013年发表了更新结果。该研究针对AJCC分期为Ⅲ~Ⅳ期且可手术切除的喉鳞癌患者(未包括T1和特大T4肿瘤),随机分为3组:单纯放射治疗组(n=185)给予原发肿瘤以及淋巴引流区标准放射治疗(70 Gy/35次,7周完成);诱导化疗组(n=180)给予与美国退伍军人医院研究相同的PF化疗方案和标准放射;同期化放疗组(n=182)在标准放射治疗(70 Gy)中的第1、22、43天给予DDP 100 mg/m2化疗。中位随访10.8年,诱导化疗、同期化疗组和单纯放疗组的10年LFS分别为28.9%、23.5%和17.2%,与单纯放疗相比,诱导化疗(HR=0.75,95%CI:0.59~0.95,P=0.02)和同期化疗组(HR=0.78,95%CI:0.78~0.98,P=0 .03)的LFS均明显提高,但2个化疗组的LFS类似。三组之间总生存率差异无统计学意义。同期放化疗组在局部区域性控制率和喉保留率方面均优于单纯放疗和诱导化疗。
2009年发表的一项针对局部晚期头颈部鳞癌、包括93个临床随机研究的荟萃分析的更新结果显示[17],手术或放射治疗前的诱导化疗未能提高总生存率(HR=0.96,95%CI:0.90~1.02),但如采用PF方案诱导化疗,则总生存率获得显著的提高(HR=0.90,95%CI:0.82~0.99)。与单纯放疗相比,同期化疗降低了肿瘤相关死亡率,年龄越大受益越小,70岁以上患者无受益。但同期化疗在OS上并未较诱导化疗提高(HR=0.90,P=0.15)。进一步分析发现,CCRT在局部失败方面更有优势,而诱导化疗在降低远处转移方面更有优势。辅助化疗未较单纯局部治疗提高OS(HR=1.06,95%CI:0.95~1.16)。
3 含紫杉烷类诱导化疗方案在局部晚期头颈部鳞癌中的作用
PF方案是头颈部鳞癌的标准化疗方案,具有较高的完全缓解率和生存率。近年来,有4项大样本的Ⅲ期临床研究证实[18-23],在PF方案的基础上加用紫杉烷类药物比传统的PF方案对头颈部鳞癌更为有效。其中最具代表性的是TAX323[20]和TAX324[21-22]两项研究。TAX323临床研究入组了358例不可手术切除的局部区域性晚期头颈部鳞癌(不包括鼻咽、鼻腔鼻窦)患者,根据治疗中心和原发肿瘤分层后,患者随机接受了TPF方案或PF方案的诱导化疗。TPF方案为多西他赛(75 mg/m2,第1天)+DDP (75 mg/m2,第1天)+5-FU (750 mg/m2,第1~5天);PF方案为DDP(100 mg/m2,第1天)+5-FU(1 000 mg/m2·d,第1~5天),TPF方案和PF方案均以3周为1个周期,4个周期化疗后继以单纯放疗(常规分割、超分割、加速分割)。新辅助化疗后两组患者的有效率分别为67.8%和53.6%(P=0.007),经过32.5个月的中位随访期,分析结果显示TPF方案治疗组的无进展生存率和总生存率更优(HR=0.72,95%CI:0.57~0.91,P=0.007;HR=0.73,95%CI:0.56~0.94,P=0.02),两组患者的中位无进展生存期(progression free survival,PFS)分别为11个月和8.2个月,中位生存期分别为18.8个月和14.5个月。TAX324临床研究入组了501例局部晚期头颈部鳞癌,根据原发肿瘤分期、N分期和治疗中心分层后,患者随机接受了TPF方案或PF方案的诱导化疗,TPF方案为多西他赛(75 mg/m2,第1天)+DDP (100 mg/m2,第1天)+5-FU (1 000 mg/m2,第1~5天);PF方案为DDP(100 mg/m2,第1天)+5-FU (1 000 mg/m·d,第1~5天),3个周期化疗后患者给予同期放化疗[21-22]。中位随访期72.2个月,TPF组总生存率明显高于PF组(HR=0.74,95% CI:0.58~0.94),5年总生存率分别为52%和42%,中位生存期分别为70.6个月和34.8个月,TPF组的PFS也优于PF组(HR=0.75,95%CI:0.60~0.94),中位PFS分别为38.1个月和13.2个月。
近期,共计1 772例局部晚期头颈部鳞癌的荟萃分析[24-25],比较了TPF和PF方案作为诱导化疗的有效性。中位随访4.9年,结果显示死亡HR=0.79(95%CI:0.70~0.89,P<0.001),TPF和PF诱导化疗的5年总生存率分别为42.4%和35.0%,TPF较PF提高了7.4%(95%CI:2.3~12.5)的生存率,TPF还降低了肿瘤进展率(HR=0.78,95%CI:0.69~0.87,P<0.001)、局部区域性失败率(HR=0.79,95%CI:0.66~0.94,P=0.007)和远处转移率(HR=0.63,95%CI:0.45~0.89,P=0.009)。
4 诱导化疗联合同期放化疗
同期放化疗仍是局部晚期头颈部鳞癌非手术治疗的标准治疗策略,在同期放化疗前加用诱导化疗的作用尚未明确。
在一项Ⅱ期临床研究中[26],101例局部晚期头颈部癌患者随机分为序贯放化疗组(TPF诱导化疗+同期放化疗)和同期放化疗组。序贯放化疗组较同期放化疗组提高了影像学上完全缓解率(首要观察终点,50% vs 20%),中位总生存期(overall survival,OS,40个月 vs 33个月)和中位PFS(30个月 vs 20个月)有所延长,但两组间差异无统计学意义。
近期发表的3项临床随机研究未能明确序贯放化疗优于同期放化疗[27-28]。在PARADIGM研究中[27],145例头颈部鳞癌患者随机分为序贯放化疗组和同期放化疗组,序贯放化疗组先给予标准的TPF方案诱导化疗,然后根据肿瘤对诱导化疗的敏感性而给予不同的同期化疗,诱导化疗敏感者每周给予卡铂AUC1.5,不敏感者每周给予多西他赛20 mg/m2。同期放化疗组的同期化疗方案为放疗第1、4周给予DDP单药。放疗采用同期加量加速分割方式。该研究计划入组300例患者,但由于入组患者数而提前结束。中位随访49个月,3年总生存率分别为73%和78%),两组间差异无统计学意义。另一项来自西班牙头颈部肿瘤协作组(Spanish Head and Neck Cancer Cooperative Group,TTCC)的临床研究[24]针对局部晚期不能手术切除的头颈部鳞癌,439例患者随机分为TPF诱导化疗+同期放化疗组(TPF+CCRT)、PF诱导化疗+同期放化疗组(PF+CCRT)和单纯同期放化疗组,中位PFS分别为14.6个月(95%CI:11.6~20.4)、14.3个月(95%CI:11.8~19.3)和13.8个月(95% CI:11.0~17.5),3组之间差异无统计学意义(P=0.56)。2012年ASCO会议上报道了DeCIDE研究结果[28],280例患者随机分为序贯放化疗组和同期放化疗组,序贯放化疗组先给予2个周期的TPF方案诱导化疗。结果两组在生存率、无复发生存率和无远处转移生存率上差异均无统计学意义。然而,并不能根据这3项临床研究而否定序贯治疗的作用,主要基于以下原因:入组病例数不够,研究提前结束;未做人乳头状瘤病毒(human papillomavirus,HPV)检测而可能包括了预后较好的HPV阳性患者。
综上所述,同期放化疗在局部失败方面更有优势,而诱导化疗在降低远处转移方面则更有优势。总体上,包含同期放化疗的治疗策略是目前局部晚期头颈部鳞癌最为有效的非手术治疗方式。在诱导化疗方案的选择上,多项Ⅲ期临床研究和荟萃分析结果显示,TPF方案较PF方案明显提高了总生存率。但是,在同期放化疗前使用诱导化疗的序贯放化疗是否较单纯同期放化疗提高生存率尚不明确,近期报道的Ⅲ期临床随机研究的初步结果显示,序贯放化疗并未较单纯同期放化疗提高生存率,其结论有待商榷。序贯放化疗可能适用于那些具有高风险远处转移(N2c、N3)或局部失败率高(T2-4)且一般情况良好的患者,而并非适用于所有的患者,其作用还有待于Ⅲ期临床研究结果的佐证。
[1] ARGIRIS A. Induction chemotherapy for head and neck cancer: will history repeat itself? [J]. J Natl Compr Canc Netw, 2005, 3: 393-403.
[2] DEPONDT J, GEHANNO P, MARTIN M, et al. Neoadjuvant chemotherapy with carboplatin/5-fluorouracil in head and neck cancer[J]. Oncology, 1993, 50(Suppl 2): 23-27.
[3] DOMENGE C, HILL C, LEFEBVRE J L, et al. Randomized trial of neoadjuvant chemotherapy in oropharyngeal carcinoma[J]. Br J Cancer, 2000, 83: 1594-1598.
[4] JACOBS C, GOFFINET D R, GOFFINET L, et al. Chemotherapy as a substitute for surgery in the treatment of advanced resectable head and neck cancer. A report from the Northern California Oncology Group[J]. Cancer, 1987, 60: 1178-1183.
[5] The Department of Veterans Affairs Laryngeal Cancer Study Group. Induction chemotherapy plus radiation compared with surgery plus radiation in patients with advanced laryngeal cancer[J]. N Engl J Med, 1991, 324: 1685-1690.
[6] LEFEBVRE J L, CHEVALIER D, LUBOINSKI B, et al. Larynx preservation in pyriform sinus cancer: Preliminary results of a European Organization for Research and Treatment of Cancer phase Ⅲ trial[J]. J Natl Cancer Inst, 1996, 88: 890-899.
[7] LEFEBVRE J L, ANDRY G, CHEVALIER D, et al. Laryngeal preservation with induction chemotherapy for hypopharyngeal squamous cell carcinoma: 10-year resultsof EORTC trial 24891[J]. Ann Oncol, 2012, 23: 2708-2714.
[8] BRIZEL D M, ALBERS M E, FISHER S R, et al. Hyperfractionated irradiation with or without concurrent chemotherapy for locally advanced head and neck cancer[J]. N Engl J Med, 1998, 338: 1798.
[9] CALAIS G, ALFONSI M, BARDET E, et al. Randomized trial of radiation therapy versus concomitant chemotherapy and radiation therapy for advanced-stage oropharynx carcinoma[J]. J Natl Cancer Inst, 1999, 91: 2081.
[10] DENIS F, GARAUD P, BARDET E, et al. Final results of the 94-01 French Head and Neck Oncology and Radiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced-stage oropharynx carcinoma[J]. J Clin Oncol, 2004, 22(1): 69-76.
[11] ADELSTEIN D J, LI Y, ADAMS G L, et al. An Intergroup phase III comparison of standard radiation therapy and two schedules of concurrent chemoradiotherapy in patients with unresectable squamous cell head and neck cancer[J]. J Clin Oncol, 2003, 21: 92-98.
[12] STAAR S, RUDAT V, STUETZER H, et al. Intensified hyperfractionated accelerated radiotherapy limits the additional benefit of simultaneous chemotherapy--results of a multicentric randomized German trial in advanced head-andneck cancer[J]. Int J Radiat Oncol Biol Phys, 2001, 50(5): 1161-1171.
[13] JEREMIC B, SHIBAMOTO Y, MILICIC B, et al. Hyperfractionated radiation therapy with or without concurrent low-dose daily cisplatin in locally advanced squamous cell carcinoma of the head and neck: a prospective randomized trial[J]. J Clin Oncol, 2000, 18: 1458-1464.
[14] HUGUENIN P, BEER K T, ALLAL A, et al. Concomitant cisplatin significantly improves locoregional control in advanced head and neck cancers treated with hyperfractionated radiotherapy[J]. J Clin Oncol, 2004, 22(23): 4665-4673.
[15] FORASTIERE A A, GOEPFERT H, MAOR M, et al. Concurrent chemotherapy and radiotherapy for organ preservation in advanced laryngeal cancer[J]. N Engl J Med, 2003, 349: 2091-2098.
[16] FORASTIERE A A, ZHANG Q, WEBER R S, et al. Long-term results of RTOG 91-11: a comparison of three nonsurgical treatment strategies to preserve the larynx in patients with locally advanced larynx cancer[J]. J Clin Oncol, 2013, 31: 845-852.
[17] PIGNON J P, LE MAÎTRE A, MAILLARD E, et al. Metaanalysis of chemotherapy in head and neck cancer (MACHNC): an update on 93 randomised trials and 17,346 patients[J]. Radiother Oncol, 2009, 92: 4.
[18] HITT R, LÓPEZ-POUSA A, MARTÍNEZ-TRUFERO J, et al. Phase III study comparing cisplatin plus fluorouracil to paclitaxel, cisplatin, and fluorouracil induction chemotherapy followed by chemoradiotherapy in locally advanced head and neck cancer[J]. J Clin Oncol, 2005, 23: 8636-8645.
[19] HITT R, GRAU J J, LOPEZ-POUSA A, et al. Final results of a randomized phase III trial comparing induction chemotherapy with cisplatin/5-FU or docetaxel/cisplatin/5-FU follow by chemoradiotherapy (CRT) versus CRT alone as first-line treatment of unresectable locally advanced head and neck cancer (LAHNC)[J]. J Clin Oncol, 2009, 15s: 6009.
[20] VERMORKEN J B, REMENAR E, VAN HERPEN C, et al. Cisplatin, fluorouracil, and docetaxel in unresectable head and neck cancer[J]. N Engl J Med, 2007, 357(17): 1695-1704.
[21] POSNER M R, HERSHOCK D M, BLAJMAN C R, et al. Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer[J]. N Engl J Med, 2007, 357: 1705-1715.
[22] LORCH J H, GOLOUBEVA O, HADDAD R I, et al. Induction chemotherapy with cisplatin and fluorouracil alone or in combination with docetaxel in locally advanced squamous-cell cancer of the head and neck: Long-term results of the TAX 324 randomised phase 3 trial[J]. Lancet Oncol, 2011, 12: 153-159.
[23] POINTREAU Y, GARAUD P, CHAPET S, et al. Randomized trial in induction chemotherapy with cisplatin and 5-fluorouracil with or without docetaxel for larynx preservation[J]. J Natl Cancer Inst, 2009, 101: 498-506.
[24] HITT R, GRAU J J, LÓPEZ-POUSA A, et al. A randomized phase III trial comparing induction chemotherapy followed by chemoradiotherapy versus chemoradiotherapy alone as treatment of unresectable head and neck cancer[J]. Ann Oncol, 2013[Epub ahead of print].
[25] BLANCHARD P, BOURHIS J, LACAS B, et al. Taxanecisplatin-fluorouracil as induction chemotherapy in locally advanced head and neck cancers: an individual patient data meta-analysis of the meta-analysis of chemotherapy in head and neck cancer group[J]. J Clin Oncol, 2013, 31: 2854-2860.
[26] PACCAGNELLA A, GHI M G, LOREGGIAN L, et al. Concomitant chemoradiotherapy versus induction docetaxel,cisplatin and 5 fluorouracil (TPF) followed by concomitant chemoradiotherapy in locally advanced head and neck cancer: a phase II randomized study[J]. Ann Oncol, 2010, 21: 1515.
[27] HADDAD R, O'NEILL A, RABINOWITS G, et al. Induction chemotherapy followed by concurrent chemoradiotherapy (sequential chemoradiotherapy) versus concurrent chemoradiotherapy alone in locally advanced head and neck cancer (PARADIGM): a randomised phase 3 trial[J]. Lancet Oncol, 2013, 14(3): 257-264.
[28] Cohen EEW et al. Docetaxel Based Chemoradiotherapy Plus or Minus Indicution Chemotherapy to Decrease Events in Head and Neck Cancer (DeCIDE) [J]. J Clin Oncol, 2012, (suppl: abstract #5500).
Non-surgical treatment of locoregionally advanced squamous cell carcinoma of the head and neck region
KONG Lin, LU Jia-de (Department of Radiation Oncology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
KONG Lin E-mail: konglinj@gmail.com
Definitive treatment for locoregionally advanced squamous cell carcinoma of the head and neck region (HNSCC) is challenging, and usually require multidisciplinary efforts involving surgery, radiotherapy, and chemotherapy. Although surgery followed by radiation or chemoradiation therapy remains the standard treatment for resectable disease, combined chemoradiation therapy provides an effective option with organ spearing potential. In addition, combined chemoradiation therapy is the only treatment option for non-metastatic advanced HNSCC. Recently published results from TAX323 and TAX324, two important randomized clinical trials on the efficacy of induction chemotherapy using docetaxel based regimen, showed that induction chemotherapy using TPF can significantly improve patients’ survival as compared to the conventional PF regimen. However, whether TP or TPF induction chemotherapy should be combined with concurrent chemoradiation and considered as part of the standard treatment regimen remains controversial, and requires support from the results of well-designed randomized clinical trial.
10.3969/j.issn.1007-3969.2013.12.005
R739.91
A
1007-3639(2013)12-0961-06
2013-12-03)
孔琳 E-mail: konglinj@gmail.com

