舌癌的间室外科
上海交通大学医学院附属第九人民医院口腔颌面-头颈肿瘤科,上海 200011
舌癌的间室外科
张陈平
上海交通大学医学院附属第九人民医院口腔颌面-头颈肿瘤科,上海 200011

张陈平,教授。主任医师,博士生导师。1982年毕业于原上海第二医学院口腔系,获学士学位。1992年获博士学位。后赴美国Mount Sinai医学中心和Sloan Kettering癌症中心进修学习。目前任职上海交通大学医学院附属第九人民医院口腔颌面-头颈肿瘤科主任,兼任中国抗癌协会头颈肿瘤外科专委会常委、上海头颈肿瘤诊治与转化医学中心执行主任以及国际口腔颌面外科协会口腔颌面肿瘤外科与修复重建培训中心主任。致力于口腔颌面-头颈肿瘤的临床与基础研究研究,尤其擅长头颈部缺损的修复重建,并作深入系列研究。成果获得上海市科技进步一等奖、中华医学二等奖和国家科技进步二等奖,并获得专利2项。善于研究总结,近年在国内外学术期刊发表论文200余篇,SCI收录20篇;主编专著1部,副主编2部。曾获上海市领军人才、优秀学科带头人、卫生局百人计划等人才项目资助。负责国家自然科学基金、上海生物医药重大等国家和省市级课题15余项。并创办国家级继续教育学术班“显微外科技术在口腔颌面外科中的应用”31期,已在国外举办4期,推动颌面头颈肿瘤外科技术的发展。
尽管多学科肿瘤综合序列治疗已逐渐应用于临床,但口腔癌的5年总生存率维持在45%~50%。回顾性研究显示,目前临床病理学特征很难确定肿瘤预后、复发率和生存率。然而,能否进行根治性切除并获取安全切缘则是影响口腔癌局部控制的最重要的因素。舌体分别由舌内肌和舌外肌组成。肌束走向及其密集分布的神经血管束使舌比其他口腔组织利于肿瘤向深层侵袭。舌癌浸润生长方式是沿着肌束方向或者神经血管束间隙前进的。单纯传统的距肿瘤边缘1~2 cm扩大切除未能切除深面肌束。舌癌切除需参照解剖间室切除原则,这使得原发肿瘤和颈部淋巴结构之间潜在的侵袭途径可以被完整的切除,达成更彻底的根治目标, 可以提高局控率。相比之下,舌淋巴系统与其余口腔癌淋巴回流有差异,即使en-bloc切除也未见将其舌淋巴结包涵在内,唯独间室切除可将舌淋巴结暴露于手术野内并完整切除。间室切除作为舌癌原发灶外科根治的一种术式,已经初步展现其科学性和可行性,同时也证实了局控率的改善。因此,今后需要共同探索口腔癌的发生发展规律和肿瘤浸润转移特点,寻求不同部位口腔癌间室切除的规范模式,增强口腔癌外科治疗的根治力度,努力提高患者的生存率。
口腔癌;舌癌;间室外科;生存率
头颈癌是排名第6的恶性肿瘤,口腔癌发病率占头颈癌45%[1-3]。口腔癌的发生率存在地域性差异。中国台湾、南方地区为高发区域,尤其是印度和东南亚国家每年新发病率占全身疾病的25%,而癌症发生率低的国家每年也有3%[1]。流行病学研究显示在口腔恶性肿瘤中,舌癌占25%~40%[4]。其发病率与致死率呈攀升趋势。尽管科学在不断的进步,多学科肿瘤综合序列治疗也逐渐应用于临床,但如今肿瘤患者的总体生存率与过去30年相比并无显著改善,5年总生存率维持在45%~50%[5-7]。回顾性研究显示,目前临床病理学特征很难确定肿瘤预后、复发率和生存率。然而,能否进行根治性切除并获取安全切缘则是影响口腔癌局部控制的最重要的因素。如果肿瘤未能彻底切除,最终将引起局部复发,甚至远处转移[8]。
1 舌体的解剖特点与肿瘤侵袭
舌体本身是个复杂的肌肉器官,分别由舌内肌和舌外肌组成。肌束走向及其密集分布的神经血管束使舌比其他口腔组织利于肿瘤向深层侵袭[4]。同时,恶性肿瘤病灶的三维微结构是不规则的,其病灶结构的复杂性与肿瘤的恶性程度呈正相关;恶性程度越高,其三维微结构则越复杂。鳞状细胞癌的浸润前缘为小指状凸出的方式侵润生长[9]。浸润前缘是肿瘤细胞密度最高的区域,其细胞分化增殖也是最高峰。舌癌浸润生长方式是沿着肌束方向或者神经血管束间隙前进的。单纯传统的距肿瘤边缘1~2 cm扩大切除未能切除深面肌束,再加上术中肌肉痉挛并收缩到深面易被遗留,这些肌肉很可能存有残余肿瘤细胞。
2 间室外科的临床意义
肢体骨骼肌肉瘤的切除在解剖上学提倡间室外科,即强调切除范围包括受累肌肉的起始端至终末端,其根治术理念更强,并且改革了传统的盲目扩大切除[10-11]。舌体属于肌肉器官,不同类型的外科技术处理对肌肉的扭曲有着不同程度的影响。刀片切除对肌肉的抽搐和收缩影响最低,其次为超声刀;使用单极电刀则会引起最大程度的肌肉抽搐、收缩和组织扭曲[12]。Johnson等[13]报道肌肉区域收缩程度要大于黏膜区域,舌黏膜区域平均收缩为30.7%,收缩最大的部分为肌肉区域,为34.5%,以肿瘤为中心的三维视点上看,肌肉收缩面则是肿瘤的深面或底部。研究显示舌癌阳性切缘发生于下切缘,又称外侧黏膜边缘(口底)(31.7%)最为频繁,其次为深部/底切缘(肌肉部分)(26.7%);再次分别为后(11.9%)、上/内侧(10.9%)和前切缘(5.9%)。这些说明了传统的1~2 cm盲目扩大切除仍有不足之处,安全缘的可靠性有待进一步研究。
Yuen等[14]提倡在肿瘤浸润周围的正常组织行广泛切除,大部分的显微浸润组织可能将被一并切除。然而,他们却未明确其扩大的范围;并且该安全切缘与区域癌变理论(Field Cancerization)混淆。同时,他们也未能澄清“部分区域未能彻底切除”或“为保存重要器官而保守切除”的概念。然而,通过文献复习,可以认为首次手术彻底性切除是影响局部控制率及总生存率的最主要因素[12-13,15]。
侵袭性强的肿瘤容易沿着肌束、黏膜下淋巴系统和神经周围间隙浸润生长,术中切缘的冷冻切片检查为点状式的检测方式,并不足以鉴别其根治力度[12,15]。此外,(microscopic tumor cut-through,MTC)肿瘤边缘的微小切开理论说明了肿瘤外层的微小结构完整性一旦被破坏,其肿瘤种植的风险明显提高[12,16]。相关研究也提示了,MTC(在最初的手术切除过程中近切缘或阳性切缘),尽管再次扩大切除最终是获得阴性切缘,但是,将此类别与最初阴性切缘组进行对比,局部控制和总生存率差异有统计学意义,MTC组预后较差[16-17]。
舌体肌肉组织学结构与肢体骨骼肌相似,舌癌切除需遵循解剖间室切除(compartment resection)原则,这使得原发肿瘤和颈部淋巴结构之间潜在的侵袭途径(包涵了下颌舌骨肌、舌神经血管及舌下腺等)可以被完整的切除。Azzarelli等[18]报道了间室切除显著提高了局控率,其生存率为76%,与传统扩大切除(53%)相比,差异有统计学意义(P<0.001)。提示了对解剖学的深入理解和技术创新能改善局部区域控制率。因而,我们提倡舌癌手术治疗应以间室切除方式达成更彻底的根治目标,可以提高局控率。
3 舌体的解剖结构与间室概念
人类的舌体由左右对称的肌肉器官组成,舌体解剖边界为下颌骨膜(外界和前界)、舌骨(下界)及舌中隔(内界)。舌肌由舌內外肌组成。舌外肌的其中一头附着于骨面(包括下颌骨、舌骨和茎突);而舌內肌则起始及附着点均位于舌体。除了解剖学,同时需要考虑胚胎发育学,舌的区分界线与胚胎的发育是一致的。舌前三分之二起源于第一鳃弓(first pharyngeal arch);它开始于奇结节(tuberculum impar),两侧的侧舌隆突(lateral lingual swelling)向奇结节两侧迅速生长,于中线融合最终形成舌中隔 (median septum)。舌中隔解剖非常明确,解剖结构几乎未能见任何神经血管束穿过;它因此形成隔离膜,阻止感染或肿瘤超越此界[19]。并且其此解剖位置恒定,有助于规范性的半舌切除。舌后1/3即舌根起源于第2、3和部分第4鳃弓的中胚层。舌后1/3迅速生长并且与舌前2/3融合形成分界线,此V型皱褶分界线即为人字沟 (sulcus terminalis)。V型皱褶界线将舌分成口腔和口咽两大部分。
旁中隔(paramedian septum)是另一个明确的隔膜,紧贴颏舌肌外侧向后、向外延伸形成斜面三角形,较宽的底位于后部,狭窄部分位于前下部,随后附着于中线隔膜和舌骨。其隔膜外侧有纵向肌群 (combined longitudinal muscle)。纵向肌群是由舌上纵肌(superior longitudinal muscle)、舌下纵肌 (inferior longitudinal muscle)、茎突舌肌(styloglossus muscle)和舌骨舌肌(hyoglossus muscle)组成[20]。舌动脉及伴行静脉位于此隔膜中。
4 不同临床分期舌癌的间室切除术式
T1期的舌癌,如果临床检查观察到舌体形态对称,活动灵活自如,伸舌无受限,伸舌时舌尖无偏移,舌尖无阻力地旋转并能触及双侧口角;则可认为肿瘤的侵袭仍处于浅表位置。结合舌神经肌肉组织学和临床表现,沿旁中隔(paramedian septum)将其隔膜外侧的纵向肌肉群进行长轴间室切除,且能彻底切除肿瘤及其潜在的侵袭途径。如果临床上诊断为cN0,可暂不行预防性颈淋巴清扫,选择严密观察,必要时再行颈淋巴清扫术。
相关研究证实舌淋巴系统在进入颌下及颈部淋巴区域之前,沿舌下腺分布于口底[21-25]。舌淋巴结可分为两种:①舌旁淋巴结位于颏舌肌的外侧,于旁中隔的间隙内;②舌中隔淋巴结位于双侧颏舌肌中间[21,26]。由于舌旁淋巴结较小,与舌下腺关系密切并且离原发灶也比较近,导致术前CT或MRI检查难以鉴别[26-28]。舌部淋巴可引流至舌淋巴结(舌旁淋巴结、舌中隔淋巴结),以及舌动脉根部淋巴结[22,26],继续进展或者不停留而直接进入颌下及颈部淋巴结[22,29]。
然而到目前为止,大部分的外科医生对于舌淋巴结不够重视;加上舌动脉根部淋巴结解剖学上是被舌骨舌肌所遮挡,术者如果没有注意解剖,则很容易被忽略而残留[26]。因此术中仔细探查是必要的,如果按照间室切除(切除了下颌舌骨肌和舌骨舌肌),其舌动脉根部淋巴结将暴露于手术视野中。舌淋巴结回流系统中的舌旁和舌动脉根部的淋巴结将被彻底切除。
T2期以上的舌癌则更应提倡间室切除。间室切除始于颈淋巴清扫,从下往上。原发灶切除始于下颌舌骨肌、颏舌骨肌和下颌舌骨肌于舌骨骨面离断。舌动静脉在舌骨水平结扎后,根部舌淋巴结已被暴露于手术视野内。此步骤允许直视下探查肿瘤是否已浸润深部舌肌,如有肿瘤侵润,受累肌肉及舌骨将一并切除。随后,紧贴下颌骨内侧离断下颌舌骨肌的起始点,进入口底区域。经口入路切除则始于口底(外)、人字沟(后)、舌中线(内)和舌系带(舌腹内侧)的黏膜切除。舌下腺从口底黏膜分离,随即将连同舌标本一并en bloc切除。病灶未过中线者则沿舌中隔(包括舌中隔)行标准半舌切除,最后于后界人字沟切开,舌原发灶连同周围附着肌肉及颈部纤维脂肪组织整块切除,完成间室切除术。
如果病灶超过中线则需要更加广泛的根治术,甚至全舌切除;如果病灶向后发展接近或达到会厌,则根据具体情况考虑实施全舌全喉切除术。手术步骤在此不作详细描述。
5 展望
间室切除作为舌癌原发灶外科根治的一种术式,已经初步展现其科学性和可行性,值得同行们广泛重视,认真对待。今后需要在临床工作中不断实践,总结经验,多中心的广泛合作,共同探索口腔癌的发生发展规律和肿瘤浸润转移特点,深入研究,寻求不同部位口腔癌间室切除的规范模式,增强口腔癌外科治疗的根治力度,结合多学科肿瘤综合序列治疗,必将明显提高口腔癌患者的生存率。
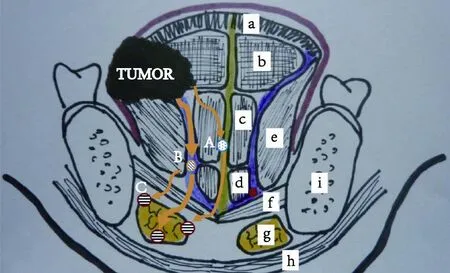
图 1 舌体剖面图(于第一磨牙位置)显示肌肉和隔膜的分布Fig. 1 Tongue body section (in the position of the first molar) shows that the distribution of the muscles and diaphragm
[1] WARNAKULASURIYA S. Living with oral cancer: epidemiology with particular reference to prevalence and lifestyle changes that influence survival[J]. Oral Oncol, 2010, 46(6): 407-410.
[2] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[3] WARNAKULASURIYA S. Global epidemiology of oral and oropharyngeal cancer[J]. Oral Oncol, 2009, 45(4-5): 309-316.
[4] BELLO I O, SOINI Y, SALO T. Prognostic evaluation of tongue: Means, markers, perspectives (I)[J]. Oral Oncol, 2010, 46: 630-635.
[5] BAGAN J V, SCULLY C. Recent advances in Oral Oncology 2007: epidemiology, aetiopathogenesis, diagnosis and prognostication[J]. Oral Oncol, 2008: 44(2): 103-108.
[6] JERJES W, UPILE T, PETRIE A, et al. Clinicopathological parameters, recurrence, locoregional and distant metastasis in 115 T1-T2 oral squamous cell carcinoma patients[J]. Head Neck Oncol, 2010, 2: 9.
[7] TANEJA C, ALLEN H, KONESS R J, et al. Changing patterns of failure of head and neck cancer[J]. Arch Otolaryngol Head Neck Surg, 2002, 128: 324-327.
[8] KURITA H, NAKANISHI Y, NISHIZAWA R, et al. Impact of different surgical margin conditions on local recurrence of oral squamous cell carcinoma[J]. Oral Oncol, 2010, 46: 814-817.
[9] SHIMAZU Y, KUDO T, YAGISHITA H, et al. Three-dimension visualization & quantification for growth and invasion of oral squamous cell carcinoma[J]. Japanese Dent Sci Review, 2010, 46: 17-25.
[10] KARAKOUSIS C P, KONTZOGLOU K, DRISCOLL D L. Anterior compartment resection of the thigh in soft-tissue sarcomas[J]. Eur J Surg Oncol, 1998, 24: 308-312.
[11] MENDENHALL W M, INDELICATO D J, SCARBOROUGH M T. The management of adult soft tissue sarcomas[J]. Am J Clin Oncol, 2009, 32: 436-442.
[12] COMEN E, NORTON L, MASSAGUE J. Clinical implications of cancer self-seeding[J]. Nat Rev Clin Oncol, 2011, 8(6): 369-377.
[13] JOHNSON R E, SIGMA J D, FUNK G F, et al. Quantification of surgical margin shrinkage in the oral cavity[J]. Head Neck, 1997, 19(4): 281-286.
[14] YUEN P W, LAM K Y, CHAN A C, et al. Clinicopathological analysis of local spread of carcinoma of the tongue[J]. Am J Surg, 1998, 175: 242-244.
[15] SUTTON D N, BROWN J S, ROGERS S N, et al. The prognostic implications of the surgical margin in oral squamous cell carcinoma[J]. Int J Oral Maxillofac Surg, 2003, 32: 30-34.
[16] SCHOOL P, BYERS R M, BATSAKIS J G, et al. Microscopic cut-through of cancer in the surgical treatment of squamous carcinoma of the tongue. Prognostic and therapeutic implications[J]. Am J Surg, 1986, 152: 354-360.
[17] PATEL R S, GOLDSTEIN D P, GUILLEMAUD J, et al. Impact of positive frozen section microscopic tumor cutthrough revised to negative on oral carcinoma control and survival rates[J]. Head & Neck, 2010, 32(11): 1444-1451.
[18] AZZARELLI A. Surgery in soft tissue sarcomas[J]. Eur J Cancer, 1993, 29A[4]: 618-623.
[19] MU L, SANDERS I. Human tongue neuroanatomy: Nerve supply and motor endplates[J]. Clin Anat, 2010, 23(7): 777-791.
[20] SHIMAZU Y, KUDO T, YAGISHITA H, et al. Threedimension visualization & quantification for growth and invasion of oral squamous cell carcinoma[J]. Japanese Dent Sci Review, 2010, 46: 17-25.
[21] UMEDA M, MINAMIKAWA T, SHIGETA T, et al. Metastasis to the lingual lymph node in patients with squamous cell carcinoma of the floor of the mouth: a report of two cases[J]. Kobe J Med Sci, 2009, 55: E67-E72.
[22] HAN W, YANG X, HUANG X, et al. Metastases to lingual lymph nodes from squamous cell carcinoma of the tongue[J]. Br J Oral Maxillofacial Surg, 2008, 46: 376-378.
[23] CALABRESE L, RENNE G, DE CICCO C, et al. Letter to editor[J]. Head Neck, 2003, 25: 341-342.
[24] KATAYAMA T. Anatomical study of the lymphatic system of the mouth[J]. J Nippon Dent Assoc, 1943, 30: 647-774.
[25] HAAGENSEN C D. The lymphatics in cancer[J]. Philadelphia, PA: W.B.Saunders, 1972: 135-140.
[26] ANDO M, ASAI M, ONO T, et al. Metastases to the lingual nodes in tongue cancer: A pitfall in a conventional neck dissection[J]. Auris Nasus Larynx, 2010, 37: 386-389.
[27] DUTTON J M, GRAHAM S M, HOFFMAN H T. Metastatic cancer to the floor of mouth: the lingual lymph nodes[J]. Head Neck, 2002, 24(4): 401-405.
[28] OZEKI S, TASHIRO H, OKAMOTO M, et al. Metastasis to the lingual lymph node in carcinoma of the tongue[J]. J Maxillofac Surg, 1985, 13: 1277-1281.
[29] OMURA K, YANAI C, YAMASHITA T, et al. Diagnosis and management of lingual lymph node metastases[J]. Int J Oral and Maxillofacial Surg, 1997, 26: 45.
Compartmental tongue surgery
ZHANG Chen-ping (Department of Oral & Maxillofacial – Head & Neck Oncology, Ninth People’s Hospital Affiliated Shanghai Jiaotong University School of Medicine, Shanghai 200011, China)
ZHANG Chen-ping E-mail: zhang.chenping@hotmail.com
Despite the evolution in cancer management and the introduction of multidisciplinary treatmentmodalities, 5-year overall survival rate of oral cancer remained to be 45-50%. Retrospectively, one patient's prognosis, relapse pattern and survival were determined by clinicopathological parameters. Nevertheless, radical resection with adequate safe margins is crucial for local control in treatment strategy for oral cancer. However, orthogonally muscle orientation of tongue with enriched neurovascular bundles and lymphatic network make it disadvantaged for progressive deep tumor invasion and regional metastasis. Tumor spread along the muscle fibers following the path of least resistance, this thereby reflected the shortcomings of conventional 1-2cm circumferential wide excision. Compartment resection is removal of entire primary lesion along with its entire potential spreading path with an advantage in removing the potential spreading path. Contrary, lymphatic drainage of tongue cancer is outstanding, there is overtly existence of lymphatic vessels and lingual lymph node which occult lymph node metastasis might easily being overshadowed. Routine neck dissection is disadvantaged for unable to reach. Nevertheless, compartmental surgery can overcome it by bringing lingual lymphatic system into surgical field. Compartment resection is more appreciable than conventional 1-2cm wide resection in fulfilling oncological radicality criteria. In summary, we need to explore the characteristic pattern of tumor invasion and metastasis for other subtypes of oral cancer, thereby establishing a location orientated compartment resection, subsequently enhance the radicality of surgical management and strive to improve the survival rate.
Oral cancer; Tongue cancer; Compartment surgery; Survival rate
10.3969/j.issn.1007-3969.2013.12.001
R739.86
A
1007-3639(2013)12-0937-05
2013-11-20)
张陈平 E-mail:zhang.chenping@hotmail.com

