Aurora-A促进胰腺癌细胞放射抵抗的机制研究
复旦大学附属肿瘤医院实验研究中心,复旦大学上海医学院肿瘤学系,上海200032
Aurora-A促进胰腺癌细胞放射抵抗的机制研究
孙会贞 杨恭
复旦大学附属肿瘤医院实验研究中心,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:Aurora-A属于丝氨酸和苏氨酸蛋白激酶家族,其异常表达可导致肿瘤发生及其对放射线的抵抗,本研究旨在探讨Aurora-A与细胞放射敏感的相关性。方法:用Aurora-A激酶抑制剂处理Capan-1细胞,检测细胞增殖、锚定非依赖性生长和细胞周期及其周期相关蛋白的变化;处理的细胞同时用γ线照射,然后用流式细胞术检测细胞凋亡。结果:Aurora-A激酶抑制剂处理后,Capan-1细胞生长速度减慢,克隆形成率降低;Aurora-A抑制可引起细胞周期G1/S以及G2/M期转化阻滞,Cyclin D1、CDK2和CDK6表达下降。Aurora-A激酶抑制剂处理后可以提高放射线照射诱导的细胞凋亡率。结论:Aurora-A激酶抑制剂可抑制胰腺癌细胞增殖,阻滞细胞周期,促进细胞对放射线照射的敏感性。因此,Aurora-A可能是胰腺癌放射治疗增敏的靶向分子之一。
Aurora-A;胰腺癌;放射敏感性
Aurora-A又称为BTAK[1]、STK15[2]、AIKI[3]等,是丝氨酸和苏氨酸蛋白激酶家族成员[4],其在胰腺癌[5]、乳腺癌[6]等多种肿瘤中均高表达。Aurora-A可通过调节中心体复制,纺锤体组装以及染色体分离[7-8]等参与有丝分裂,并且可以通过与Cyclin B1[9]、P53以及BRCA1/2相互作用调节细胞周期检查点,维持基因组完整性[10]。近期研究发现Aurora-A与某些肿瘤放疗抵抗相关,但其机制尚不明了。本研究选取Aurora-A高表达的胰腺癌细胞系Capan-1进行研究,用Aurora-A激酶抑制剂对其处理后发现,Aurora-A激酶抑制剂可通过阻滞细胞周期进展,抑制细胞周期蛋白表达等明显增加其放射线敏感性。胰腺癌是致死率最高的恶性肿瘤之一,其病死率接近100%[11],且往往不能通过单纯的手术治疗改善5年生存率,必须通过手术联合放疗等综合治疗达到延长生存期的目的。因此,抑制Aurora-A激酶活性有可能对胰腺癌放射治疗具有增敏作用。
1 材料和方法
1.1 材料和试剂
人胰腺癌细胞系Capan-1和HPAFⅡ购自美国ATCC公司;PI (Propidium Iodide,P4170) 为美国 Sigma公司产品;流式凋亡试剂盒(556547)购自BD公司;BCA试剂盒(P0012)购自碧云天公司;HRP化学发光试剂盒(WBKLS0500)购自Millipore公司;Aurora-A (CS-3042)、p-Aurora-A(Thr288,CS-3079)、Cyclin D1(CS-2922)、CDK2(cyclin-dependent kinase 2,CS-2546)、CDK6(cyclin-dependent kinase 6,CS-3136)等抗体购自Cell Signaling Technology公司;β-actin抗体(A5316)购自Sigma公司;Aurora-A激酶抑制剂VX680(S1048)购自美国 Selleck公司。
1.2 方法
1.2.1 荧光定量PCR
收集细胞2×106个,然后用TRIzol试剂(Invitrogen, Carlsbad, CA)提取RNA;用逆转录试剂盒将总RNA转录成cDNA,用Ex-Script Sybr green QPCR试剂盒(TaKaRa)进行PCR反应,反应体系含10×buffer、MgCl2、dNTP、Tag酶、引物、cDNA模板、DEPCH2O等。PCR反应条件为,42 ℃温育15 min,95 ℃温育2 min,95 ℃变性5 s,62 ℃退火延伸31 s,共40个循环。实验重复3次。GAPDH引物:5’-GGCCTCCAAGGAGTAAGACC-3’(正向引物)和5’-CAAGGGGTCTACAT GGCAAC-3’(反向引物);Aurora-A引物:5-TCCATCTTCCAGGAGGACCAC-3(正向引物),5’-CCAGAGATCCACCTTCTCATC-3’(反向引物)。由PCR反应曲线得到阈值循环数(Ct),以GAPDH作为内参照,用2-△△CT法计算Aurora-A mRNA相对表达量。
1.2.2 免疫印迹检测
用胰酶消化细胞后收集细胞沉淀,用预冷的PBS洗涤细胞2次,加入蛋白裂解液,置冰上30 min,4 ℃,15 000×g离心10 min,收集蛋白裂解液。用BCA试剂盒测定蛋白浓度,然后将蛋白用6×上样缓冲液以及细胞裂解液稀释,之后煮沸5 min。将变性后的蛋白25 μg经SDSPAGE电泳后,100 V恒压转膜2 h,然后用5%脱脂奶粉封闭该膜2 h,之后加入一抗(1%脱脂奶粉1∶1 000稀释),室温温育2 h,1%TBST(Tris-Buffered Saline and Tween 20)洗膜3次(每次15 min),然后加入辣根过氧化物酶标记的鼠抗/兔抗(1%脱脂奶粉1∶1 000稀释),室温温育1 h,用1%TBST洗膜3次(每次15 min)。最后用Millipore化学发光剂于暗室中对PVDF膜进行曝光和显影。
1.2.3 细胞计数
将细胞种植于6孔板,每孔5×104个,在37 ℃、CO2体积分数为5%的细胞培养箱中培养,每2天计数1次,共计数8 d,绘制细胞生长曲线。每孔设置3个副孔。
1.2.4 软琼脂克隆形成试验
在60 mm细胞培养皿中提前制备0.7%低熔点琼脂糖底胶(2 mL 1.4%低熔点琼脂糖与2 mL 2×DMEM培养基混合制备而成),4 ℃冰箱保存,在用之前提前1 h置于37 ℃细胞培养箱中预热。用胰酶将细胞消化成单细胞后,将1×103个细胞悬浮于0.5 mL含20%胎牛血清的2×DMEM培养液中。将0.5 mL细胞与培养基混合物与0.5 mL 0.7%的低熔点琼脂糖混合均匀后悬于已制备好的0.7%低熔点琼脂糖底胶之上。待上层琼脂糖凝固后,置入37 ℃,CO2体积分数为5%的温箱中培养21 d,然后拍照计数,在此过程中每7 d加1 mL不含细胞的上层琼脂糖避免细胞干燥。
1.2.5 凋亡检测
收集细胞5×105个,在1 200×g的条件下离心5 min,用PBS清洗2次,向细胞沉淀中加入100 μL 1×buffer,然后向buffer中加入5 μL An-nexin-Ⅴ FITC,5 μL PI,避光,室温温育15 min。流式细胞仪分析:流式细胞仪激发光波长为488 nm,并用一波长为515 nm的通带滤器检测FITC荧光,另一波长>560 nm的滤器检测PI。
1.2.6 细胞周期检测
细胞生长至对数期时,胰酶消化细胞,PBS清洗,在1 000×g的条件下离心5 min,沉淀重悬于75%乙醇,-20 ℃固定4 h以上。用PBS清洗,在1 200×g的条件下离心5 min,收集细胞,将细胞重悬于含100 μg/mL的RNaseA和50 μg/mL的PI的PBS中,室温温育30 min,之后用流式细胞仪检测细胞周期。
1.2.7 细胞系处理
应用荧光定量PCR和蛋白质印迹法(Western blot)在胰腺癌的两个细胞系Capan-1和HPAFⅡ中分别检测Aurora-A mRNA和蛋白水平的变化,然后选择Aurora-A高表达的细胞系Capan-1进行研究。用DMSO溶剂处理组做为对照(control),用300 nmol/L VX680处理细胞12 h,通过Western blot检测p-Aurora-A (Thr288)蛋白表达水平,然后根据1.2.3和1.2.4所示实验方法检测Aurora-A激酶抑制剂对细胞增殖和体外克隆的影响。应用300 nmol/L VX680处理细胞2 h,然后对其进行18 Gy γ射线照射,4 d后用流式细胞术检测细胞凋亡水平,并用等量DMSO溶剂处理组做为对照(control),进行相同处理,检测Aurora-A激酶抑制剂对细胞凋亡的影响。
实验分为3组:抑制剂组、对照组和抑制剂加放射线组。其中抑制剂组采用300 nmol/L Aurora-A激酶抑制剂VX680处理Capan-1细胞12 h后收集细胞沉淀,对照组采用等量DMSO溶剂处理Capan-1细胞12 h后收集细胞沉淀,抑制剂加放射线组采用300 nmol/L VX680处理细胞2 h,然后对其进行18 Gy γ射线照射,10 h后收集细胞沉淀。应用流式细胞术检测细胞周期,并采用Western blot检测周期相关蛋白的变化。
1.3 统计学处理
实验数据采用SPSS 17.0软件进行整理和统计分析。计量数据采用t检验,P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结 果
2.1 抑制Aurora-A激酶活性阻滞胰腺癌细胞增殖和体外瘤性生长
荧光定量PCR和Western blot检测结果显示,Capan-1细胞株Aurora-A基因和蛋白水平明显高于HPAF Ⅱ(图1A、B),因此本研究选择Aurora-A高表达的Capan-1细胞株进行进一步研究。
由于VX680可降低Aurora-A激酶磷酸化活性位点Thr288的自我磷酸化来抑制Aurora-A激酶活性,本研究发现,VX680成功降低了p-Aurora-A表达水平(图1C),证实了VX680确可降低Aurora-A激酶活性,且较对照组VX680处理后细胞生长速度明显减慢(图1D),体外克隆数亦明显减少(图1E、F)。表明Aurora-A激酶抑制剂可抑制胰腺癌细胞增殖和锚定非依赖性生长。
2.2 Aurora-A激酶抑制剂促进胰腺癌细胞对放射线的敏感性
尽管细胞早期凋亡差异无统计学意义,但抑制剂组细胞经放射线照射后晚期凋亡比例(50.7%)明显高于对照组(23.8%)(图2A、B),Aurora-A激酶抑制剂可促进胰腺癌细胞的放射线敏感。
2.3 Aurora-A激酶抑制剂促进胰腺癌细胞放射线敏感的机制
本研究结果显示,抑制剂组较对照组G0/G1期增加13.7%,G2/M期增加25.4%,而S期减低39.2%,抑制剂加放射线组较对照组G0/G1期增加更加明显,为23.1% (图3A、B、C)。Western blot检测结果显示,抑制剂组较其对照组周期蛋白Cyclin D1、CDK2和CDK6均降低,γ射线处理后周期蛋白减低更加明显(图3D)。
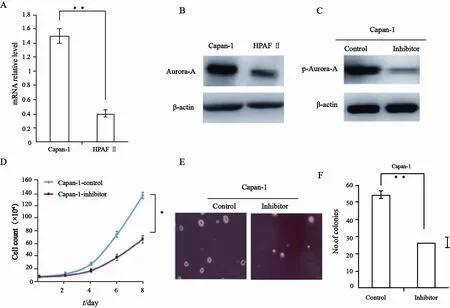
图 1 Aurora-A激酶抑制剂对细胞增殖和锚定非依赖性生长的影响Fig. 1 Effect of Aurora-A kinase inhibitor on cell proliferation and anchorage-independent growth
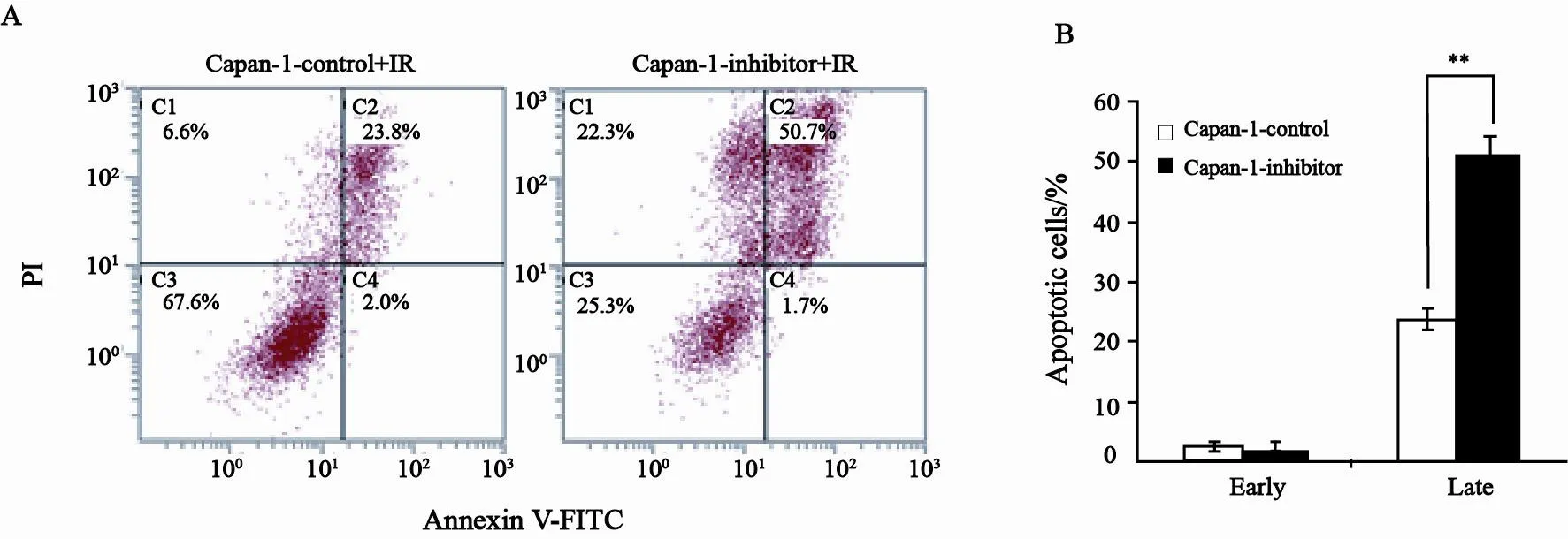
图 2 Aurora-A激酶抑制剂对Capan-1细胞放射线敏感性的影响Fig. 2 Influence of Aurora-A kinase inhibitor on radiosensitivity in Capan-1 cells.
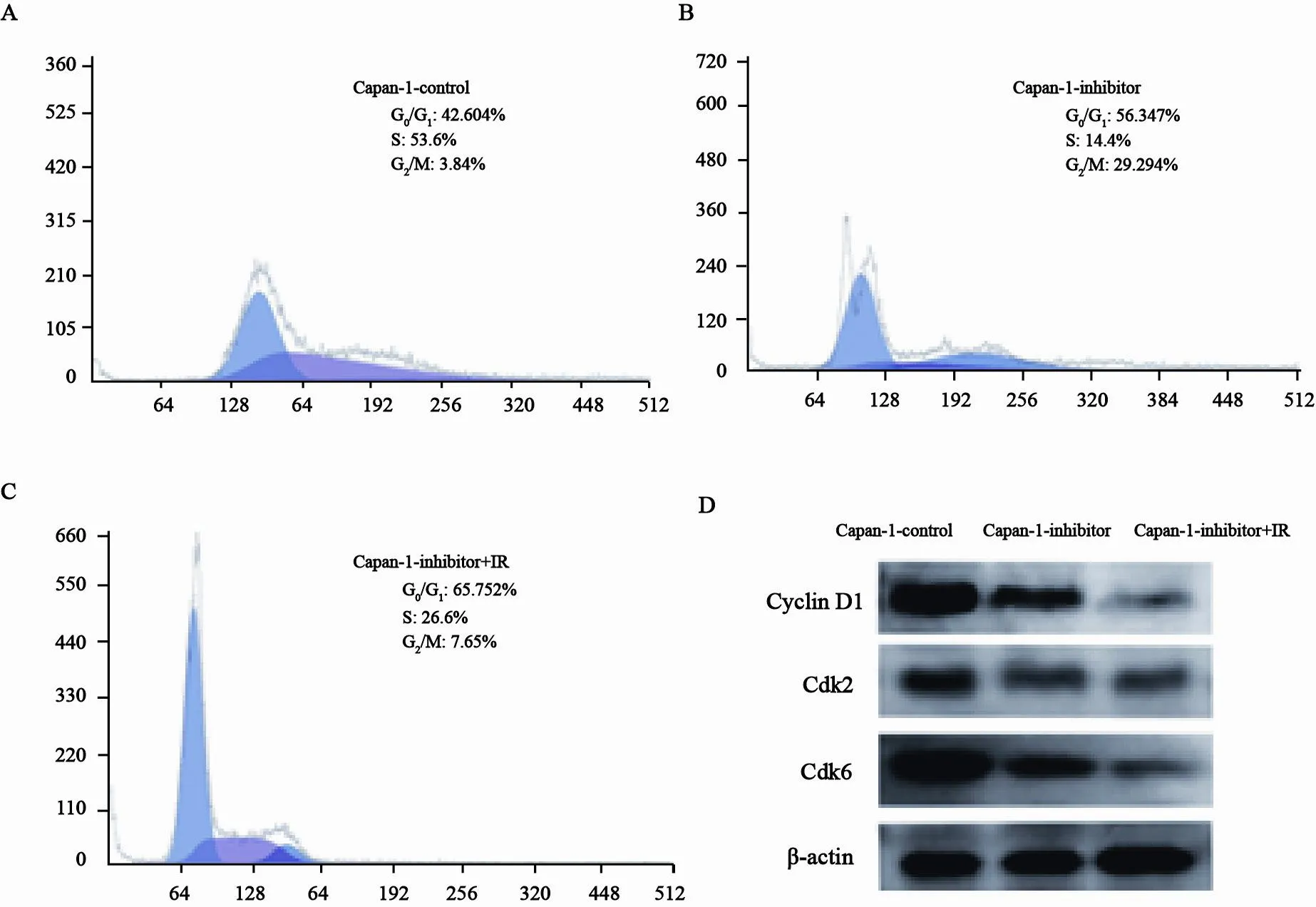
图3. Aurora-A激酶抑制剂促进胰腺癌细胞放射线敏感的机理研究Fig. 3 Mechanism of the enhanced radiosensitivity induced by Aurora-A kinase inhibitor in pancreatic cancer cells
3 讨 论
细胞周期有3个检验点,分别在G1/S期、G2/ M期和M期。大多数研究表明,Aurora-A主要在G2/M期被激活,进而调节细胞周期进展。本研究证明在胰腺癌细胞系Capan-1中,Aurora-A激酶抑制剂可同时抑制G1/S期和G2/M期转化,进而阻滞细胞周期进展,抑制剂加放射线处理后细胞G1/S期阻滞更加显著,但该阻滞由Aurora-A激酶抑制剂直接引起还是通过抑制周期蛋白Cyclin D1、CDK2和CDK6等引起尚待进一步研究。
细胞周期进展主要受细胞周期蛋白以及细胞周期蛋白依赖性激酶调节。Cyclin D1是细胞周期检查点G1/S期的重要调控因子,其可与CDK4/6结合形成复合物引起Rb蛋白的磷酸化[12],从而解除Rb对转录因子E2F的抑制效应[13],启动DNA的合成,使细胞由G1期过渡到S期。CDK2可与Cyclin A以及Cyclin B结合[14],促进细胞G2/M期转化,进而启动细胞有丝分裂,亦可与 Cyclin E结合调控细胞周期向G1/S期转换[15]。有报道称Aurora-A可通过调节Cyclin B1或磷酸化BRCA1和CDC25B而绕过G2/M检验点,促进细胞周期G2/M转换[10,16];磷酸化p53的Ser315位点,从而促进Mdm2介导的p53泛素化途径降解[17],影响细胞周期以及细胞凋亡。Aurora-A与细胞周期蛋白表达密切相关,其介导细胞周期进展的机制尚待进一步分析和研究。
综上所述,Aurora-A激酶抑制剂可通过影响细胞周期蛋白表达,抑制细胞周期进展,进而引起胰腺癌细胞的放射敏感性。此实验为胰腺癌的治疗提供了新靶点,有助于寻找胰腺癌综合治疗的新方法。
[参 考 文 献]
[1] BABA Y, NOSHO K, SHIMA K, et al. Aurora-A expression is independently associated with chromosomal instability in colorectal cancer [J] . Neoplasia, 2009, 11(5): 418-425.
[2] PAN J Y, AJANI J A, GU J, et al. Association of Aurora-A (STK15) kinase polymorphisms with clinical outcome of esophageal cancer treated with preoperative chemoradiation[J]. Cancer, 2012, 118(17): 4346-4353.
[3] XU H T, MA L, QI F J, et al. Expression of serine threonine kinase 15 is associated with poor differentiation in lung squamous cell carcinoma and adenocarcinoma[J]. Pathol Int, 2006, 56(7): 375-380.
[4] JEON H Y, LEE H. Depletion of Aurora-A in zebrafish causes growth retardation due to mitotic delay and p53-dependent cell death [J]. FEBS J, 2013, 280(6): 1518-1530.
[5] BEARSS D J. Shining the light on aurora-a kinase as a drug target in pancreatic cancer [J]. Mol Cancer Ther, 2011, 10(11): 2012.
[6] FERCHICHI I, SASSI HANNACHI S, BACCAR A, et al. Assessment of Aurora A kinase expression in breast cancer: a tool for early diagnosis? [J]. Dis Markers, 2013, 34(2): 63-69.
[7] NIKONOVA A S, ASTSATUROV I, SEREBRIISKII I G, et al. Aurora A kinase (AURKA) in normal and pathological cell division [J]. CMLS, 2013, 70(4): 661-687.
[8] PLOTNIKOVA O V, NIKONOVA A S, LOSKUTOV Y V, et al. Calmodulin activation of Aurora-A kinase (AURKA) is required during ciliary disassembly and in mitosis [J]. Mol Biol Cell, 2012, 23(14): 2658-2670.
[9] QIN L, TONG T, SONG Y, et al. Aurora-A interacts with Cyclin B1 and enhances its stability [J]. Cancer Lett, 2009, 275(1): 77-85.
[10] DODSON C A, BAYLISS R. Activation of Aurora-A kinase by protein partner binding and phosphorylation are independent and synergistic [J]. J Biol Chem, 2012, 287(2): 1150-1157.
[11] CHAKRABORTY S, BAINE M J, SASSON A R, et al. Current status of molecular markers for early detection of sporadic pancreatic cancer [J]. Biochem Biophys Acta, 2011, 1815(1): 44-64.
[12] DU Z, TONG X, YE X. Cyclin D1 promotes cell cycle progression through enhancing the kinase activity of NDR1/2 independent of cyclin dependent kinase 4[J]. J Biol Chem, 2013, 29.
[13] COE B P, TH K L, AVIEL-RONEN S, et al. Genomic deregulation of the E2F/Rb pathway leads to activation of the oncogene EZH2 in small cell lung cancer[J]. PloS One, 2013, 8(8): 71670.
[14] CERQUETTI L, SAMPAOLI C, AMENDOLA D, et al. Mitotane sensitizes adrenocortical cancer cells to ionizing radiations by involvement of the cyclin B1/CDK complex in G2arrest and mismatch repair enzymes modulation[J]. Int J Oncol, 2010, 37(2): 493-501.
[15] LIU Q, LIU X, GAO J, et al. Overexpression of DOC-1R inhibits cell cycle G1/S transition by repressing CDK2 expression and activation[J]. Int J Biol Sci, 2013, 9(6): 541-549.
[16] REBOUTIER D, TROADEC M B, CREMET J Y, et al. Nucleophosmin/B23 activates Aurora A at the centrosome through phosphorylation of serine 89[J]. J Cell Biol, 2012, 197(1): 19-26.
[17] HSUEH K W, FU S L, CHANG C B, et al. A novel Aurora-A-mediated phosphorylation of p53 inhibits its interaction with MDM2[J]. Biochim Biophys Acta, 2013, 1834(2): 508-515.
Mechanistic study of pancreatic cancer cell radioresistance conferred by Aurora-A
SUN Hui-zhen, YANG Gong (Cancer Research Laboratory, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
YANG Gong E-mail: yanggong@fudan.edu.cn
Background and purpose: Aurora-A is a member of serine/threonine kinase family. The abnormal expression of Aurora-A induces tumorigenesis and radioresistance. This study was aimed to investigate the association of Aurora-A with radioresistance. Methods: Capan-1 cells were treated with Aurora-A kinase inhibitor, and then used to test cell proliferation, anchorage independent assay, cell cycle, and cell cycle regulatory proteins. Treated cells were also used to detect cell apoptosis after γ-irradiation. Results: Cell growth and colony number in soft agar were decreased after treatment with Aurora-A inhibitor. Treatment of cells with Aurora-A inhibitor also down-regulated the expression of Cyclin D1, CDK2 and CDK6 to induce cell cycle arrest at G1/S and G2/M phases, but promoted cell apoptosis after γ-irradiation. Conclusion: Treatment of pancreatic cancer cells with Aurora-A kinase inhibitor blocks cell proliferation and cell cycle progression, and promotes sensitivity of cells to radiation. Thus, Aurora-A may be used as one of therapeutic targets to increase the sensitivity of pancreatic cancer radiotherapy.
Aurora-A; Pancreatic cancer; Radiosensitivity
10.3969/j.issn.1007-3969.2013.12.007
R735.9
A
1007-3639(2013)12-0974-06
2013-07-30
2013-10-07)
浦江人才计划基金(No:PJ[2011]0000652)。
杨恭 E-mail:yanggong@fudan.edu.cn

