趋化因子CCL28过表达对人乳腺癌细胞增殖的影响
复旦大学附属肿瘤医院乳腺癌研究所,复旦大学上海医学院肿瘤学系,上海 200032
趋化因子CCL28过表达对人乳腺癌细胞增殖的影响
林凤娟 杨小利 郭雅洁 邵志敏 欧周罗
复旦大学附属肿瘤医院乳腺癌研究所,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:CCL28,又称为黏膜相关上皮趋化因子(mucosa-associated epithelia chemokine,MEC),是趋化因子CC家族中的一员。研究表明,CCL28与肿瘤发生、发展有关,但对其在乳腺癌中的功能还知之甚少。本文旨在探讨CCL28过表达在体外对乳腺癌细胞MDA-MB-231增殖的影响。方法:构建CCL28过表达载体pBabe-CCL28表达质粒,将重组的pBabe-CCL28基因和空载体pBabe转染细胞Phoenix,利用逆转录病毒感染乳腺癌细胞MDA-MB-231,通过嘌呤霉素药物筛选获得稳定表达CCL28的MDA-MB-231/CCL28细胞系和感染空载体的MDA-MB-231/vector细胞系,利用半定量RT-PCR、实时荧光定量PCR及蛋白质印迹法(Western blot)检测CCL28的基因表达和蛋白质水平;利用CCK8、软琼脂克隆培养及流式细胞术检测CCL28过表达后细胞增殖、克隆形成能力及凋亡的变化;利用Western blot检测CCL28过表达后凋亡相关蛋白的变化。结果:成功建立了稳定表达CCL28的细胞系MDA-MB-231/CCL28,与空载体对照组相比,pBabe-CCL28质粒感染入细胞后CCL28基因表达水平明显增高,说明CCL28 cDNA重组质粒构建成功。CCK8及软琼脂克隆实验结果显示,MDA-MB-231/CCL28的增殖能力明显高于MDA-MB-231/vector,差异有统计学意义(P<0.05)。流式细胞术结果显示,MDA-MB-231/ CCL28细胞凋亡比例减少,差异有统计学意义(P<0.05)。Western blot结果显示,抗凋亡蛋白Bcl-2的表达增加。结论:CCL28过表达可以显著促进人乳腺癌细胞MDA-MB-231的增殖能力,抑制乳腺癌细胞凋亡,后者可能与Bcl-2上调有关。CCL28有望成为临床治疗乳腺癌的潜在基因靶点。
乳腺肿瘤;趋化因子;CCL28;基因表达;增殖
乳腺癌是女性最常见的恶性肿瘤[1-2],我国乳腺癌的发病率呈逐年上升趋势。近年来,趋化因子受体及其相应趋化因子配体已被证明在恶性肿瘤的发生、发展中发挥重要作用,涉及肿瘤的增殖、侵袭、血管形成及肿瘤组织中的免疫细胞[3]。
CCL28,又称为MEC(mucosa-associated epithelial chemokine),是最早由Wang等[4]于2000年从鼠的肾脏组织中分离克隆出来的,属于CC类趋化因子家族。CCL28相应的受体为CCR3和CCR10,CCL28能够调节表达有CCR3和CCR10受体细胞的趋化活性。目前对于CCL28的研究集中在其与炎性反应、免疫的关系,而对CCL28在乳腺癌中作用的研究还比较少。因此,本研究利用DNA重组技术上调CCL28的表达,观察CCL28对乳腺癌细胞增殖、克隆形成及凋亡的影响,并初步探讨其机理,从而为乳腺癌的治疗提供实验依据及理论基础。
1 材料和方法
1.1 实验材料
实验所用的人乳腺癌细胞株MDA-MB-231购自美国模式培养物集存库(American type culture collection,ATCC);所有细胞用ATCC推荐的培养基加10%胎牛血清培养,MDAMB-231用DMEM。传代时用0.25%的胰蛋白酶消化,按1∶3的比例传代。RNA提取试剂TRIzol购自于Invitrogen公司,RT-PCR反应试剂盒购自Fermentas公司,SYBR Green qPCR试剂盒购自Takara公司,Polybrene购自Sigma公司,CCL28 (18214-1-AP,1∶500) 抗体购自proteintech公司,Bcl-2 (sc-7382,1∶500) 抗体购自Santa cruz公司,β-actin (A5441,1∶20 000) 购自Sigma公司。
1.2 方法
1.2.1 RT-PCR法检测
采用TRIzol法抽提各细胞系的总RNA,Beckman公司DU800紫外分光光度仪对所得RNA进行定量分析。取3 μg的总RNA加入到25 μL的RT反应体系中,按照试剂盒说明进行逆转录反应。PCR反应体系如下:10×缓冲液25 μL,25 mmol/L MgCl21.5 μL,dNTP (10 mmol/L) 0.5 μL,基因上下游引物各0.5 μL,Taq DNA聚合酶25 U,RT反应产物1.5 μL,灭菌MQ水加至25 μL;PCR反应条件:95 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,共20个循环(GAPDH)和30个循环(CCL28),经预备实验确认处于指数扩增期;PCR产物用1.2%琼脂糖凝胶电泳鉴定,在紫外光凝胶成像分析系统下摄片,GAPDH引物序列为:上游5’-GGGAGCCAAAAGGGTCATCATCTC-3’,下游5’-CCATGCCAGTGAGCTTCCCGTTC-3’,扩增片段大小353 bp,CCL28引物序列为:上游5’-CCATACTTCCCATTGCCTCC-3’, 下游5’-TGCCCTGTTACTGTTCCTCTTG-3’,扩增片段大小为275 bp。
1.2.2 SYBR Green实时荧光定量PCR法检测
25 μL反应体系中包括上、下游引物各0.5 μL、2×Mix 12.5 μL(含反应缓冲液、dNTP、MgCl2、SYBR Green、Taq DNA polymerase)、灭菌MQ水11 μL、cDNA 1 μL。反应条件同上。GAPDH和CCL28的读靶温度为82 ℃,将监测临界点设在PCR扩增过程中,荧光信号由本底进入指数扩增阶段的拐点所对应的循环数(Ct)作为模板初始浓度的间接指标。在扩增效率达95%~105%时,使用2-ΔΔCt法(Ct代表循环阈值)计算相对定量比值。
1.2.3 蛋白质印迹法检测(Western blot)
细胞收集后加入RIPA裂解液(1×PBS,1%NP40,0.1% SDS,5 mmol/L EDTA,0.5%去氧胆酸钠,1 mmol/L原钒酸钠)常规方法提取细胞的总蛋白,BCA法测定蛋白浓度。取30 μg蛋白质,行10% SDS-PAGE电泳。电泳完毕后,4 ℃、90 V电转移2 h至PVDF膜上。PVDF膜用含5%脱脂奶粉的TBST室温封闭1 h后,加入一抗4 ℃温育过夜,洗膜后,加入二抗室温温育1.5 h,洗膜后,加入现配的增强型化学发光试剂(ECL)常规显像。以β-actin为内对照。
1.2.4 CCL28逆转录病毒表达载体的构建
CCL28带有SalI(GTCGAC)和BamHI(GGATCC)酶切位点的引物(384bp):上游5’-TATGGATCCATGCAGCAGAGAGGACTC GCCAT-3’;下游5’- CGCGTCGACCTAATAAG GAGTTTTATGGCCGTA-3’。以人乳腺癌细胞系T47D为模板得到PCR产物,反应产物为5’端带有SalⅠ位点,3’端带有BamHⅠ位点的目的基因片段。PCR反应条件同上。将PCR产物进行1%琼脂糖凝胶电泳,按Qiagen胶回收试剂盒操作回收片段。将PCR产物和pBabe逆转录病毒载体进行SalⅠ和BamHⅠ双酶切,T4连接酶进行连接反应。转化大肠杆菌,挑取阳性克隆扩增抽提质粒。对重组逆转录病毒载体pBabe-CCL28进行双酶切鉴定。将逆转录病毒载体pBabe和重组逆转录病毒载体pBabe-CCL28利用磷酸钙沉淀法共转染Phoenix细胞,加入Polybrene增加病毒包装的效果,转染后48 h收获含病毒的上清液,5 030×g,离心5 min,去除细胞沉淀,0.45 μm的滤膜过滤,将上清液分装,-80 ℃保存。
1.2.5 CCL28过表达细胞株的建立及鉴定
利用逆转录病毒感染乳腺癌细胞株MDAMB-231,感染48 h后加入含有puromycin的培养基进行药物筛选,获得抗性克隆,扩大培养,利用荧光定量PCR方法鉴定过表达效果,命名为MDA-MB-231/CCL28,空载体克隆命名为MDA-MB-231/vector。
1.2.6 CCK8法测细胞增殖
MDA-MB-231细胞使用含10% FBS的DMEM培养基;取2 500个/孔(100 μL/孔)的浓度将处于对数期的细胞接种到96孔板,每孔设3个对照;待细胞贴壁后,加入10 μL CCK8,温育2 h;用自动酶标仪在450 nm波长处,测定各孔的A值。连测7 d,最后取各样本的平均值进行比较。
1.2.7 软琼脂克隆形成实验
称取软琼脂粉末配制成1.4%及0.7%浓度的软琼脂,高压灭菌,放37 ℃温箱不凝固;按1∶1比例使1.4%软琼脂与2×DMEM混合,取4 mL注入6 cm培养皿中,冷却凝固;制备细胞悬液,用一般传代方法将对数生长期的单层培养细胞分散成单细胞悬液,计数;将细胞调至20 000个细胞,加入2×DMEM至500μL,与0.7%软琼脂500μL混合,铺入铺有凝胶的皿中,待凝固后放温箱培育10~14 d;倒置显微镜下计数。
1.2.8 流式细胞术检测细胞凋亡
按常规方法消化、离心(1 509×g)MDAMB-231/CCL28和MDA-MB-231/vector细胞,计数,将细胞调至2×105个,经Annexin-V、FITC染色后,利用流式细胞术检测细胞凋亡情况。
1.3 统计学处理
采用SPSS 17.0软件包进行统计学处理。计数资料采用χ2检验;计量资料采用非参数检验。P<0.05为差异有统计学意义。
2 结 果
2.1 建立稳定的CCL28过表达的乳腺癌细胞株
将设计好的CCL28引物片段在人的基因组数据库(www.ncbi.nlm.gov/BLAST/)进行比对,未发现与其他编码序列同源。随后将构建好的逆转录过表达载体进行测序分析,选取序列正确的载体进行下一步的实验。经包装细胞Phoenix包装的逆转录病毒,与培养基按比例稀释,并设立空白对照,用逆转录病毒感染MDAMB-231细胞,感染后48 h加入含嘌呤霉素的培养基进行药物筛选,14 d后建立抗性克隆,将克隆扩大培养,收集细胞进行感染效果的检测。半定量RT-PCR、荧光定量PCR和Western blot检测结果均显示,转入CCL28 cDNA的细胞(MDAMB-231/CCL28)较转入空载体(MDA-MB-231/ vector)中CCL28的表达明显上调(图1)。
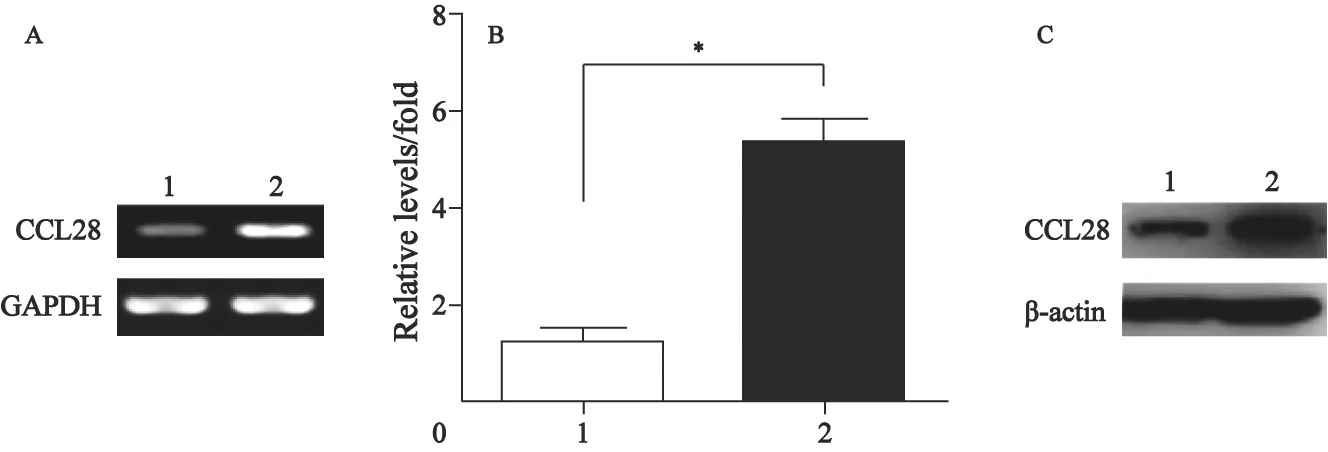
图1 半定量PCR、实时荧光定量PCR及Western blot检测转染后CCL28 mRNA表达和蛋白水平Fig.1 CCL28 mRNA expression and protein level in MDA-MB-231/CCL28 detected by semi-quantitative PCR (A), real-time PCR (B) and Western blot (C)
2.2 过表达CCL28促进乳腺癌细胞MDAMB-231增殖
为了研究CCL28对MDA-MB-231细胞增殖能力的影响,本研究采用CCK8法测定了细胞培养24、48、72、96、120、144和168 h后的吸光度值(A),以每日吸光度值均数绘制了各组细胞的生长曲线。结果表明,过表达CCL28的MDAMB-231/CCL28乳腺癌细胞组的增殖能力明显高于MDA-MB-231/vector组(P<0.05,图2)。
2.3 过表达CCL28促进乳腺癌细胞MDAMB-231克隆形成
软琼脂克隆形成实验结果表明,CCL28能够促进乳腺癌细胞MDA-MB-231在软琼脂中的克隆形成。显微镜下可见MDA-MB-231/CCL28形成的克隆比MDA-MB-231/vector中显著增多;3次重复实验的定量数据显示,其差异有统计学意义(P<0.05,图3A、B)。
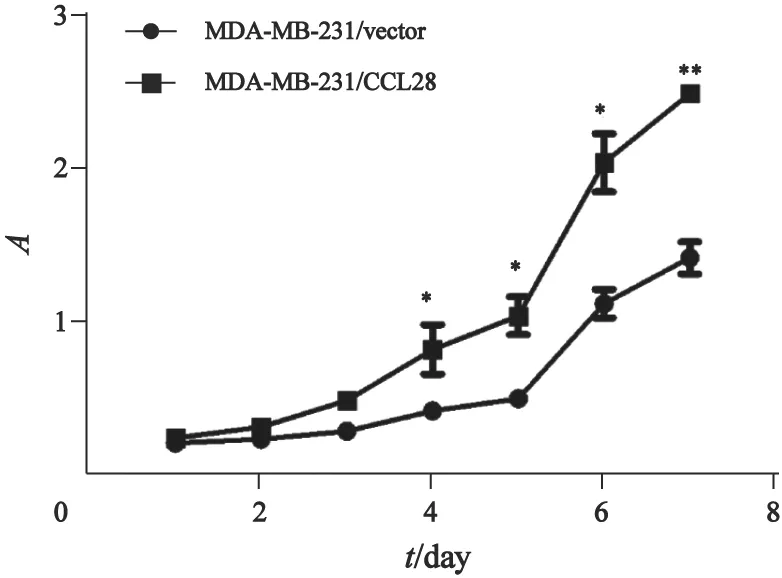
图2 CCK-8法检测转染后细胞的增殖能力Fig.2 The proliferative ability of MDA-MB-231 cells infected with different plasmids detected by CCK-8 method
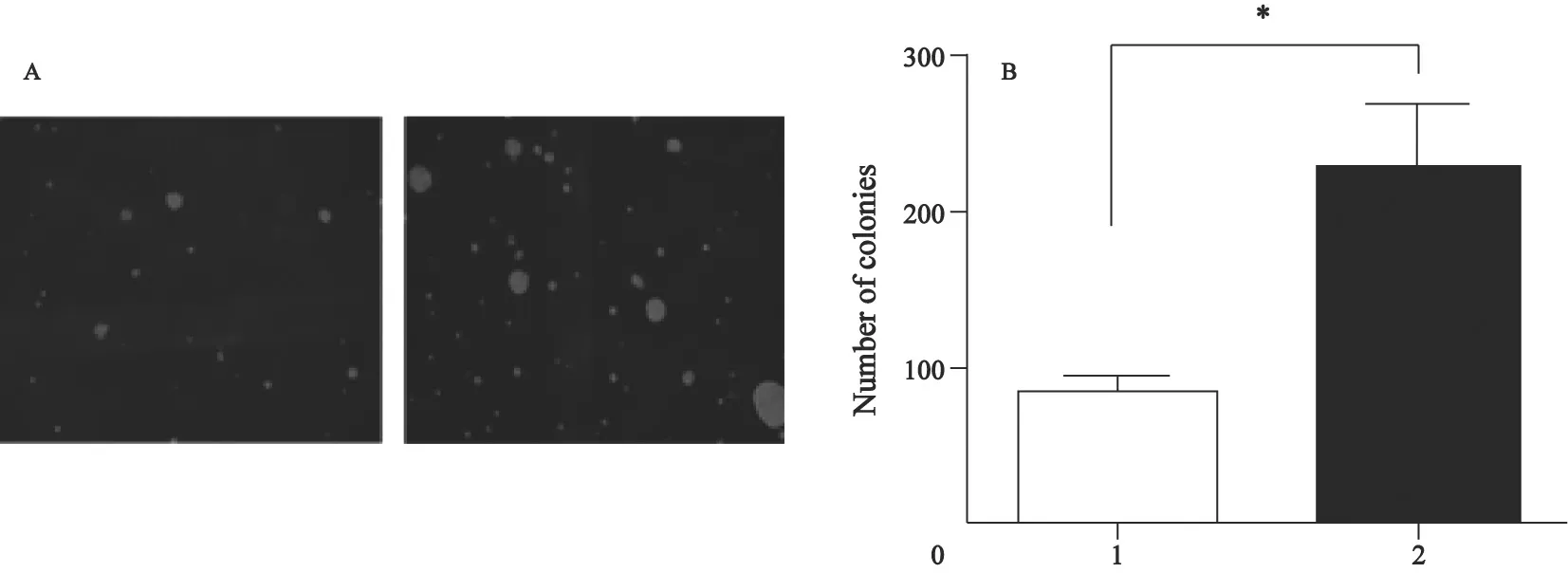
图3 软琼脂克隆形成实验检测转染后细胞克隆形成情况Fig.3 Anchorage-independent colony formation on soft agar in association with CCL28 protein expression
2.4 过表达CCL28抑制乳腺癌细胞MDAMB-231凋亡
为了分析CCL28对细胞凋亡的影响,本研究利用流式细胞术检测MDA-MB-231/CCL28和MDA-MB-231/vector细胞的凋亡情况。结果显示,与对照组细胞相比,过表达CCL28的MDAMB-231/CCL28细胞凋亡显著减少,差异有统计学意义(P<0.05,图4A)。
为了进一步分析CCL28与细胞凋亡的关系,本研究利用Western blot检测抗凋亡蛋白Bcl-2的变化,结果显示,MDA-MB-231/CCL28中抗凋亡蛋白Bcl-2的表达明显高于其对照组(图4B)。
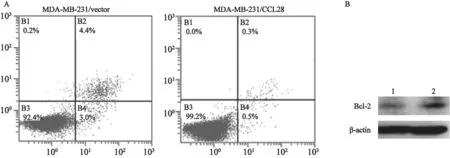
图4 过表达CCL28抑制细胞凋亡Fig.4 Over-expression of CCL28 inhibits breast cancer cells apoptosis.
3 讨 论
CCL28是CC族趋化因子家族中新的一员,可表达于不同的黏膜部位,包括唾液腺、乳腺、气管及结肠等[4-5]。有研究表明,在促炎因子的刺激下,CCL28在结肠上皮细胞中的表达上调,提示CCL28与炎性反应密切相关[6]。Eksteen等[7]的研究也证实了CCL28与炎性反应的关系,并发现炎性反应因子LPS或IL-1β能够促使CCL28分泌增多,从而使得表面表达CCR10受体的T细胞募集到黏膜炎性反应区域。Hieshima等[8]进一步阐述了CCL28在炎性反应中的作用,即具有广谱抗菌活性。目前,关于CCL28与肿瘤的关系研究较少。有研究表明,CCL28在人乳腺癌组织中的表达显著低于其邻近正常组织[9]。Dimberg等[10]检测了76例结直肠癌患者组织和血清CCL28蛋白的表达,发现结肠癌组织CCL28蛋白的表达比正常组织中显著降低(P<0.001),结肠癌患者血清中CCL28蛋白的表达远高于直肠癌患者。最新研究发现,缺氧可以使卵巢癌中CCL28的表达上调,进而募集表达有CCL28受体CCR3和(或)CCR10的Treg细胞到肿瘤部位,最终促进血管生成及免疫耐受,从而使得癌症进展[11]。
为了研究CCL28基因过表达对乳腺癌细胞增殖能力的影响,本研究在构建pBabe-CCL28表达载体后,利用逆转录病毒将CCL28基因整合到乳腺癌细胞MDA-MB-231中,经嘌呤霉素筛选后克隆出高表达CCL28基因的乳腺癌细胞,命名为MDA-MB-231/CCL28,用于CCL28基因功能的研究。采用CCK-8法检测细胞的生长能力时发现,CCL28过表达的MDA-MB-231/ CCL28组细胞生长能力较MDA-MB-231/vector空质粒对照组明显增强(P<0.05),提示CCL28在MDA-MB-231细胞的生长中起促进作用。软琼脂克隆形成实验是一种检测细胞克隆形成能力的方法,可以在一定程度上反映细胞在体内的成瘤能力。本研究发现CCL28过表达后细胞的克隆形成能力显著提高(P<0.05),提示其体内成瘤能力也提高。本研究利用流式细胞仪检测细胞凋亡,发现MDA-MB-231/CCL28组细胞凋亡较对照组明显减少,提示CCL28能够抑制MDA-MB-231细胞凋亡。Bcl-2基因是一种重要的凋亡调控基因,在多种肿瘤的发生、发展及细胞凋亡方面起重要的作用,其过度表达可抑制细胞的凋亡,延长细胞寿命,促进细胞生存[12]。本研究发现,乳腺癌细胞系MDAMB-231过表达CCL28后Bcl-2表达量上调,这可能是CCL28抑制细胞凋亡的重要机制之一,其详细机制有待进一步的研究。
综上所述,CCL28能够促进乳腺癌细胞增殖,并抑制乳腺癌细胞凋亡。CCL28抑制乳腺癌细胞凋亡的能力,有可能与上调抗凋亡蛋白Bcl-2的表达相关。虽然CCL28的功能、分子机制和信号转导通路尚待深入研究,但体外促癌作用提示CCL28有可能成为治疗乳腺癌的潜在靶分子。
[1] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1): 10-29.
[2] CHALASANI P, DOWNEY L, STOPECK A T. Caring for the breast cancer survivor: a guide for primary care physicians[J]. Am J Med, 2010, 123(6): 489-495.
[3] ROLLINS B J. Inflammatory chemokines in cancer growth and progression[J]. Eur J Cancer, 2006, 42(6): 760-767.
[4] WANG W, SOTO H, OLDHAM E R, et al. Identification of a novel chemokine (CCL28), which binds CCR10 (GPR2)[J]. J Biol Chem, 2000, 275(29): 22313-22323.
[5] PAN J, KUNKEL E J, GOSSLAR U, et al. A novel chemokine ligand for CCR10 and CCR3 expressed by epithelial cells in mucosal tissues[J]. J Immunol, 2000, 165(6): 2943-2949.
[6] OGAWA H, IIMURA M, ECKMANN L, et al. Regulated production of the chemokine CCL28 in human colon epithelium[J]. Am J Physiol Gastrointest Liver Physiol, 2004, 287(5): 1062-1069.
[7] EKSTEEN B, MILES A, CURBISHLEY S M, et al. Epithelial inflammation is associated with CCL28 production and the recruitment of regulatory T cells expressing CCR10[J]. J Immunol, 2006, 177(1): 593-603.
[8] HIESHIMA K, OHTANI H, SHIBANO M, et al. CCL28 has dual roles in mucosal immunity as a chemokine with broadspectrum antimicrobial activity[J]. J Immunol, 2003, 170(3): 1452-1461.
[9] MICKANIN C S, BHATIA U, LABOW M. Identification of a novel beta-chemokine, MEC, down-regulated in primary breast tumors[J]. Int J Oncol, 2001, 18(5): 939-944.
[10] DIMBERG J, HUGANDER A, WAGSATER D. Protein expression of the chemokine, CCL28, in human colorectal cancer[J]. Int J Oncol, 2006, 28(2): 315-319.
[11] FACCIABENE A, PENG X, HAGEMANN I S, et al. Tumour hypoxia promotes tolerance and angiogenesis via CCL28 and T(reg) cells[J]. Nature, 2011, 475(7355): 226-230.
[12] KANG M H, REYNOLDS C P. Bcl-2 inhibitors: targeting mitochondrial apoptotic pathways in cancer therapy[J]. Clin Cancer Res, 2009, 15(4): 1126-1132.
《抗癌》杂志2013年征订启事
《抗癌》杂志于1988年创刊,主管单位为上海市科学技术协会,主办单位为上海市抗癌协会。《抗癌》杂志是供癌症患者及其家属阅读的公益性科普期刊,树立了为科研服务的思想意识,坚持以读者为导向,架起读者和医院之间的桥梁。杂志刊号:CN31-1664/R ISSN 1008-3065。欢迎广大读者订阅。
杂志为季刊,每期48页。本刊季末出版,每期5元,全年共20元整。征订方式请通过邮局汇款。
通讯地址:上海市东安路270号6号楼3楼《抗癌》杂志社收。
邮 编:200032
电 话:021-64043766
传 真:021-64043766
电子邮件:anti-cancer@163.com
Over-expression of chemokine CCL28 promotes the proliferation ability of human breast cancer cells
LIN Feng-juan, YANG Xiao-li, GUO Ya-jie, SHAO Zhi-min, OU Zhou-luo (Breast Cancer Institute, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
OU Zhou-luo E-mail: ouzhouluo@yahoo.com.cn
Background and purpose: CCL28, also known as mucosa-associated epithelial chemokine (MEC), is a member of the CC subfamily. Studies have shown that CCL28 is associated with tumor progress. However, little is known about its function in breast cancer. In this study, we construct the expression vector of cDNA encoding CCL28 gene and observe its effects on cell growth ability of human breast cancer cell line MDA-MB-231 in vitro. Methods: The pBabe-CCL28 expression vector was constructed, then transfected into Phoenix cells and used to infect cultured breast cancer cells MDA-MB-231 by using retroviruses infection method. The positive clones were selected with puromycin to establish stable transfectants MDA-MB-231/CCL28. Control cell lines were generated by infection with viruses containing empty vector by following the same protocol. CCL28 mRNA and protein in MDA-MB-231/ CCL28 were determined by semi-quantitative RT-PCR, realtime PCR and western blot respectively. Cell proliferation was tested by cell counting kit 8 (CCK8). Cell apoptosis percentage was observed by flow cytometry. The ability of colony formation was tested by soft agar. The expression of apoptosis associated protein was measured by Western blot. Results: The cell line MDA-MB-231/CCL28 stabling expresses chemokine CCL28 was successfully constructed. In the MDA-MB-231/CCL28 cells, cell proliferation was increased, and cell apoptosis percentage was decreased. Westernblot showed that the expression of anti-apoptotic protein Bcl-2 was decreased. Conclusion: Our data provides strong evidence that overexpression of CCL28 can promote the proliferative ability of MDA-MB-231 and inhibit the cell apoptosis, which may be regulated by Bcl-2. Therefore, CCL28 could be a important target for the treatment of breast cancer.
Breast cancer; Chemokine; CCL28; Gene expression; Proliferation
10.3969/j.issn.1007-3969.2013.03.001
R737.9
:A
:1007-3639(2013)03-0161-06
2012-12-30
2013-02-20)
国家自然科学基金资助项目(No:30570695,81172506);上海市乳腺肿瘤重点实验室资助项目(No:12DZ2260100)。
欧周罗 E-mail:ouzhouluo@yahoo.com.cn

