ETS2在乳腺癌细胞中调控CXCR4转录的机制研究
复旦大学医学院附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海200032
ETS2在乳腺癌细胞中调控CXCR4转录的机制研究
顾婷婷 谷圣美 金伟 吴炅
复旦大学医学院附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:肿瘤转移是乳腺癌患者死亡的主要原因。趋化因子受体CXCR4与乳腺癌转移密切相关。本研究探讨转录因子ETS2(人红血细胞增多症病毒致癌基因同源体2)对人乳腺癌细胞中趋化因子受体CXCR4表达的影响,以及ETS2调控CXCR4转录的分子机制。方法:在MCF-7和MDA-MB-231人乳腺癌细胞株中,本研究通过瞬时转染技术,以及RNAi技术,检测过表达ETS2或抑制ETS2的表达。然后分别应用RT-PCR以及ELISA检测CXCR4 mRNA的表达和蛋白水平,荧光酶素报告基因实验检测启动子活性,ChIP实验检测结合到CXCR4启动子上的ETS2的量。并且对CXCR4启动子上的2个ETS结合位点进行突变,通过荧光报告基因实验,检测突变对CXCR4启动子活性的影响。结果:转染了ETS2过表达质粒的MDA-MB-231和MCF-7人乳腺癌细胞中,CXCR4的表达在mRNA和蛋白水平都升高;报告基因实验结果提示,ETS2通过激活CXCR4启动子的活性提高CXCR4的表达;通过ChIP实验发现,在转染了ETS2表达质粒的MDA-MB-231和MCF-7人乳腺癌细胞中,结合到CXCR4启动子上的ETS2的蛋白量増高,提示ETS2通过直接结合到CXCR4启动子上,从而提高CXCR4启动子的活性;利用RNA干扰技术,抑制ETS2的表达,可以显著减弱CXCR4启动子的活性,降低CXCR4的表达和结合到CXCR4启动子上的ETS2的量;荧光酶素报告基因的结果显示,任意一个位点的突变都降低了CXCR4启动子的活性,2个位点的同时突变使CXCR4启动子的活性进一步降低。结论:在人乳腺癌细胞株MCF-7和MDA-MB-231细胞中,ETS2通过直接结合到CXCR4启动子上的2个结合位点(-540到-535和-240到-235),活化CXCR4启动子活性,从而对CXCR4发挥转录调控的作用。
乳腺癌;ETS2;转录;CXCR4;启动子
乳腺癌是女性最常见的恶性肿瘤之一,肿瘤转移与死亡率密切相关。临床研究证实,趋化因子受体CXCR4表达水平与乳腺癌腋窝淋巴结及远处转移存在显著相关[1-2]。近几年发现,一些ETS转录因子可以影响CXCR4的转录,例如ETS1、PEA3,通过结合到CXCR4启动子上,发挥上调其转录活性的作用[3-5];ETS蛋白通过识别位于下游靶基因的启动子或增强子区域的EBS结构域(ETS binding site,EBS)而调控靶基因的表达和功能[6]。
本研究利用瞬时转染技术和RNAi技术过表达ETS2或抑制ETS2的表达后,探讨 ETS2对CXCR4转录水平及蛋白水平的影响,并进一步研究ETS2是否可结合在CXCR4启动子序列上,参与对CXCR4转录的调节。
1 材料和方法
1.1 材料
MDA-MB-231和MCF-7人乳腺癌细胞株由复旦大学肿瘤医院中心实验室培养传代,ETS2表达质粒(pCMV6-XL5-ETS2)及空白对照质粒(pCMV6-XL5)购自Origene公司,CXCR4野生型启动子报告基因载体pGL2-CXCR4(-2632~+86),CXCR4突变型启动子报告基因载体pGL2-CXCR4mut,均由复旦大学附属肿瘤医院中心实验室构建,LipofectamineTM2000,Opti-MEM培养基购自美国Gibco公司,总RNA抽提试剂及RT-PCR试剂盒购自Ivitrogen公司,引物由上海Sangon公司合成,CXCR4抗体购自ABCAM公司,ELISA试剂盒购自CUSABIO BIOTECH公司,ETS2抗体购自美国Santa Cruz Biotechnology公司,ChIP试剂盒购自美国Millipore公司,ETS2 siRNA购自上海吉玛生物公司,报告基因实验试剂盒购自Promega公司。
1.2 细胞培养和瞬时转染
人乳腺癌细胞株MDA-MB-231用L15培养、MCF-7用RPMll640培养,所有培养基添加10% FBS。置于37 ℃,CO2体积分数为5%的培养箱中培养。取对数生长期的细胞用0.25%的胰蛋白酶消化,按1∶3的比例传代。转染前1 d,以5×105/孔的密度将细胞接种于6孔培养板中,次日细胞长满瓶底约80%时,用OPTI-MEM培养基稀释的质粒/LipofectamineTM2000复合物(4 μg/10 μL)加入细胞中继续培养,6 h后弃去转染液,换新鲜培养基。实验细胞分为以下3组:未转染组、转染空质粒组和转染ETS过表达质粒组。
1.3 RT-PCR检测CXCR4 mRNA含量
转染后48 h收集各组细胞。采用TRIzol法提取细胞总RNA(按TRIzol抽提试剂说明书进行),采用RNA反转录试剂盒将RNA反转录合成cDNA,以cDNA为模板,进行PCR反应。CXCR4引物序列为:上游引物:5’-CAGCAGGTAGCAAAGTGA -3’;下游引物:5’-AGCGTGATGAC AAAGAGG-3’,扩增产物为389 bp。ETS2引物序列为:上游引物:5’-GTGGACCTATTCAGCTGTGG-3’;下游引物:5’-TTCCCCGACGTCTTGTG GAT-3’,扩增产物为389bp。GAPDH引物序列:上游引物:5’-GGGAGCCAAAAG GGTCATCATCTC-3’;下游引物:5’-CCATGCCAGTGAGCTTCCCGTTC-3’,扩增产物353 bp。PCR反应条件:94 ℃预变性3 min,然后94 ℃ 1 min、58 ℃ 1 min,72 ℃1.5 min,72 ℃延伸10 min,指数扩增期33个循环。PCR产物4 ℃保存。取10 μL PCR反应产物在TBE缓冲液中1.2%的琼脂糖凝胶电泳40 min,电压130 V,结果通过凝胶成像系统进行分析。实验重复2次。
1.4 酶联免疫吸附实验(ELISA)
转染后48 h,ELISA法检测培养液上清CXCR4蛋白水平,按照试剂盒说明书操作。实验重复3次,数据结果取平均值进行计算。
1.5 荧光报告基因实验
细胞处理同上,采用LipofectamineTM2000分别共转染pGL2-Basic(阴性对照),pGL2-CXCR4,pGL2-CXCR4mut,ETS2质粒或空质粒。每种质粒用量均为5 μg/孔。同时分别共转染pRL-TK 20 ng/孔作为内参。在荧光素酶检测仪器上进行检测,读取595 nm下的吸光度(A)值以得到相对荧光蛋白浓度。实验重复3次,数据结果取平均值进行计算。
1.6 免疫共沉淀
转染细胞48 h后,按说明书步骤操作,细胞在15 cm平板中培养后,加入1%甲醛,37 ℃温育10 min。PBS清洗细胞2次后收集并用TNT裂解液(20 mmol/L Tris-HCl,pH=7.4,200 mmol/L NaCl,1%TritonX-100,1 mmol/L PMSF和1% aprotinin)冰浴处理。采用超声剪切细胞DNA,使DNA剪切成200~500 bp片断,并采用2 μg ETS2抗体免疫共沉淀。通过Protein A磁珠收集抗体/蛋白复合物,并使用ChIP缓冲液(5%SDS,l mmol/L EDTA,0.5%牛血清白蛋白和40 mmol/L NaHPO4,pH=7.2)清洗3次。使用1%SDS和1 mmol/L NaHCO3洗涤免疫复合物,加入200 mmol/L NaCl及RNaseA,在65 ℃温育4 h,解交联。采用蛋白酶K处理样品2 h,柱纯化提取DNA。采用PCR扩增检测CXCR4启动子DNA。引物包括CXCR4启动子-401到-142序列(顺义链:5’-CAGCAAGTCACTCCC-3’,反义链:5’-GGAGAGGTGCGCGGC-3’)。样品分为3组:IgG组(阴性对照)、Input组(阳性对照)和ETS2组。
1.7 RNA干扰实验
转染前1 d,以5×105/孔的密度将细胞接种于6孔培养板中,次日细胞长满瓶底约40%~70%时,分别转染ETS2特异的siRNA和NT-siRNA(100 pmol siRNA/5 μL LipofectamineTM2000),转染后48 h检测基因沉默效果。
1.8 统计学处理
数据均由SPSS Software 13.0统计软件分析:ELISA检测到的CXCR4蛋白水平,以及荧光启动子报告基因实验中所得到的结果,采用student t检验分析;P<0.05为差异有统计学意义。
2 结 果
2.1 过表达ETS2对CXCR4表达及CXCR4启动子活性的影响
RT-PCR与ELISA结果显示,过表达ETS2后,与对照组相比,MDA-MB-231和MCF-7人乳腺癌细胞中CXCR4的mRNA表达和蛋白水平显著升高(ELISA结果,P<0.05,图1)。荧光报告基因实验结果显示,过表达ETS2后,与对照组相比,CXCR4启动子活性显著增强(P<0.05,图2)。ChIP实验结果显示,过表达ETS2后,结合到CXCR4启动子上的ETS2的量显著增加(图3)。
2.2 抑制ETS2表达对CXCR4表达及CXCR4启动子活性的影响
RT-PCR与ELISA结果显示,抑制ETS2表达后,与对照组相比,MDA-MB-231和MCF-7人乳腺癌细胞中CXCR4的mRNA表达和蛋白水平显著降低(ELISA结果,P<0.05,图4)。荧光报告基因实验结果显示,抑制ETS2表达后,与对照组相比,CXCR4启动子活性显著下降(P<0.05,图5)。ChIP实验结果显示,抑制ETS2表达后,结合到CXCR4启动子上的ETS2的量显著减少(图6)。
2.3 突变两个ETS2结合位点对CXCR4启动子活性的影响
荧光报告基因实验结果显示,与野生型CXCR4启动子相比,ETS2结合位点中任意一个位点的突变都显著降低了CXCR4启动子的活性,两个位点(-540到-535和-240到-235)的同时突变则导致了CXCR4启动子活性的进一步降低(图7)。

图 1 转染ETS2过表达质粒48 h 后CXCR4的mRNA表达情况Fig. 1 The CXCR4 mRNA expression and protein level of MDA-MB-231 cells and MCF-7 cells after 48h of transfection

图 2 转染ETS2过表达质粒48 h后CXCR4的启动子活性Fig. 2 The CXCR4 promoter activity of MDA-MB-231 cells and MCF-7 cells after 48 h of transfection

图 3 转染ETS2过表达质粒48 h后结合到CXCR4的启动子上的ETS2蛋白情况Fig. 3 The amount of ETS2 protein binding to CXCR4 promoter in MDA-MB-231 cells and MCF-7 cells after 48 h of transfection
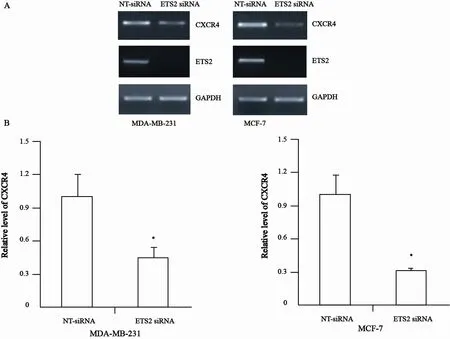
图 4 转染ETS2 siRNA 48 h 后CXCR4的mRNA表达情况Fig. 4 The CXCR4 mRNA expression and protein level of MDA-MB-231 cells and MCF-7 cells after 48 h of ETS2 siRNA transfection

图 5 转染ETS2 siRNA 48 h 后CXCR4的启动子活性Fig. 5 The CXCR4 promoter activity of MDA-MB-231 cells and MCF-7 cells after 48 h of ETS2 siRNA transfection
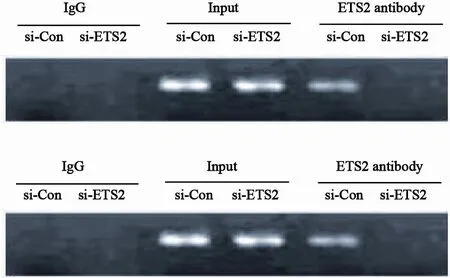
图 6 转染ETS2 siRNA 48 h后,结合到CXCR4的启动子上的ETS2蛋白情况Fig. 6 The amount of ETS2 protein binding to CXCR4 promoter in MDA-MB-231 cells and MCF-7 cells after 48 h of ETS2 siRNA transfection

图 7 CXCR4启动子上的两个ETS2结合位点的突变对CXCR4启动子活性的影响Fig. 7 The impact on CXCR4 promoter activity of the mutation of two ETS2 binding sites on CXCR4 promoter
3 讨 论
近年来,肿瘤生物研究方面的结果证实,CXCR4在乳腺癌以及其他肿瘤中具有重要的作用,特别是疾病的转移扩散[7-9]。
Dewan等[1]将CXCR4低表达的MCF-7细胞接种到SCID鼠,8~9周后仅在接种部位形成较小肿瘤病灶,而未发生远处器官转移。但是接种了CXCR4高表达的MDA-MB-231细胞后,3周内即可形成较大的肿瘤病灶,并发生明显远处及内脏转移。
在乳腺癌骨转移的研究中,发现与没有发生骨转移的患者相比,乳腺癌骨转移患者的乳腺癌组织中,CXCR4的表达显著升高,提示CXCR4在乳腺癌骨转移中起重要作用[10]。
2012年,Jin等[11]报道,抑制CXCR4表达后,乳腺癌细胞对内皮细胞层的黏附和侵袭都显著下降。2013年,Ling等[12]研究发现,CXCR4的拮抗剂AMD3465能够作用在构成肿瘤微环境的肿瘤细胞和免疫细胞上,调控肿瘤信号,包括STAT3途径,预防乳腺癌的进一步生长及转移,提示CXCR4是乳腺癌治疗的新靶点。Yang等[13]报道,初始化疗后,CXCR4的表达显著下降,这种改变提示CXCR4可能是一个评估乳腺癌新辅助化疗的疗效的标志物。2013年,一篇关于CXCR4对乳腺癌预后影响的META分析中,发现CXCR4的高表达,特别是在细胞质中,可能是乳腺癌患者不良预后的一个指标[14]。
CXCR4的转录调控是多方面的,例如ETS1、PEA3和HIF-1α都可以通过结合到CXCR4启动子上,发挥上调其转录活性的作用[3-5];相反,KLF-2则通过结合到CXCR4启动子上,下调其转录活性[15]。其中,ETS1和PEA3都属于细胞内最大的信号依赖转录调控因子家族-ETS家族(E26 transformation specific)之一。ETS基因具有一个高度保守的同源序列,称为ETS结构域。磁共振分析显示,ETS域是一个由85个氨基酸组成的特异的DNA结合区,呈翼状螺旋-转角-螺旋结构, 可以识别、结合嘌呤丰富的DNA核心序列GGAA/T,即EBS结构域(ETS Binding site,EBS)[6]。ETS蛋白通过识别位于下游靶基因的启动子或增强子区域的EBS而调控靶基因的表达和功能。它存在于与细胞外基质降解及血管生成有关的许多基因(如integrin α4,stromely-sin-1,u-PA,collagenase等)的5’侧翼调节区, 所以ETS家族和肿瘤的发生、发展密切相关[6]。
实验结果显示,过表达ETS2通过直接结合到CXCR4启动子上的两个ETS蛋白结合位点,增强CXCR4启动子的活性,上调CXCR4的表达。如前所述,CXCR4在乳腺癌的侵袭和转移中有着重要的作用。因此,ETS2对CXCR4的调控可能引起乳腺癌细胞侵袭转移力的改变。
与此同时,抑制ETS2表达减弱了CXCR4启动子的活性,下调CXCR4的表达。由此推断,如果阻断这一肿瘤细胞内的调控环节,可能为抑制乳腺癌细胞转移提供新的思路。
本研究采用的两种细胞,MCF-7是ER阳性乳腺癌细胞,MDA-MB-231细胞是三阴性乳腺癌细胞。CXCR4的转录在MDA-MB-231细胞和MCF-7细胞中都可以被激活,提示了这个过程是激素非依赖性的。
在探讨ETS蛋白成员PEA3调控CXCR4转录的研究中,发现过表达PEA3能够促进裸小鼠乳腺癌模型的肺转移瘤生长[5]。本研究如进行后续实验,可进一步探讨ETS2是否具有促进乳腺癌转移的作用。
综上所述,过表达ETS2具有上调CXCR4基因转录的作用,其具体作用机制是ETS2通过结合到CXCR4启动子上的2个ETS2结合位点,激活CXCR4启动子的活性,从而激活CXCR4的转录,促进CXCR4的表达。研究结果提示ETS2可能是一个潜在的乳腺癌转移分子标志物,有望成为乳腺癌诊断与治疗过程中新的分子靶点。
[1] DEWAN M Z, AHMED S, IWASAKI Y, et al. Stromal cellderived factor-1 and CXCR4 receptor interaction in tumor[J]. Biomed Pharmacother, 2006, 60(6): 273-276.
[2] YASUOKA H, TSUJIMOTO M, YOSHIDOME K, et al. Cytoplasmic CXCR4 expression in breast cancer: induction by nitric oxide and correlation with lymph node metastasis and poor prognosis[J]. BMC Cancer, 2008, 8: 340.
[3] MARONI P, BENDINELLI P, MATTEUCCI E, et al. HGF induces CXCR4 and CXCL12-mediated tumor invasion through Ets1 and NF-kappaB[J]. Carcinogenesis, 2007, 28(2):267-279.
[4] SCHIOPPA T, URANCHIMEG B, SACCANI A, et al. Regulation of chemokine receptor CXCR4 by hypoxia[J]. J Exp Med, 2003, 198: 1391-1402.
[5] GU S M, CHEN L, HONG Q, et al. PEA3 activates CXCR4 transcription in MDA-MB-231 and MCF7 breast cancer cells[J].Acta Biochim Biophys Sin, 2011, 43: 771-778.
[6] ITO Y, MIYOSHI E, TAKEDA T, et al. Expression and possible role of ets-1 in hepatocellular carcinoma[J]. Am J Clin Pathol, 2000, 114(5): 719-725.
[7] KOSHIBA T, HOSOTANI R, MIYAMOTO Y, et al. Expression of stromal cell-derived factor 1 and CXCR4 ligand receptor system in pancreatic cancer: a possible role for tumorprogression[J]. Clin Cancer Res, 2000, 6: 3530-3535.
[8] SCOTTON C J, WILSON J L, SCOTT K, et al. Multiple actions of the chemokine CXCL12 on epithelial tumor cells in human ovarian cancer[J].Cancer Res, 2002,62: 5930-5938.
[9] BALKWILL F. The significance of cancer cell expression of the chemokine receptor CXCR4[J].Semin Cancer Biol, 2004, 14: 171-179.
[10] ZHANG H W, SUN X F, HE Y N,et al. Bioinformatics analysis of breast cancer bone metastasis related gene-CXCR4[J]. Asian Pac J Trop Med, 2013, 6(9): 732-738.
[11] JIN F , BROCKMEIER U, OTTERBACH F, et al. New insight into the SDF-1/CXCR4 axis in a breast carcinoma model: hypoxia-induced endothelial SDF-1 and tumor cell CXCR4 are required for tumor cell intravasation[J]. Mol Cancer Res, 2012, 10: 1021-1031.
[12] LING X Y, SPAETH E, CHEN Y, et al. The CXCR4 antagonist AMD3465 regulates oncogenic signaling and invasiveness in vitro and prevents breast cancer growth and metastasis in vivo[J]. PLoS ONE, 2013, 8(3): 58426.
[13] YANG S X, LOO W T, CHOW L W,et al. Decreased expression of C-erbB-2 and CXCR4 in breast cancer after primary chemotherapy[J]. J Transl Med, 2012, 19(10): 3.
[14] XU T P, SHEN H, LIU L X, et al. The impact of chemokine receptor CXCR4 on breast cancer prognosis: a meta-analysis[J]. Cancer Epidemiol, 2013, 37(5):725-31.
[15] UCHIDA D, ONOUE T, BEGUM N M, et al. Vesnrinone downregulates CXCR4 expression via upregulation of Krüppel-like factor 2 in oral cancer cell[J]. Mol Cancer 2009, 8: 62.
《中国癌症杂志》2013年征订启事
《中国癌症杂志》是由国家教育部主管、复旦大学附属肿瘤医院主办的全国性肿瘤学术期刊,读者对象为从事肿瘤基础、临床防治研究的中高级工作者。主要报道内容:国内外研究前沿的快速报道、专家述评、肿瘤临床研究、基础研究、文献综述、学术讨论、临床病理讨论、病例报道、讲座和简讯等。《中国癌症杂志》已入选中文核心期刊、中国科技核心期刊及全国肿瘤类核心期刊,并为中国科技论文统计源期刊,先后被“中国期刊网”、“万方数据——数字化期刊群”和“解放军医学图书馆数据库(CMCC)”等收录。
《中国癌症杂志》为月刊,大16开,80页铜版纸(随文彩图),每月30日出版,单价8元,全年96元。国际标准刊号1007-3639,国内统一标准刊号CN31-1727/R,邮发代号4-575。
读者可在当地邮局订阅,漏订者可直接向本刊编辑部订阅。
也欢迎广大作者来稿。
主 编:沈镇宙
主 任:秦 娟
联系地址:上海市东安路270号复旦大学附属肿瘤医院内《中国癌症杂志》编辑部
邮 编:200032
电 话:021-64188274;021-64175590×3574
网 址:www.china-oncology.com
电子邮件:zgaz@163.com
Mechanism of ETS2 modulating transcriptional activity of the CXCR4 gene in breast cancer cells
GU Ting-ting, GU Sheng-mei, JIN Wei, WU Jiong (Department of Breast Surgery, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
WU Jiong E-mail: Wujiong1122@sina.vip.com
Background and purpose: Tumor metastasis is a main reason of breast cancer patients’ death. This study aimed to discuss whether or how the transcription factor ETS2 regulate CXCR4 transcription and the molecular mechanism of ETS2 modulating transcriptional activity of CXCR4 gene in human breast cancer cells. Methods: In MCF-7 breast cancer cell lines and MDA-MB-231 breast cancer cell lines, through transient transfection, as well as RNAi technology, the expression of ETS2 was overexpressed or inhibited was detected. RT-PCR and ELISA was used respectively to detect CXCR4 mRNA expression and protein level. Luciferase reporter gene assay was applied to detect CXCR4 promoter activity, and ChIP for detecting the amount of ETS2 protein binding to CXCR4 promoter. Two binding sites of CXCR4 promoter were mutated to detect the impact on the activity of CXCR4 promoter by gene mutations. Results: After transfected with ETS2 expression vector in MCF-7 and MDA-MB-231 breast cancer cell lines, the mRNA expression and protein level of CXCR4 were elevated. The result of luciferase reporter gene assay indicated that overexpression of ETS2 activated CXCR4 promoter. ChIP assay demonstrated that the amount of ETS2 protein binding to CXCR4 promoter increased after ETS2 transfection. This result indicated that ETS2 mayactivate CXCR4 promoter through directly binding with CXCR4 promoter. Inhibition of ETS2 expression using RNAi could significantly attenuate CXCR4 promoter activity and reduce expression of CXCR4. Two ETS binding sites of CXCR4 promoter were mutated and the result of luciferase reporter gene assay proved that, an arbitrary point mutations attenuated CXCR4 promoter activity, while mutation of both binding sites further attenuated CXCR4 activity. Conclusion: In MCF-7 and MDA-MB-231 breast cancer cell lines, overexpression of ETS2 could activate CXCR4 promoter and the transcription of CXCR4 through directly binding to two ETS2 binding sites (-540 to -535 and -240 to -235) of CXCR4 promoter.
Breast cancer; ETS2; Transcription; CXCR4; Promoter
10.3969/j.issn.1007-3969.2013.11.007
R737.9
:A
:1007-3639(2013)11-0892-08
2013-04-25
2013-10-15)
吴炅 E-mail:Wujiong1122@sina.vip.com

