MAPK信号激活抑制三阴性乳腺癌细胞的迁移和侵袭
徐晗狄根红杨恭
1.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海200032;
2.复旦大学附属肿瘤医院肿瘤研究所,复旦大学上海医学院肿瘤学系,上海200032
MAPK信号激活抑制三阴性乳腺癌细胞的迁移和侵袭
徐晗1,2狄根红1杨恭2
1.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海200032;
2.复旦大学附属肿瘤医院肿瘤研究所,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:三阴性乳腺癌具有高复发和转移风险,除了化疗,临床上无特定的靶向治疗。因此,研究三阴性乳腺癌复发转移机制对提高患者生存率具有重要意义,本研究旨在探讨丝裂原激活的蛋白激酶(MAPK)信号激活对三阴性乳腺癌细胞迁移和侵袭的影响。方法:首先用细胞划痕和细胞小室(Transwell)试验分析和比较肺高转移三阴性乳腺癌细胞系231-HM及其父代肺低转移细胞系231-p的体外迁移和侵袭性差异;然后用蛋白质印迹法(Western blot)检测转移相关蛋白和MAPK分子激活状态;最后用MAPK抑制剂处理231-p细胞,测定MAPK抑制情况下的细胞迁移、侵袭和相关蛋白变化。结果:与231-p细胞相比,231-HM细胞迁移和侵袭性明显增强;Western blot检测发现,231-HM细胞中促细胞迁移和侵袭蛋白Caveolin-1和β-catenin升高,MAPK通路相关蛋白P38、Erk1/2和MEK的磷酸化水平明显降低;用P38/MAPK磷酸化抑制剂(SB202190)处理231-p细胞后发现,其细胞迁移和侵袭性明显增强,Caveolin-1和β-catenin表达水平上升。结论:MAPK信号激活抑制三阴性乳腺癌的迁移和侵袭。
乳腺癌;蛋白激酶;迁移;侵袭
[Key words]Triple-negative breast cancer; MAPK; Migration; Invasion
乳腺癌是妇女最常见的恶性肿瘤之一,发病率占全身各种恶性肿瘤的7%~10%,近年来发病年龄呈年轻化。其发病常与遗传有关,在40~60岁绝经期前后的妇女中发病率较高[1]。虽然随着筛查和早期诊断水平以及手术、放化疗的综合治疗水平提高,患者生存期显著延长,但是三阴性乳腺癌的转移和复发依然导致80%以上的患者死亡[2]。因此,研究三阴性乳腺癌转移的机制对于提高乳腺癌整体生存率具有重大意义。
丝裂原激活的蛋白激酶(MAPK)参与调节细胞的很多生物学功能[3]。其成员有P38、Erk1/2、MEK等分子,因其在细胞内主要是通过磷酸化调节其他蛋白的功能,因此对肿瘤的发生、发展也极为重要[4]。虽然MAPK一般被认为促进肿瘤的发生[5],但其成员的激活可能具有抑制乳腺癌发生和转移的作用。Cotrim等[4]发现,MAPK的激活可能介导雌激素受体beta拮抗剂诱导的细胞生长抑制。P38的激活也可能介导Activin诱导的细胞生长抑制[6]。Uehara等[7]发现,用伏立诺他(vorinostat)处理231细胞系产生细胞凋亡与P38的激活有关,抑制P38的磷酸化水平,细胞凋亡率下降。由此可见,明确MAPK在乳腺癌中的功能可能对乳腺癌尤其是三阴性乳腺癌的诊治具有重要意义。本研究旨在分析和比较肺高转移三阴性乳腺癌231-HM及其父本细胞系231-p细胞中MAPK激活水平及其对体外细胞迁移和侵袭的影响。
1 材料和方法
1.1 细胞培养
231-p细胞是人三阴性乳腺癌细胞株MDAMB-231(购自ATCC),231-HM细胞由复旦大学附属肿瘤医院乳腺癌研究所构建[8],是将231-p细胞接种NOD/SCID裸鼠,然后从小鼠的肺转移灶中取出肿瘤组织并重新接种裸鼠,这样在体内经过4次传代而建立的细胞系,其肺转移能力比231-p细胞明显增强。细胞培养用的培养基为含10%胎牛血清、1 mmol/L 非必需氨基酸、2 mmol/L L-谷氨酰胺、100 U/mL青霉素及100 μg/mL链霉素的DEME(购于Gibco公司),培养环境为37 ℃、CO2体积分数为5%的恒温培养箱,PBS清洗细胞,含EDTA的0.25%胰酶消化传代。
1.2 细胞划痕实验
分别将231-HM、231-p以及用DMSO和P38/ MAPK抑制剂SB202190处理MAPK通路活性较高的231-p细胞等量接种至6孔板中,每种细胞接种3个平行孔。等到细胞完全融合的时候,再用10 μL枪头在每孔单层细胞上划痕,每孔划出的“伤口”宽度要保持一致。PBS清洗1次,加无血清培养基,37 ℃、CO2体积分数为5%的培养箱中培养,0、12、24 h分别观察划痕愈合情况并拍照。计算不同时间段细胞迁移的距离,以迁移距离反映细胞迁移性,实验重复3次。
1.3 细胞侵袭实验
实验采用带有8 μm微孔聚碳酸酯膜的Transwell小室(购自美国BD公司)。首先将Matrigel (50 mg/L)胶和无血清DMEM培养基以1∶3比例进行混合。在小室上室铺100 μL混合好的Matrigel,37 ℃无菌保持过夜,确保Matrigel充分凝固。收集对数生长期的231-HM、231-p以及分别用DMSO和P38/MAPK抑制剂SB202190处理的231-p细胞,用无血清DMEM培养基调整细胞浓度为1×106/mL,每孔加入100 μL细胞悬浮液于上室,每种细胞加3个复孔,下室每孔加600 μL无血清DMEM。37 ℃、CO2体积分数为5%的培养箱温育16 h后取出小室,滤膜用4%多聚甲醛固定20 min。用棉签小心擦去未侵袭的滤膜表面细胞,结晶紫染色,在光镜下随机选5个视野,计算单个视野细胞平均数,以穿过Matrigel的细胞数来表示肿瘤细胞的侵袭性,实验重复3次。
1.4 蛋白免疫印迹法(Western blot)检测
将细胞用蛋白裂解缓冲液RIPA (25 mmol/L Tris-HCl,pH=7.6;150 mmol/LNaCl,1%的NP-40,1%脱氧胆酸钠-sodium deoxycholate,0.1% SDS)及适量蛋白酶抑制剂混合物[4-(2-aminoethyl)benzenesulfonyl fluoride (AEBSF)、E-64、bestatin、leupeptin、aprotinin和EDTA]裂解后,用BCA法测定蛋白浓度(试剂盒购自碧云天),然后用6×的SDS加样缓冲液(125 mmol/L Tris-HCl pH=6.8、2% SDS、20%甘油、0.2%的溴酚蓝)制备成适当浓度的样品。样品分离前,用100 ℃水浴处理样品3~5 min。然后用10%的SDS-聚丙烯酰胺凝胶电泳分离裂解的蛋白样品。之后将蛋白转移到聚偏二氟乙烯膜(PVDF membrane)上,并用10%的脱脂奶粉(Bio-Rad)在室温下封闭2 h。此后依次加入一抗和HRP(辣根氧化物酶)-偶联的二抗(依一抗而定)。转移的膜上的蛋白用化学发光底物(ECL购自Millipore公司)进行显色后,LAS4000化学发光成像分析仪曝光显出条带。
1.5 P38/MAPK抑制剂处理细胞
用低浓度(10 µmmol/L)的P38/MAPK抑制剂SB202190处理231-p细胞,溶剂DMSO处理的231-p细胞作为对照,24 h后收取细胞,分别进行细胞迁移、侵袭和Western blot检测分析。
1.7 统计学处理
实验数据用x±s表示,采用SPSS 18.0统计分析软件进行统计学处理,实验组与对照组比较用t检验,两组以上数据比较用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 肺高转移细胞具有高体外迁移和侵袭性
231-p是一株三阴性乳腺癌细胞系,本实验室曾经用其接种NOD/SCID小鼠,从肺组织中分离和建立了肺高转移的乳腺癌细胞系231-HM[8]。细胞划痕检测结果显示,12 h后231-HM细胞中“伤口”已有明显的缩小,而231-p细胞迁移距离较短,24 h后231-HM细胞划痕已基本愈合,而231-p细胞仍有一段距离未闭合。说明231-HM细胞的迁移性比231-p细胞强(图1)。
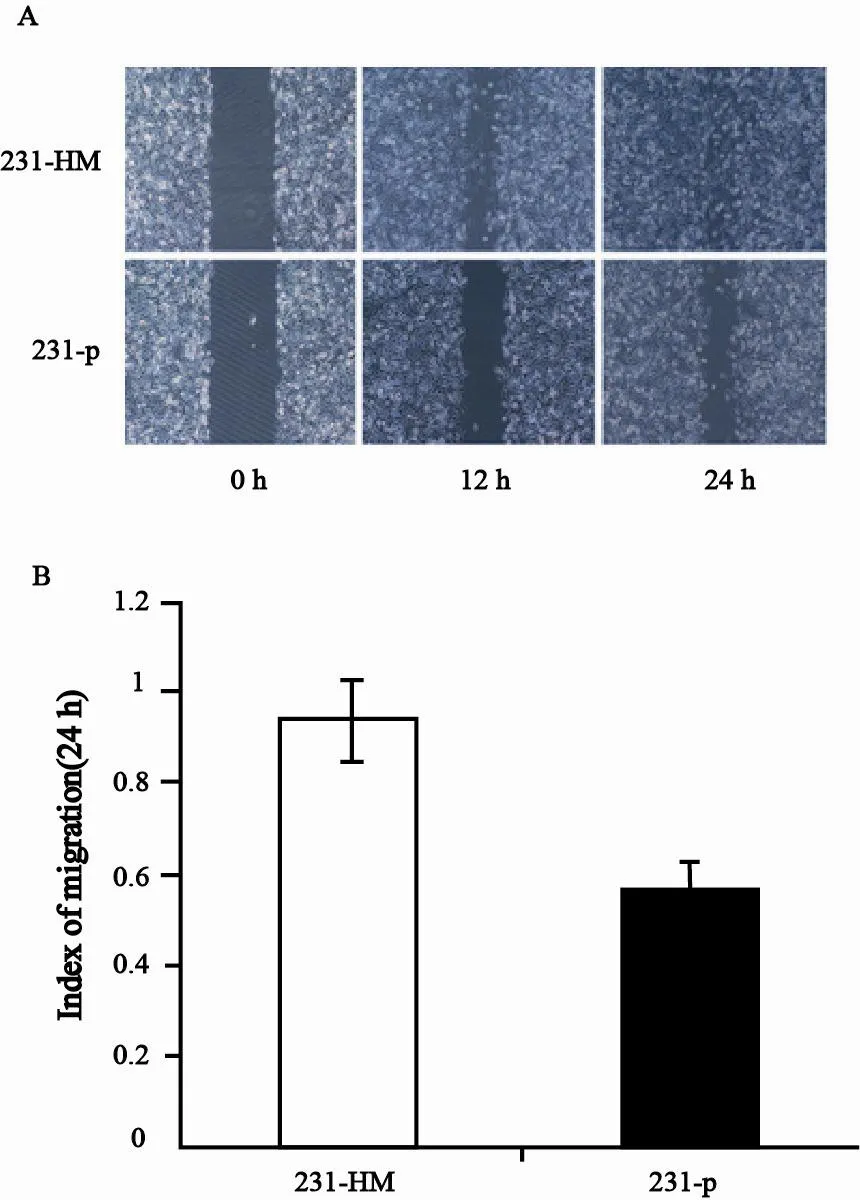
图 1 231-HM和231-p细胞体外迁移性的差别Fig. 1 The difference in the migration between 231-HM and 231-p cells
用带有Matrigel的Transwell小室检测231-HM和231-p细胞侵袭能力,结果显示,经过16 h体外培养,231-HM细胞穿过Matrigel的个数为1 254±143(单个视野的平均数),而231-p细胞穿过Matrigel的个数仅为521±38(单个视野的平均数),两者差异有统计学意义(P<0.05,图2)。说明231-HM细胞的体外侵袭性比231-p细胞强。
2.2 肺高转移细胞中MAPK磷酸化降低,促转移相关蛋白表达升高
Western blot检测结果显示,231-HM细胞中促转移蛋白Caveolin-1和β-catenin表达比231-p细胞中高,但P38、Erk1/2和MEK的磷酸化水平降低(图3)。说明MAPK信号激活可能抑制三阴性乳腺癌细胞的迁移和侵袭。
2.3 p38/MAPK抑制剂处理细胞显著降低促转移相关蛋白的表达
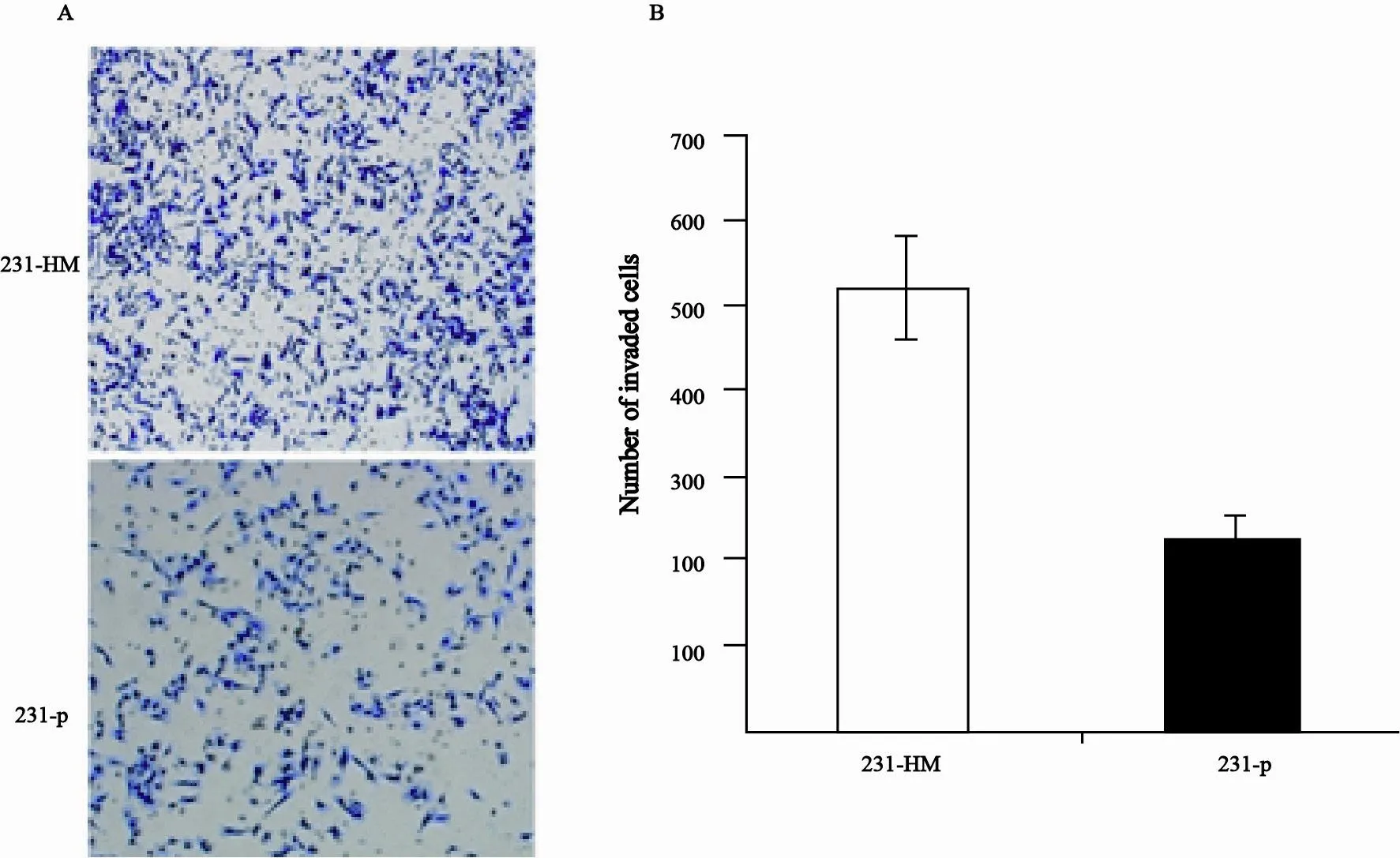
图 2 231-HM和231-p细胞体外侵袭性的差别Fig. 2 The difference in the invasion between 231-HM and 231-p cells
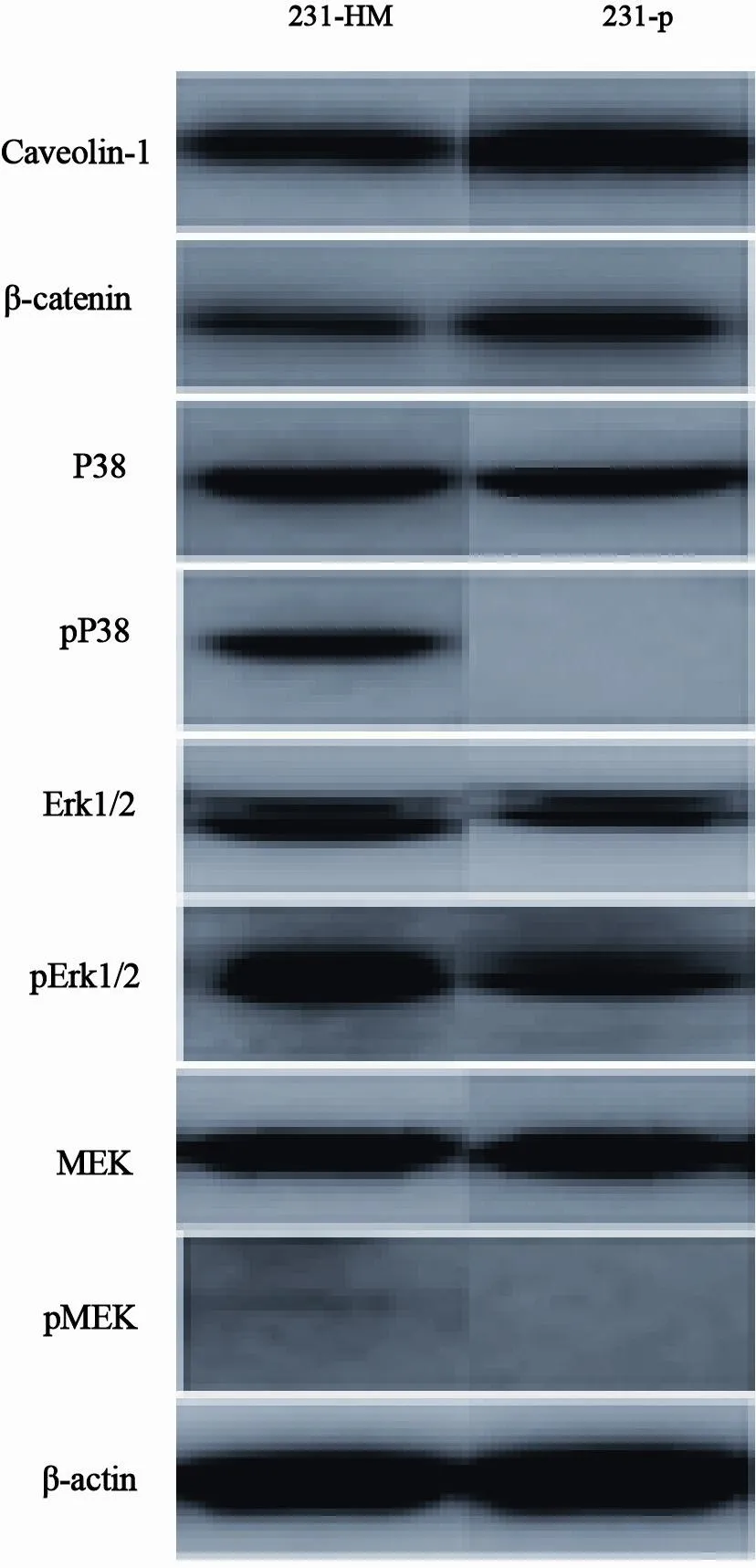
图 3 231-HM和231-p细胞中促转移蛋白Caveolin-1和β-catenin表达的差别以及MAPK通路激活的不同Fig. 3 The difference in the expression of metastasis-promoting proteins Caveolin-1 and β-catenin and activation of MAPK pathways between 231-HM and 231-p cells
Western blot检测结果显示,与用溶剂DMSO处理的细胞相比,用P38/MAPK抑制剂处理231-p细胞后P38的表达无明显变化,但磷酸化的P38水平明显降低,促转移相关蛋白Caveolin-1和β-catenin表达水平显著上升,进一步说明P38/MAPK信号的激活抑制三阴性乳腺癌细胞的迁移和侵袭(图4)。
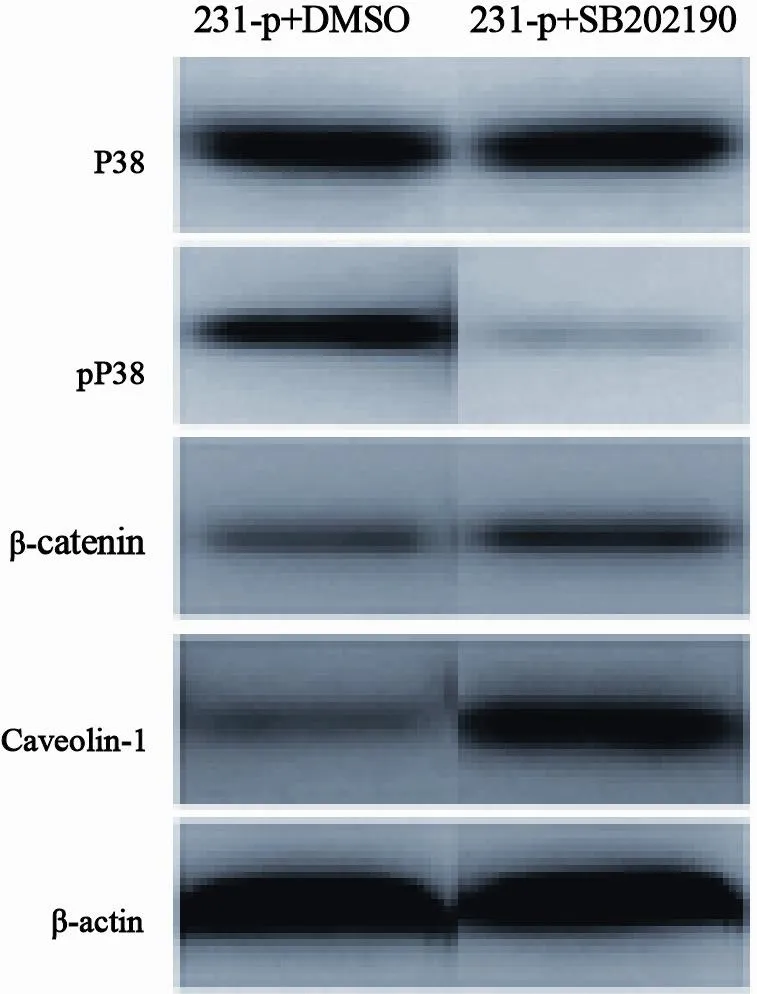
图 4 p38/MAPK抑制剂SB202190处理231-p细胞后转移相关蛋白Caveolin-1和β-catenin表达的变化Fig. 4 Changes in the expression of metastasis-related proteins Caveolin-1 and β-catenin in the 231-p cells with P38/MAPK inhibitor SB202190
2.4 p38/MAPK抑制剂处理细胞促进231-p细胞的迁移和侵袭
再次用细胞划痕和小室(Transwell)试验检测用SB202190处理的231-p细胞,结果显示划痕12 h后,处理的细胞中“伤口”明显缩小,而用溶剂处理的231-p细胞迁移距离相对短,24 h时抑制剂处理的细胞划痕接近愈合,而溶剂处理的细胞仍有部分未闭合(图5A)。同时,侵袭实验结果显示,经过16 h体外培养,抑制剂处理的细胞穿过Matrigel的个数为521±61, 而溶剂处理的231-p对照细胞穿过Matrigel的个数仅为219±32,差异有统计学意义(图5B)。说明抑制P38/MAPK可明显促进三阴性乳腺癌细胞系231-p的体外侵袭。
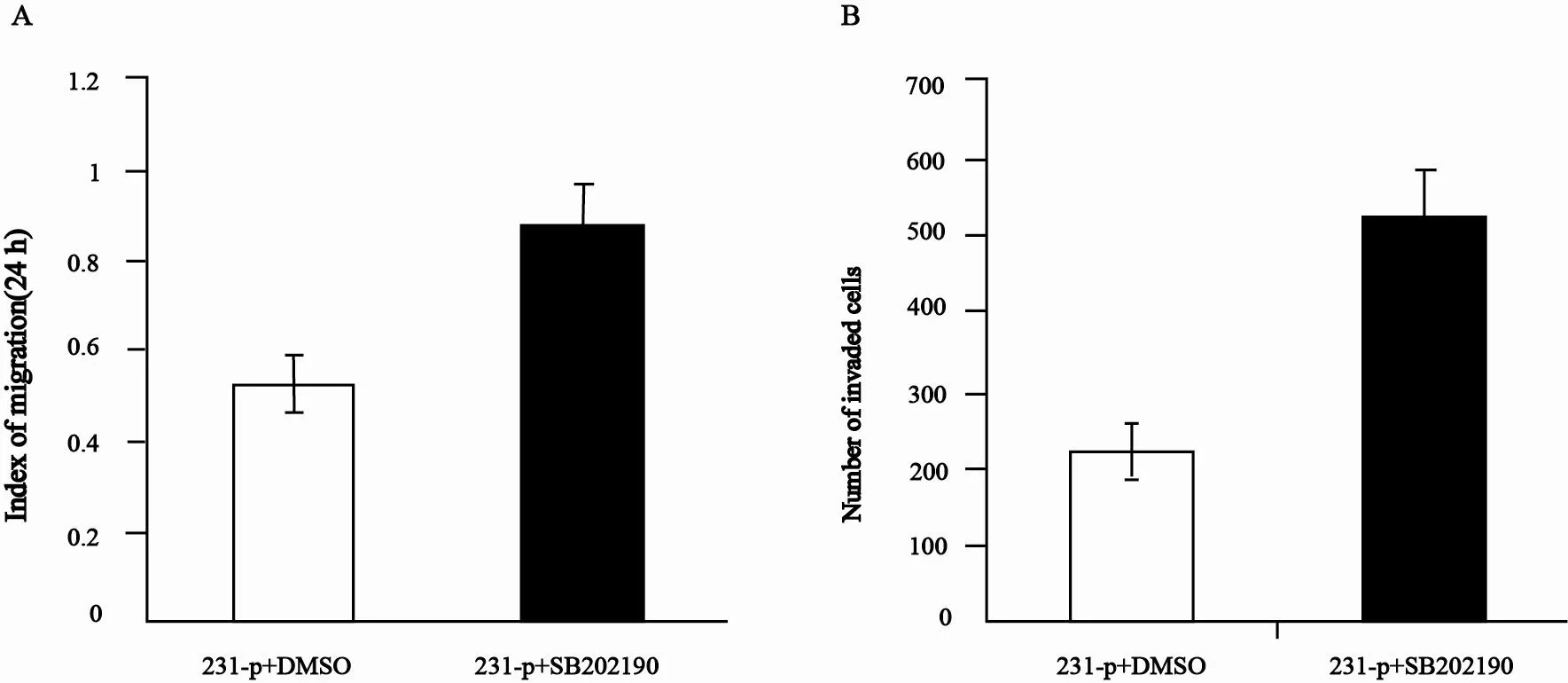
图 5 p38/MAPK抑制剂处理的231-p细胞体外迁移和侵袭性的变化Fig. 5 Changes of the migration and invasion in 231-p cells with P38/MAPK inhibitor
3 讨 论
本研究采用体外细胞划痕、侵袭实验和Western blot检测证明MAPK信号通路的激活抑制促转移相关蛋白β-catenin和Caveolin-1表达,从而抑制三阴性乳腺癌系231体外迁移和侵袭。
肿瘤的转移是个多因素、多步骤、多阶段过程,一般受到多个通路和信号分子的调控,而且涉及机制非常复杂。同一种蛋白分子对不同的肿瘤甚至对同一肿瘤在不同环境下有着不同调节作用。MAPK信号通路参与调控多种细胞功能,尤其是对细胞增殖、分化起关键调节作用[3]。此外,各种生长因子及细胞因子的信号传递大多通过MAPK信号通路来进行[9]。细胞外信号调节激酶(ERK)及其上游激酶(MEK)是该通路中两个重要的信号分子。MEK具有酪/苏氨酸蛋白激酶的活性,可活化其下游分子ERK,后者为丝/苏氨酸蛋白激酶,可进一步活化下游底物,进而诱导某些基因的表达启动,导致细胞增殖[10]。本研究比较和分析了肺高转231-HM细胞和231-p细胞中MAPK的激活水平,发现P38、Erk1/2、MEK的磷酸化水平在231-p细胞中明显增高,而促转移蛋白β-catenin和Caveolin-1的表达明显降低,用其特异性抑制剂SB202190处理231-p细胞系,P38的磷酸化水平明显受到抑制,但促转移蛋白β-catenin和Caveolin-1的表达增加,进而诱导其体外迁移和侵袭性加强。MAPK通路活化促进乳腺癌的侵袭和转移已有报道[11-12]。也有研究发现,MAPK可以阻滞Caveolin-1的表达,并抑制细胞的体外转化[13]。
总之,通过体外的初步研究,结果证明MAPK磷酸化水平可能通过阻滞癌转移相关蛋白的表达,抑制三阴性乳腺癌细胞的体外迁移和侵袭,在动物体内和人体组织中是否如此,尚需要更多的实验数据证实。但是本研究的结果揭示,在三阴性乳腺癌化疗中,必需谨慎使用MAPK抑制剂,此结果对于三阴性乳腺癌的个体化治疗具有一定的借鉴意义。
[1] 杨文涛. 个体化诊治时代的乳腺癌病理诊断[J]. 中国癌症杂志, 2012, 22(7): 556-558.
[2] LOI S, POMMEY S, HAIBE-KAINS B, et al. CD73 promotes anthracycline resistance and poor prognosis in triple negative breast cancer[J]. Proc Natl Acad Sci U S A, 2013, 110(27): 11091-11096.
[3] KOLCH W, CALDER M, GILBERT D. When kinases meet mathematics: the systems biology of MAPK signalling[J]. FEBS Lett, 2005, 579(8): 1891-1895.
[4] COTRIM C Z, FABRIS V, DORIA M L, et al. Estrogen receptor beta growth-inhibitory effects are repressed through activation of MAPK and PI3K signalling in mammary epithelial and breast cancer cells[J]. Oncogene, 2013, 32(19): 2390-2402.
[5] TKACH M, ROSEMBLIT C, RIVAS M A, et al. p42/p44 MAPK-mediated Stat3Ser727 phosphorylation is required for progestin-induced full activation of Stat3 and breast cancer growth[J]. Endocr Relat Cancer, 2013, 20(2): 197-212.
[6] COCOLAKIS E, LEMAY S, ALI S, et al. The p38 MAPK pathway is required for cell growth inhibition of human breast cancer cells in response to activin[J]. J Biol Chem, 2001, 276(21): 18430-18436.
[7] UEHARA N, KANEMATSU S, MIKI H, et al. Requirement of p38 MAPK for a cell-death pathway triggered by vorinostat in MDA-MB-231 human breast cancer cells[J]. Cancer Lett, 2012, 315(2): 112-121.
[8] XU W H, LIU Z B, YANG C, et al. Expression of dickkopf-1 and beta-catenin related to the prognosis of breast cancer patients with triple negative phenotype[J]. PLoS One, 2012, 7(5): e37624.
[9] LAU M T, SO W K, LEUNG P C. Fibroblast growth factor 2 induces E-cadherin down-regulation via PI3K/Akt/mTOR and MAPK/ERK signaling in ovarian cancer cells[J]. PLoS One, 2013, 8(3): e59083.
[10] SANTARPIA L, LIPPMAN S M, EL-NAGGAR A K. Targeting the MAPK-RAS-RAF signaling pathway in cancer therapy[J]. Expert Opin Ther Targets, 2012, 16(1): 103-119.
[11] MENG X, CAI C, WU J, et al. TRPM7 mediates breast cancer cell migration and invasion through the MAPK pathway[J]. Cancer Lett, 2013, 331(1): 96-102.
[12] WANG X F, ZHOU Q M, DU J, et al. Baicalin suppresses migration, invasion and metastasis of breast cancer via p38MAPK signaling pathway[J]. Anticancer Agents Med Chem, 2013, 13(6): 923-931.
[13] SASAI K, KAKUMOTO K, HANAFUSA H, et al. The Ras-MAPK pathway downregulates Caveolin-1 in rodent fibroblast but not in human fibroblasts: implications in the resistance to oncogene-mediated transformation[J]. Oncogene, 2007, 26(3): 449-455.
《抗癌》杂志2013年征订启事
《抗癌》杂志于1988年创刊,主管单位为上海市科学技术协会,主办单位为上海市抗癌协会。《抗癌》杂志是供癌症患者及其家属阅读的公益性科普期刊,树立了为科研服务的思想意识,坚持以读者为导向,架起读者和医院之间的桥梁。杂志刊号:CN31-1664/R ISSN 1008-3065。欢迎广大读者订阅。
杂志为季刊,每期48页。本刊季末出版,每期5元,全年共20元整。征订方式请通过邮局汇款。
通讯地址:上海市东安路270号6号楼3楼《抗癌》杂志社收。
邮 编:200032
电 话:021-64043766
传 真:021-64043766
电子邮件:anti-cancer@163.com
Activation of MAPK signaling is associated with migration and invasion of triple-negative breast cancer cells
XU Han1,2, DI Gen-hong1, YANG Gong2(1.Department of Breast Surgery, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Department of Cancer Research Center, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
YANG Gong E-mail: yanggong@fudan.edu.cn
Background and purpose: Triple-negative breast cancer (TNBC) possesses high risk of relapse and metastasis. Clinically, there are no specific targeted-therapies to TNBC except chemotherapy. Therefore, studying the mechanism of relapse and metastasis has significance to improve the patients’ survival rate. This experiment aimed to study the effect of MAPK activation on migration and invasion of triple-negative breast cancer cells. Methods: Difference of migration and invasion between lung-high metastasis breast cancer cell line 231-HM and its parental cell line 231-p were first examined by cell scratch and transwell; Then, metastasis-associated proteins and MAPK-associated molecules were detected by Western blot; Last, 231-p cells were treated with P38/MAPK inhibitor and used to determine cell migration, invasion, and metastasis-associated proteins thereafter. Results: Compared with the parental cell line 231-p, 231-HM cells displayed obviously higher ability of migration and invasion. With the increased expression of Caveolin-1and β-catenin, the phosphorylation of MAPK-associated molecules including P38, Erk1/2, and MEK was highly decreased. Treatment of 231-p cells with low concentration (10 µmol/L) of the P38/MAPK inhibitor SB202190 increased the migration and invasion of 231-p cells, and the expression of Caveolin-1 and β-catenin. Conclusion: Activation of MAPK signaling inhibits the migration and invasion of triple-negative breast cancer.
10.3969/j.issn.1007-3969.2013.11.004
R737.9
:A
:1007-3639(2013)11-0874-06
2013-07-29
2013-09-10)
2011年上海市卫生局课题项目(No:JG1101)。
杨恭 E-mail:yanggong@fudan.edu.cn
[关键词]三阴性乳腺癌;蛋白激酶;迁移;侵袭

