一株产淀粉酶枯草芽孢杆菌16S rDNA的克隆及序列分析
李元召,孙俊良,李东霄,张永帅
(1.河南科技学院,河南新乡453003;2.酶制剂工程研究所,河南新乡453003)
一株产淀粉酶枯草芽孢杆菌16S rDNA的克隆及序列分析
李元召1,孙俊良1,李东霄1,张永帅2
(1.河南科技学院,河南新乡453003;2.酶制剂工程研究所,河南新乡453003)
对实验室保存的一株产α-淀粉酶的枯草芽孢杆菌的16S rDNA区进行克隆及序列分析.采用PCR克隆方法,对其菌株的16S rDNA区进行序列扩增,扩增产物经琼脂糖凝胶电泳,获得一个大小约为1 300 bp的特异性扩增条带,随后将测序结果用GeneBank数据库中的BLAST软件与获取的已知枯草芽孢杆菌的16S rDNA序列进行序列比对分析.结果表明:该枯草芽孢杆菌与枯草芽孢杆菌FZB42具有相似的序列,相似性为97%.根据上述分析结果可判定2种枯草芽孢杆菌为同属细菌.
枯草芽孢杆菌;16SrDNA;序列扩增;基因测序
淀粉酶是一类被广泛应用于粮食加工、食品工业、酿造、发酵、纺织品工业和医药行业等众多领域的酶制剂.淀粉酶可由微生物发酵产生,也可从植物和动物中提取,目前工业生产上都以微生物发酵法进行大规模生产淀粉酶[1].枯草芽孢杆菌的定性和分类主要依赖于形态和生理特征.然而,这些特征所表现的均是表型性状,难以反映种间亲缘关系,因此它们所反映的遗传基础是有限的.随着DNA序列分析技术的日趋成熟和简易化,现代细菌学更倾向于细菌的基因型特征结合表型特征进行分类,细菌基因组中编码核糖体的基因包括5S rDNAs、16S rDNAs和23S rDNAs3种,目前公认的方法是依据细菌16S rDNA序列进行分类[2-3].而利用细菌的16S rDNA序列进行同源性比较和系统发育分析已然成为鉴定细菌的一个重要手段[4].
16S rDNA是编码原核生物核糖体小亚基rRNA(16S rRNA)的基因,长度约为1 600 bp,其序列包含10个可变区和11个恒定区[5].16S rDNA在结构上既具有保守性,又具有高变性.不仅能反映出生物物种的亲缘关系,而且是属种鉴定的分子水平基础.因此,16S rDNA可以作为细菌分析最常用的系统进化标记分子.把待测细菌的16S rDNA序列测定出来,然后与数据库中的已知菌种进行比较,即可确定供试菌的分类地位.因此可以最大程度地保证结果的准确性和客观性[6].
因此,本试验对一株α-淀粉酶产量较高的枯草芽孢杆菌16SrDNA进行克隆和分析,以确定该菌的种类.同时,对枯草芽孢杆菌的鉴定,也为今后分离和研究其淀粉酶酶的基因结构和蛋白功能奠定了基础.
1 材料与方法
1.1 试验材料
1.1.1 菌种与培养基
枯草芽孢杆菌B-1A5:由河南科技学院食品学院发酵工程实验室保藏提供.
培养基:蛋白胨2.0 g,牛肉膏1.0 g,葡萄糖1.0 g,NaCl1.0 g,蒸馏水200mL,pH 7.2~7.4,固体培养基添加2%的琼脂粉.121℃灭菌15min.
1.1.2 主要试剂和仪器
试剂:细菌基因组DNA提取试剂盒(Solarbio公司);pMD-18T载体试剂盒购自宝生物工程有限公司;凝胶回收试剂盒购置于上海生工生物有限公司;10×PCR buffer、TAE buffer、Taq DNA聚合酶购自欧瑞卡、dNTP宝生物工程(大连)有限公司,DNA相对分子质量标准物Maker 2000(上海生工生物),DNA扩增试剂盒,其他试剂均为分析纯产品.
引物上游和引物下游英俊有生物技术有限公司合成,如下:
引物上游:5'-AGGAAGCGGAAGAATG-3'
引物下游:5'-TAGCCTTGCCCTCAAT-3'
仪器:SW-CJ-1F型净化工作台(苏州净化设备有限公司);琼脂糖凝胶电泳系统(北京市六一仪器厂);D-37520型高速冷冻离心机(德国Sigma公司);纯水机(LABCONCO公司);HVE-50型高压灭菌锅(HIRAYAMAMANUFACTURING公司);SARTORIUS型电子分析天平(Sartorius公司);SPX-250型电热恒温水温箱(北京市光明医疗器械厂);T-Gradient型PCR热循环仪(德国Biometra公司);WFJ 7200型紫外分光光度计(上海尤尼柯仪器有限公司);GeIX1650型凝胶图像分析系统(上海欧翔科学仪器有限公司);其他均为实验室常用仪器.
1.2 试验方法
1.2.1 芽孢杆菌B-1A5活化培养将-70℃保存的芽孢杆菌B-1A5转接于装有液体培养基的5mLEP管中,接种量为2%,活化4 h后进行平板划线,分离单菌落.挑取单菌落转接于25mL三角瓶中进行扩大培养.培养条件为37℃,210 r/min振荡培养16 h.
1.2.2 枯草芽孢杆菌核基因组提取取1mL过夜培养的细菌菌液放入1.5mL的离心管中,室温下8000 r/min离心1min,弃上清,重悬沉淀于1.0mL的质量分数为0.85%的NaCl溶液,4℃,13 000 r/min离心5min,弃上清,加520μLTE溶解,然后加17μL的溶菌酶,37℃水浴30min;加蛋白酶K(20mg/mL)至终浓度为100 ng/mL,混匀后30℃水浴30min;加30μL 10%SDS,30℃水浴30min;加100μL浓度为5mol/L的NaCl溶液,加80μLCTAB/NaCl溶液,混匀后65℃水浴10min;加等体积酚氯仿异戊醇混液(V酚∶V氯仿∶V异戊醇=25∶24∶1),混匀,4℃,13 000 r/min离心10min;移上清至1.5mL新离心管,加等体积氯仿异戊醇混液(V氯仿∶V异戊醇=24∶1),混匀,离心;移上清至1.5mL新离心管,加0.6倍体积异丙醇,混匀后室温静置60min;离心,弃上清,加500μL体积分数为70%的乙醇(洗盐),颠倒数次,离心,重复2次,倒置离心管,干燥DNA沉淀10~15min;将DNA溶于60μLTE缓冲液,-20℃下保存.
1.2.3 16S rDNA PCR扩增及PCR产物检测取上述制备的枯草芽孢杆菌B-1A5基因组DNA作为PCR扩增的模板,采用50.0μL的反应体系.反应产物瞬时离心后采用的反应程序为:98℃预变性5min, 98℃变性10 s,55℃褪火15 s,72℃延伸2min,10℃保存,该程序循环30次.
PCR反应体系(50μL):5×Prime STARBuffer10.0μL,dNTPmixture4.0μL,Primer上下游各1.0μL, Primer STARHSDNA Polymerase 0.5μL,ddH2O 32.5μL,DNA 1μL.其中将PCR反应体系分装成2组,一个为试验组,另一个为阴性对照组.
制备质量分数为1%的琼脂糖凝胶:称量150mg的琼脂糖加入到15mL的电泳缓冲液中(1× TAE),利用微波炉加热,待琼脂糖溶液冷却到55℃左右,加入1μL的EB染液.待琼脂糖凝固后,拔出梳子将凝胶放置含有1×TAE缓冲液的电泳槽中(电击缓冲液的液面高于凝胶的液面0.5mm),注意电极要对应.取PCR产物5μL与6×上样缓冲液均匀混合后加入到琼脂糖凝胶上样孔中进行电泳,电压设置220 V,电流400mA,电泳液为1×TAE,时间17min.若PCR验证成功,则可以观察到约为1 300 bp的条带.
1.2.4 16S rDNA基因片段的测序及分析将成功获得的PCR产物用pMD-18T载体试剂盒进行连接过夜,验证后有上海英骏生物技术有限公司北京测序部128进行测序,将测序结果直接输入到Genbank中,利用BLAST功能组件将测到的基因序列与Genbank数据库的序列进行同源性比较.
2 结果与分析
2.1 琼脂糖凝胶电泳验证基因组DNA提取结果
用质量分数为1%的琼脂糖凝胶对实验菌株的基因组DNA进行电泳检测,采用GeIX1650型凝胶图像分析系统采集相片观察,结果如图1所示.
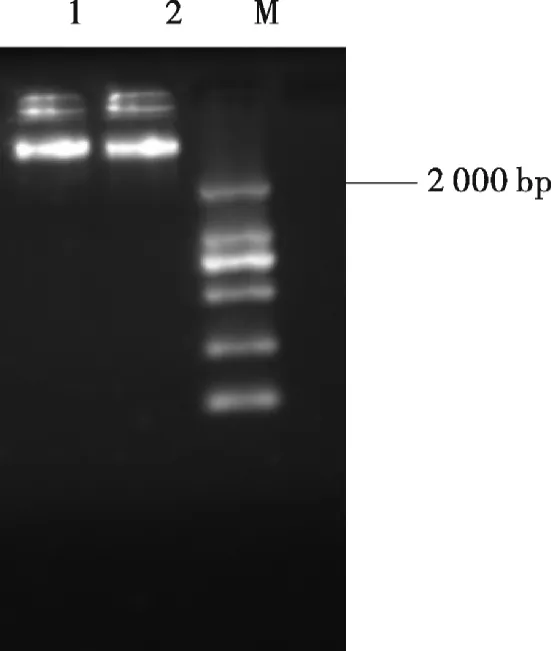
图1 芽孢杆菌基因组DNA电泳图Fig.1 Electrophoretogram of Bacillus subtilis genomic DNA
由图1可知,所提取的基因组无明显的拖尾及条带不均匀现象,说明该基因组DNA纯度较好,基本能够满足后续16s rDNA扩增和测序的需求.
2.2 16S rDNA基因片段的PCR扩增结果
用质量分数为1%的琼脂糖凝胶对试验菌株的16S rDNA的PCR扩增产物进行电泳检测,通过GeIX 1650型凝胶图像分析系统采集相片观察,16S rNDA PCR扩增产物琼脂糖凝胶电泳结果如图2所示.
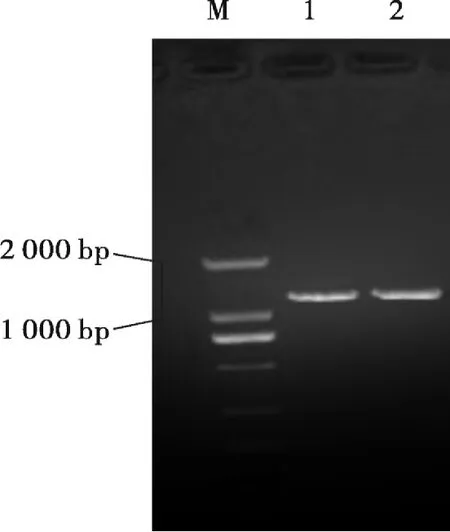
图2 芽孢杆菌16S rDNA区域PCR扩增结果Fig.2 PCR amplification resultof Bacillus subtilis16S rDNA
由图2可知,在约1 300 bp处出现了荧光条带,而且没有拖尾和不均现象,大小与期望值相符,说明PCR扩增成功,能满足后续测序的需求.
2.3 16S rDNA基因片段的测序与序列分析
对PCR结果测序,测序结果如下:

测序结果显示目的片段约为1 300 bp.将测序结果与国际分子生物学数据库中的序列用BLAST软件进行同源性分析,经检索比对发现该基因片段与网上公开枯草芽孢杆菌株FZB42的相关片段序列有97%同源性.
3 结论
试验用一株产淀粉酶枯草芽孢杆菌,对其16SrDNA片段克隆与序列分析并且根据前期对芽孢杆菌B-1A5生物学特征的研究结果以及序列鉴定后发现,该枯草芽孢杆菌菌株与网上公布的枯草芽孢杆菌菌株FZB42序列有97%的序列同源性,因目前普遍认为当16S rDNA序列同源性高于97%时[7],是属内关系,高于99%时为种内关系[8],当小于95%为属外成员[9].因此可以判断这两种菌是同属菌种属于同一个属,但是因其序列相似性未达到99%以上,且16S rDNA序列种间变化很大,因此极有可能非同一个种.
[1]谷军.α-淀粉酶的生产与应用[J].生物技术,1994,4(3):1-5.
[2]李瑞芳,赵玉峰,魏建,等.具有稻瘟病菌拮抗活性的枯草芽孢杆菌的分离与鉴定[J].河南农业科学,2010,39(3):63-66.
[3]Gupta R K,Datta M,Banik S.Studies on the efficacy of a phytohormone producing pliospliate solubiliz-ing Bacillus subtilis in augmenting paddy yield in acid soilsofN-agaland[J].Plantand Soil,2000,89:765-774.
[4]张振粉,陈秀蓉.牧草内生枯草芽孢杆菌的功能多样性及其16SrDNA鉴定[J].甘肃农业大学学报,2010(6):12-15.
[5]傅君芬,洪文谰.16S-23S基因序列:一种新的细菌分类鉴定方法[J].国外医学:流行病学传染病学分册,1998,25(6):245-249.
[6]李瑞芳,赵玉峰,薛雯雯.一株芽孢杆菌16S rRNA的基因序列测定和系统进化分析[J].广东农业科学,2011(3):121-125.
[7]苏波,康建平,黄静.16S rDNA序列分析鉴定一株芽孢杆菌[J].食品与发酵科技,2010,46(5):1-3.
[8]黄继翔.产碱性蛋白酶芽孢菌株的鉴定[J].微生物通报,2011,38(2):157-163.
[9]陈相达,戴慧慧,刘燕.一株高产淀粉酶枯草芽孢杆菌的筛选、鉴定及产酶条件的优化[J].温州医学院学报,2011,41(1):40-47.
(责任编辑:邓天福)
16S rDNA sequence cloning and analysis of a high am ylaseproduction Bacillus subtilis strain
Li Yuanzhao1,Sun Junliang1,LiDongxiao1,Zhang Yongshuai2
(1.Henan InstituteofScienceand Technology,Xinxiang453003,China;2.Amylase ExperiementCenter for Scientific Research,Xinxiang453003,China)
This experiment adopted the genome which extracted form Bacillus subtilis strain that can hydrolyze amylase as a template,used the PCR cloning method to amplify the 16S rDNA Regions sequence of it.Through the agarose gel electrophoresis of the PCR products,a specific amplification bands in the size of approximately 1 300 bp was got.Used the sequence determination and the comparative analysis of the known Bacillus subtilis's 16S rDNA sequence which got from the International Molecular Biology Database in Internet,the results showed that,according to the results of the 16S rDNA sequence analysis,it would be found that the similarity between the two strains was about 97%.It can be initially identified that these two strains belong to the same kind.
Bacillus subtilis;16S rDNA;sequence amplification;gene sequencing
Q78
A
1008-7516(2013)03-0037-05
10.3969/j.issn.1008-7516.2013.03.007
2013-05-05
国家自然科学基金项目(C200101)
李元召(1986-),男,河南洛阳人,硕士研究生.主要从事食品生物技术研究.
孙俊良(1964-),男,河南新乡人,教授,硕士生导师.主要从事食品生物技术与酶工程研究.

