SPARCL1在胆管癌中的表达及其预后价值
张浩石伟宋宁王叙馥
1.复旦大学附属华山医院普外科,上海 200040;
2.青岛大学医学院附属医院核医学科,山东 青岛,266003
SPARCL1在胆管癌中的表达及其预后价值
张浩1石伟1宋宁1王叙馥2*
1.复旦大学附属华山医院普外科,上海 200040;
2.青岛大学医学院附属医院核医学科,山东 青岛,266003
背景与目的:SPARC类似蛋白1(SPARC-like 1,SPARCL1)是细胞外基质蛋白SPARC相关家族成员,在多种肿瘤细胞中低表达,有肿瘤抑制作用。本研究探讨其在胆管癌中的表达及与预后的关系。方法:采用组织芯片和免疫组织化学技术检测胆管癌和部分癌旁非肿瘤组织中SPARCL1蛋白的表达,并分析其与各项临床病理参数及患者预后的关系。结果:免疫组化结果显示,SPARCL1在胆管癌中的表达率为47.9%(23/48),在癌旁胆管上皮中均有表达。SPARCL1的表达与区域淋巴结转移和神经侵犯呈负相关,生存期分析显示SPARCL1阳性患者预后明显优于阴性患者(37.3 vs 12.8个月,P<0.001)。结论:SPARCL1在胆管癌的发生发展过程中起着重要作用,是影响胆管癌患者预后的重要因素。
胆管癌;SPARCL1;预后
SPARC类似蛋白1(SPARC-like 1,SPARCL1)是SPARC家族成员之一,与SPARC序列有62%的同源性。两者都拥有富含半胱氨酸的卵泡抑素样结构域和胞外钙结合结构域,但SPARCL1的N端较长。SPARCL1是分泌型的基质细胞糖蛋白,参与多项机体生理过程,如细胞黏附、增殖,肌肉分化以及B淋巴细胞成熟等[1]。SPARCLl是抑癌分子,可以抑制细胞的增生、侵袭和转移[2-3]。研究发现,SPARCL1在多种肿瘤中低表达[4-7],但与临床预后的关系只在前列腺癌、结直肠癌和胃癌中有报道[4-6]。SPARCL1在胆管癌中的表达及与预后的意义尚不明确。本研究旨在探讨SPARCL1蛋白在胆管癌组织中的表达及其与临床病理参数和预后之间的关系。
1 资料和方法
1.1 组织标本
构建含有胆管癌标本和部分对应癌旁正常黏膜上皮的胆管癌组织芯片。该芯片含有48例胆管癌术后标本,15例非肿瘤组织,其中男性34例,女性14例,年龄31~79岁,中位年龄60岁。所有患者具有完整的随访资料,随访时间1~60个月,中位时间为23个月。
1.2 试剂与方法
羊抗多克隆抗体SPARCL1(AF2728,稀释比例为1∶400)购自R&D Systems公司。SP免疫组化试剂盒购自福州迈新公司。免疫组化技术采用SP法,PBS替代一抗作阴性对照。
1.3 结果判断
SPARCL1阳性染色为淡黄色、棕黄色或棕褐色,定位于细胞质和(或)细胞膜。采用二级计分法,阳性细胞计数根据阳性细胞所占5个以上高倍镜视野比例计数分为4类:5%~25%为1分;25%~50%为2分;50%~75%为3分;>75%为4分。染色强度分类:淡黄色为1分;黄或深黄色为2分;褐或棕褐色为3分。两者计分相乘大于1为阳性。
1.4 统计学处理
采用SPSS 11.0软件进行统计处理。组内变量采用配对χ2检验。单因素生存分析采用Kaplan-Meier分析,P<0.05为差异有统计学意义。
2 结 果
2.1 SPARCL1在癌旁黏膜和肿瘤中的表达
免疫组化检测结果显示,SPARCL1呈淡黄至棕黄色,癌旁组织普遍着色,肿瘤中呈弥漫或片状分布(图1A、B、C)。SPARCL1在胆管癌中的表达率显著低于癌旁非肿瘤组织,为47.9%(23/48),差异有统计学意义(P<0.05)。
2.2 SPARCL1表达与临床病理参数间的关系
SPARCL1表达水平与多项临床病理参数的相关性分析结果显示,SPARCL1的表达与年龄、性别、临床分期、组织学分级及肿瘤大小等参数无明显相关性(P>0.05),与肿瘤的区域淋巴结转移和神经侵犯呈显著负相关(P<0.05,表1)。
2.3 生存期分析
生存期分析显示,SPARCL1阳性患者的总体生存期为37.3个月,而阴性患者仅为12.8个月,两者之间差异有统计学意义(P<0.001,图2)。

图 1 SPARCL1在胆管癌组织中的免疫组化染色Fig. 1 Immunohistochemical staining for SPARCL1 of cholangiocarcinoma
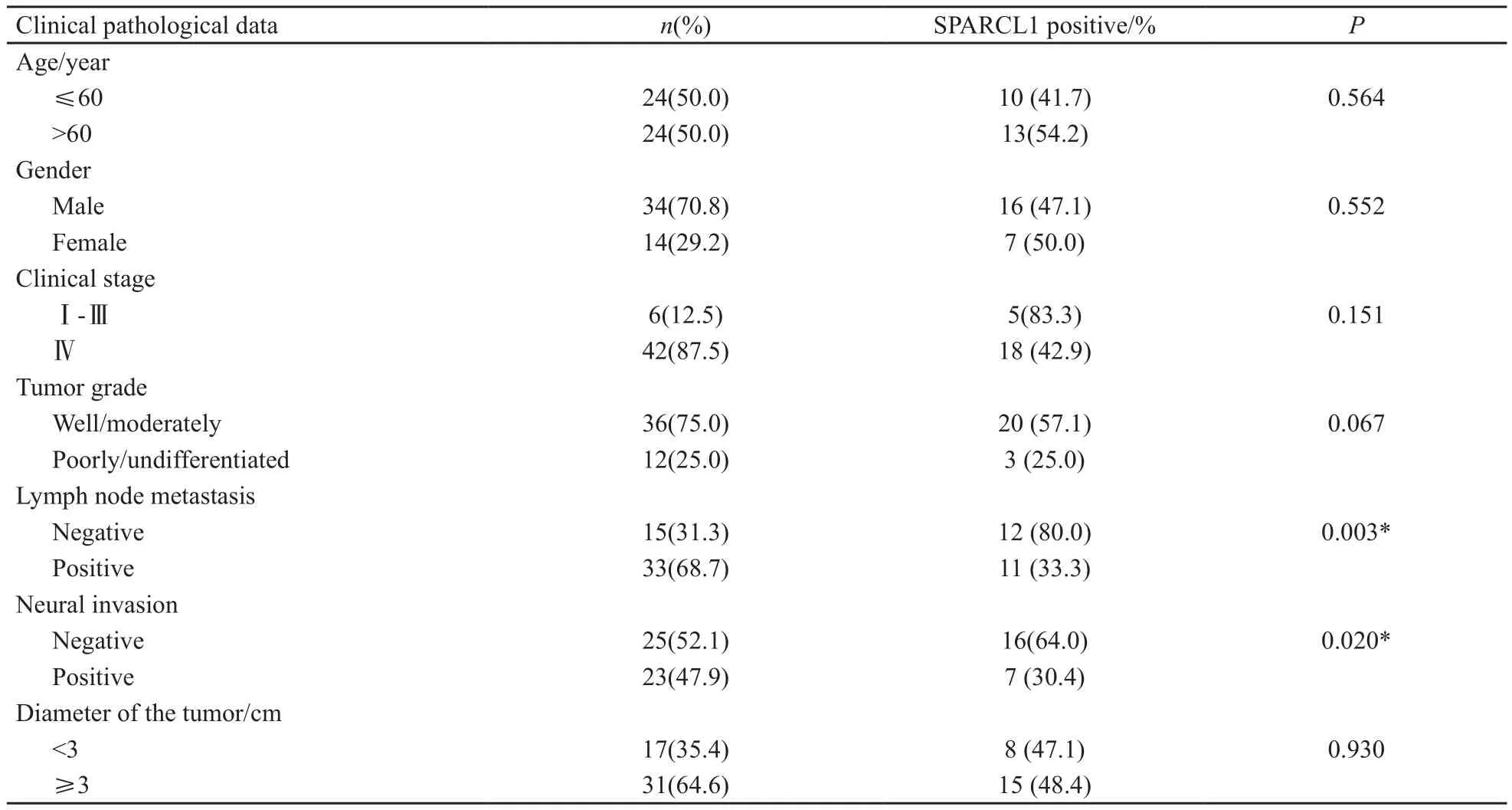
表 1 SPARCL1的表达与胆管癌临床病理参数之间的关系Tab. 1 Relationship between SPARCL1 expression and clinicopathologic features in the patients with cholangiocarcinoma
3 讨 论
近年来,胆管癌发病率有逐年上升的趋势,治疗目前以手术切除为主[8]。大部分胆管癌患者诊断时往往已是晚期,不能手术切除,5年存活率仅为8%~45%。因而深入探讨胆管癌发病机制,寻找判断胆管癌预后的相关分子标志物,并加以干预是目前研究的热点和难点之一[9]。此前的研究显示了SPARCL1蛋白在前列腺癌[4,10]、非小细胞肺癌[11]、胰腺导管癌[7]、胃癌[6]、结直肠癌[5]及膀胱癌[12]中低表达,而在肝癌中高表达[13],与临床预后的关系只在前列腺癌、结直肠癌和胃癌中有报道[4-6]。其在胆管癌中表达情况及与预后的关系尚未可知。本研究检测了SPARCL1蛋白在胆管癌中表达,并分析了其与临床病理指标和预后的关系。
本研究发现SPARCL1在胆管癌旁黏膜上皮中广泛表达,而在胆管癌组织中表达显著下降,仅为47.9%,差异有统计学意义(P<0.05)。提示SPARCL1的缺失是胆管癌发生发展的因素之一。进一步分析发现,SPARCL1的表达与淋巴结转移密切相关,有淋巴结转移者表达降低,有淋巴结转移者较无淋巴结转移者,SPARCL1的表达差异有统计学意义(P=0.003)。还发现SPARCL1的表达与神经侵犯呈负相关,有神经侵犯病例的SPARCL1表达降低,有神经侵犯者较无神经侵犯者,SPARCL1的表达差异有统计学意义(P=0.02)。生存期分析显示,SPARCL1阳性患者预后明显优于阴性患者(37.3 vs 12.8个月,P<0.001)。有研究证实SPARCL1能够抑制细胞的黏附和扩散[13],显示淋巴结转移和神经侵犯是胆管癌细胞的重要生物学特性,有无淋巴结转移和神经侵犯与治疗敏感性和预后具有高度相关性。本研究结果进一步表明,SPARCL1参与了胆管癌的发生和发展,其表达水平与胆管癌的恶性生物学行为呈负相关,显示SPARCL1具有肿瘤抑制功能,也提示SPARCL1蛋白是判断胆管癌预后的标志物。
临床分期和肿瘤分化程度是指导肿瘤治疗和判断肿瘤患者预后的重要指标。SPARCL1 的表达与胃癌TNM分期及分化程度明显相关[6],在高分化和临床分期低的结直肠癌组织中表达较高[5]。但本研究未发现SPARCL1表达与胆管癌的临床分期和分化程度相关,可能是由于大部分胆管癌患者确诊时已经处于晚期,本组Ⅳ期患者占了87.5%,临床分期的代表性下降所致。
总之,本研究发现SPARCL1的表达与胆管癌的发生、转移密切相关,SPARCL1的表达缺失还可以作为胆管癌患者预后的重要指标,但其具体作用机制还有待于进一步研究。
[1] BREKKEN R A, SULLIVAN M M, WORKMAN G, et al. Expression and characterization of murine hevin (SC1), a member of the SPARC family of matricellular proteins[J]. J Histochem Cytochem, 2004, 52(6): 735-748.
[2] CHITTKA A, AREVALO J C, RODRIGUEZ-GUZMAN M, et al. The p75NTR-interacting protein SC1 inhibits cell cycle progression by transcriptional repression of cyclin E[J]. J Cell Biol, 2004, 164(7): 985-996.
[3] SULLIVAN M M, SAGE E H. Hevin/SC1, a matricellular glycoprotein and potential tumor-suppressor of the SPARC/ BM-40/osteonectin family[J]. Int J Biochem Cell Biol, 2004, 36(6): 991-996.
[4] HURLEY P J, MARCHIONNI L, SIMONS B W, et al. Secreted protein, acidic and rich in cysteine-like 1 (SPARCL1) is down regulated in aggressive prostate cancers and is prognostic for poor clinical outcome[J]. Proc Natl Acad Sci USA, 2012, 109(37): 14977-14982.
[5] HU H, ZHANG H, GE W, et al. Secreted protein acidic and rich in cysteines-like 1 suppresses aggressiveness and predicts better survival in colorectal cancers[J]. Clin Cancer Res, 2012, 18(19): 5438-5448.
[6] LI P, QIAN J, YU G, et al. Down-regulated SPARCL1 is associated with clinical significance in human gastric cancer[J]. J Surg Oncol, 2012, 105(1): 31-37.
[7] ESPOSITO I, KAYED H, KELEG S, et a1. Tumor-suppressor function of SPARC-like protein 1/Hevin in pancreatic cancer[J]. Neoplasia, 2007, 9(1): 8-17.
[8] ITO F, CHO C S, RIKKERS L F, et al. Hilar cholangiocarcinoma: current management[J]. Ann Surg, 2009, 250(2): 210-218.
[9] SANO T, SHIMADA K, SAKAMOTO Y, et al. Prognosis of perihilar cholangiocarcinoma: hilar bile duct cancer versus intrahepatic cholangiocarcinoma involving the hepatic hilus[J]. Ann Surg Oncol, 2008, 15(2): 590-599.
[10] NELSON P S, PLYMATE S R, WANG K, et al. Hevin, an antiadhesive extracellular matrix protein, is down-regulated in metastatic prostate adenocarcinoma[J]. Cancer Res, 1998, 58(2): 232-236.
[11] BENDIK I, SCHRAML P, LUDWIG C U. Characterization of MAST9/Hevin, a SPARC-like protein, that is down-regulated in non-small cell lung cancer[J]. Cancer Res, 1998, 58(4): 626-629.
[12] ZARAVINOS A, LAMBROU G I, BOULALAS I, et al. Identification of common differentially expressed genes in urinary bladder cancer[J]. PLoS One, 2011, 6(4): e18135.
[13] LAU C P, POON R T, CHEUNG S T, et al. SPARC and Hevin expression correlate with tumour angiogenesis in hepatocellular carcinoma[J]. J Pathol, 2006, 210(4): 459-468.
Expression of SPARCL1 in cholangiocarcinoma and its relationship with the prognosis
ZHANG Hao1, SHI Wei1, SONG Ning1, WANG Xu-fu2(1.Department of General Surgery, Affiliated Huashan Hospital of Fundan University, Shanghai 200040, China; 2.Department of Nuclear Medicine, The Affiliated Hospital of Qingdao University Medical College, Qingdao Shandong 266003, China)
WANG Xu-fu E-mail: wangxufu@sina.com
Background and purpose:SPARC-like 1 (SPARCL1) is a member of extracellular matrix protein SPARC family, it was found to be down-expressed and had tumor inhibitory role in several cancers. This study aimed to investigate the SPARCL1 expression and determine its clinical significance in cholangiocarcinoma. Methods:Tissue microarray blocks containing tumor specimens obtained from 48 patients were constructed. Expressions of SPARCL1 in these specimens were detected by immunohistochemistry (IHC) method. Results:IHC showed that expression of SPARCL1 was observed in 23 cases (47.9%) of 48 primary tumors. SPARCL1 expression was significantly inversely associated with lymph node metastases and nerve invasion. Loss of SPARCL1 expression significantly correlated with poor survival in univariate analysis (37.3 vs 12.8 months, P<0.001). Conclusion:Our results showed SPARCL1 expression significantly changed in cholangiocarcinoma, and suggested the importance of SPARCL1 as a biomarker in cancer development and progression.
Cholangiocarcinoma; SPARCL1; Prognosis
R735.8
:A
:1007-3639(2013)02-0126-04
2012-08-15
2012-12-20)
王叙馥 E-mail:wangxufu@sina.com
DOI: 10.3969/j.issn.1007-3969.2013.02.008

