靶向沉默HOXA9基因对U937细胞体内外增殖的影响
滨州医学院附属医院儿科,山东 滨州 256603
靶向沉默HOXA9基因对U937细胞体内外增殖的影响
贾秀红 张艳君 李建厂
滨州医学院附属医院儿科,山东 滨州 256603
背景与目的:多数急性髓系白血病(acute myelocytic leukemia,AML)患者高表达同源盒A9(homeoboxA9,HOXA9),而HOXA9高表达与患者预后差有关。本研究探讨慢病毒载体介导shRNA(short harpin RNA,siRNA前体)靶向沉默HOXA9基因对人急性单核白血病细胞株U937细胞在体内外增殖的影响。方法:将U937细胞分为干扰组、阴性对照组、空白对照组,转染效率>90%时,经蛋白质印迹法(Western blot)测定对HOXA9基因的沉默作用;FCM检测各组细胞周期的变化;绘制各组细胞生长曲线。将32只裸鼠腹腔接种U937细胞,随机分为4组,即阴性对照组、干扰组、阴性对照联合VCR组、干扰联合VCR组,每组8只,每只裸鼠腹腔注射环磷酰胺100 mg/kg,连续4 d。1周后向阴性对照联合VCR组和干扰联合VCR组裸鼠的腹腔注射VCR 0.5 mg/kg,每周1次,连续4周。观察各组裸鼠的生存期。结果:流式细胞仪测得慢病毒对U937细胞的转染效率>90%,干扰组HOXA9的蛋白表达水平为46.56%±3.54%,较空白对照组和阴性对照组均下降(P<0.05)。干扰组细胞被阻滞于G0/G1期,其增殖明显受到抑制。慢病毒干扰HOXA9基因的表达联合VCR可显著延长裸鼠的生存期。结论:以慢病毒载体介导shRNA靶向沉默HOXA9基因表达,可明显抑制U937细胞在裸鼠体内外的增殖。
同源盒A9;RNA干扰;U937细胞;白血病
同源盒A9(homeoboxA9,HOXA9)基因位于人类7号染色体短臂(7p15-p14),其编码的转录因子对调节胚胎发育、细胞分化和机体造血起着至关重要的作用。80%的急性髓系白血病(acute myelocytic leukemia,AML)患者高表达同源盒A9(homebox A9,HOXA9)基因,且高表达HOXA9基因的患者预后较差[1]。U937细胞内t(10;11)(p13;q14)基因突变使AF10基因与CALM基因融合[2],产生白血病的癌基因CALMAF10,有研究表明HOXA9基因与癌基因CALMAF10有关,CALM-AF10阳性的T淋巴母细胞淋巴瘤患者往往有HOXA9的表达[3]。高表达CALM-AF10基因的白血病小鼠造血组织内HOXA9基因的表达水平较高,提示HOXA9基因可能是CALM-AF10基因的下游靶基因[4]。目前,HOXA9基因在CALM-AF10基因相关白血病中的作用尚不明确。本研究探讨慢病毒载体介导shRNA靶向沉默HOXA9基因对U937细胞在裸鼠体内外增殖的影响。
1 材料和方法
1.1 细胞株和试剂
靶向沉默HOXA9基因的慢病毒载体(本课题组前期实验构建成功,针对HOXA9基因的siRNA序列为3’-AAGGAGTTTCTGTTCAATATG-5’,本实验所用慢病毒为3质粒系统包装而成,即干扰质粒pGC-shHOXA9-GFP-LV、辅助质粒pHelper 1.0及pHelper 2.0),阴性对照慢病毒(pGC-GFP-lentivirus)购自上海吉凯基因技术有限公司;人髓性白血病细胞株U937购自中国科学院细胞库;兔抗人HOXA9多克隆抗体、二甲基亚砜(DMSO)和聚凝胺购自美国Sigma公司,兔抗人α-tubulin单克隆抗体购自美国Cell Signaling Technology公司,辣根过氧化物酶标记山羊抗兔二抗为联科生物进口分装;RPMI-1640培养基购自美国Hyclone公司;GIBCO胎牛血清购自美国Invitrogen公司;MTT粉为美国Amresco公司进口分装;核蛋白和细胞质蛋白提取试剂盒购自南京凯基生物科技发展有限公司。
1.2 实验动物
4~6周龄裸鼠(BALB/cA-nu)购于北京华阜康生物科技股份有限公司[实验动物生产许可证号:SCXK(京)2009-0007],雌性,体质量15~18 g,饲养于SPF级动物房,符合伦理委员会认可标准。
1.3 细胞分组及处理
将U937细胞置于含10%胎牛血清、青霉素和链霉素各100 U/mL的RPMI-1640培养基中,37 ℃、CO2体积分数为5%的培养箱中培养,2~3 d传代1次,细胞生长状态良好,取对数生长期的细胞进行实验。取对数生长期的U937细胞均匀接种在24孔板中,每孔细胞数约为1.5×105,分为3组:空白对照组、阴性对照组、干扰组。每组均加入终浓度为8 μg/mL的聚凝胺,分别在干扰组、阴性对照组细胞中加入干扰慢病毒和阴性对照慢病毒(MOI=10),空白对照组加等量磷酸盐缓冲液(PBS),培养24 h后更换新鲜的培养液继续培养,慢病毒转染5 d后进行以下相关检测。
1.3.1 流式细胞术检测慢病毒对白血病细胞的转染效率
在荧光显微镜下观察空白对照组、阴性对照组和干扰组细胞GFP表达情况并照相,收集3组细胞,PBS洗涤2次,30 min内用流式细胞仪测定GFP阳性细胞率,转染效率达到80%以上时进行后续实验。
1.3.2 蛋白质印迹法(Western blot)检测HOXA9蛋白的表达
慢病毒转染5 d后收集空白对照组、阴性对照组和干扰组细胞,用冷PBS洗涤2次,根据细胞质蛋白和细胞核蛋白提取试剂盒说明书,依次加入bufferA、bufferB、bufferC,裂解细胞膜和细胞核,16 000×g离心10 min,收集上清液即得细胞质蛋白和细胞核蛋白并混匀,取少量用BCA法测蛋白浓度,其余加入5×SDS-PAGE上样缓冲液煮沸5 min,-80 ℃保存。取等量蛋白,SDS-PAGE电泳后将蛋白转移到PVDF膜上,用含5%脱脂奶粉的TBST封闭液封闭2 h,经1×TBST充分漂洗(10 min×3次),加兔抗人HOXA9多克隆抗体(稀释度为1/300),4 ℃温育过夜,充分漂洗后加山羊抗兔二抗(稀释度为1/2 400),室温温育1 h,充分漂洗后化学发光法显色。用α-tublin做内参重复以上步骤。采用Gel-Pro analyzer软件分析图像,以HOXA9/ α-tubulin比值表示目的基因蛋白的相对表达水平。
1.3.3 细胞生长曲线
分别于慢病毒转染U937细胞0、3、5、7 d后计数空白对照组、阴性对照组和干扰组细胞数量,每组细胞计数3次取均值,本实验独立重复3次。
1.3.4 细胞周期检测
慢病毒转染U937细胞5 d后,分别收集空白对照组、阴性对照组、干扰组细胞,每管3 mL (约含4×106个细胞) ,PBS洗涤3次,离心,弃上清液,每组细胞沉淀加入70%冰乙醇1 mL并重悬,4 ℃固定过夜,离心弃乙醇,PBS洗涤并重悬,加入RNaseA(终浓度为50 mg/L),37 ℃水中温浴40 min,加入碘化丙啶(PI)50 μL,混匀,4 ℃避光放置60 min,尼龙网过滤,流式细胞仪检测。每组样本独立重复3次。
1.4 建立AML裸鼠移植瘤模型
将32只裸鼠随机分为4组:阴性对照组、干扰组、阴性对照联合VCR组、干扰联合VCR组,每组8只,每只裸鼠腹腔注射环磷酰胺100 mg/kg,连续4 d[5]。第5天分别取阴性对照组和干扰组U937细胞,经荧光激活细胞分选技术(fluorescence-activated cell sorting,FACS)分选出带有绿色荧光的细胞,PBS洗涤2次并重悬,调整细胞密度为2.5×107/mL,取200 μL细胞悬浮液(约5×106个细胞)接种到裸鼠腹腔,1周后向阴性对照联合VCR组和干扰联合VCR组裸鼠的腹腔注射VCR 0.5 mg/kg,每周1次,连续4周[6]。每2 d称裸鼠体质量,观察裸鼠生存期。
1.5 统计学处理
数据采用SPSS 13.0统计学软件分析,数据均以x±s 表示。多组间比较采用单因素方差分析,多个均数间两两比较采用LSD(方差齐)或Tamhane检验(方差不齐);生存期比较用Logrank检验。P<0.05为差异有统计学意义。
2 结 果
2.1 慢病毒对U937细胞转染效率
慢病毒转染U937细胞(MOI=10)5 d后GFP阳性细胞率约为90%,倒置荧光显微镜下可见GFP阳性细胞满视野,可满足实验要求(图1)。
2.2 慢病毒对HOXA9基因的敲减效率
Western blot实验结果显示,干扰组HOXA9蛋白表达水平为46.56%±3.54%,较阴性对照组、空白对照组显著下降,差异有统计学意义(F=45.01,P=0.000),阴性对照组和空白对照组之间HOXA9蛋白表达水平差异无统计学意义(P=1.000,图2)。

图 1 慢病毒感染5 d后的U937细胞Fig. 1 U937 cells 5 days after lentivirus transfection (×200)

图 2 Western Blot法检测各组HOXA9 蛋白表达水平Fig. 2 HOXA9 protein expression level detected by Western blot
2.3 细胞生长曲线
慢病毒转染U937细胞3 d后,干扰组细胞增殖速度变慢,细胞数量少于空白对照组和阴性对照组,转染7 d后,干扰组细胞数量较空白对照组和阴性对照组明显减少,差异有统计学意义(F=56.005,P=0.000),空白对照组和阴性对照组之间差异无统计学意义(P=0.307,图3)。
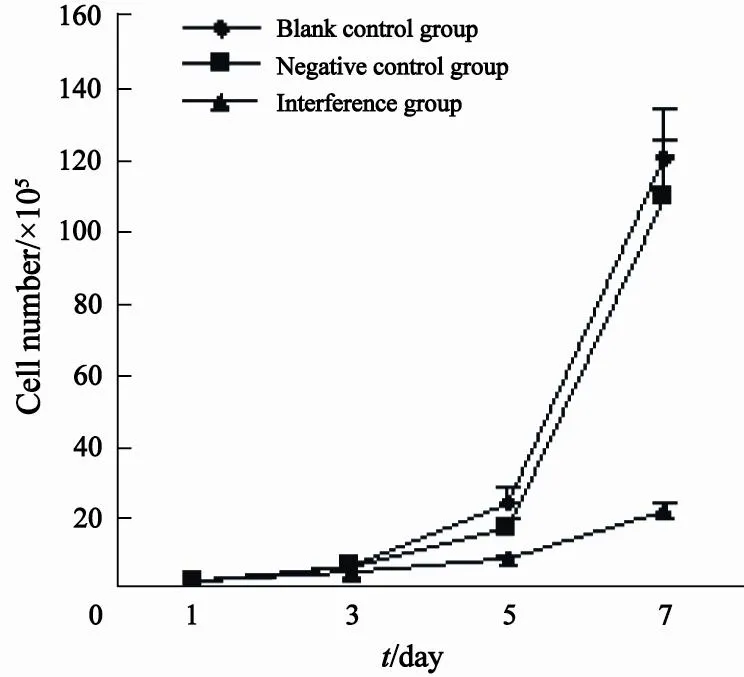
图 3 慢病毒转染后各组细胞周期分布Fig. 3 Cell growth curve of each group after lentivirus transfection
2.4 FCM检测细胞周期
干扰组U937细胞处于G0/G1期的细胞百分比高于阴性对照组和空白对照组,而S期和G2/M期的细胞百分比明显减少,差异有统计学意义(G0/G1期:F=65.55,P=0.000;S期:F=9.003,P=0.016;G2/M期:F=35.91,P=0.000),阴性对照组和空白对照组之间差异无统计学意义(P>0.05)。这表明运用RNA干扰技术下调HOXA9基因在U937细胞内的表达水平能阻止细胞从G0/G1期向S期的转变过程,细胞周期停滞于G0/G1期,G2/M期的细胞比例降低,减少DNA合成,抑制细胞增殖(表1,图4)。
2.5 裸鼠生存期
腹腔接种U937细胞3周后,阴性对照组及干扰组裸鼠均出现腹水,阴性对照组腹水较干扰组严重,两组体质量下降均不明显,阴性对照组和干扰组裸鼠生存期分别为(18.63±3.25)d和(26.25±3.91)d,差异有统计学意义(χ2=12.68,P=0.000)。提示下调HOXA9的表达水平可抑制U937细胞在裸鼠体内的增殖,延长裸鼠的生存期。阴性对照联合VCR组和干扰联合VCR组的腹水不明显,生存期分别为(36.00±3.38)d和(40.63±6.86)d,差异有统计学意义(χ2=4.43,P=0.035),说明干扰组的化疗效果好于阴性对照组,HOXA9基因的表达水平降低可增强U937细胞对化疗药物的敏感性(图5)。

表 1 慢病毒转染5 d后3组细胞周期分布Tab. 1 Cell cycle distribution of 3 groups 5 days after lentivirus transfection
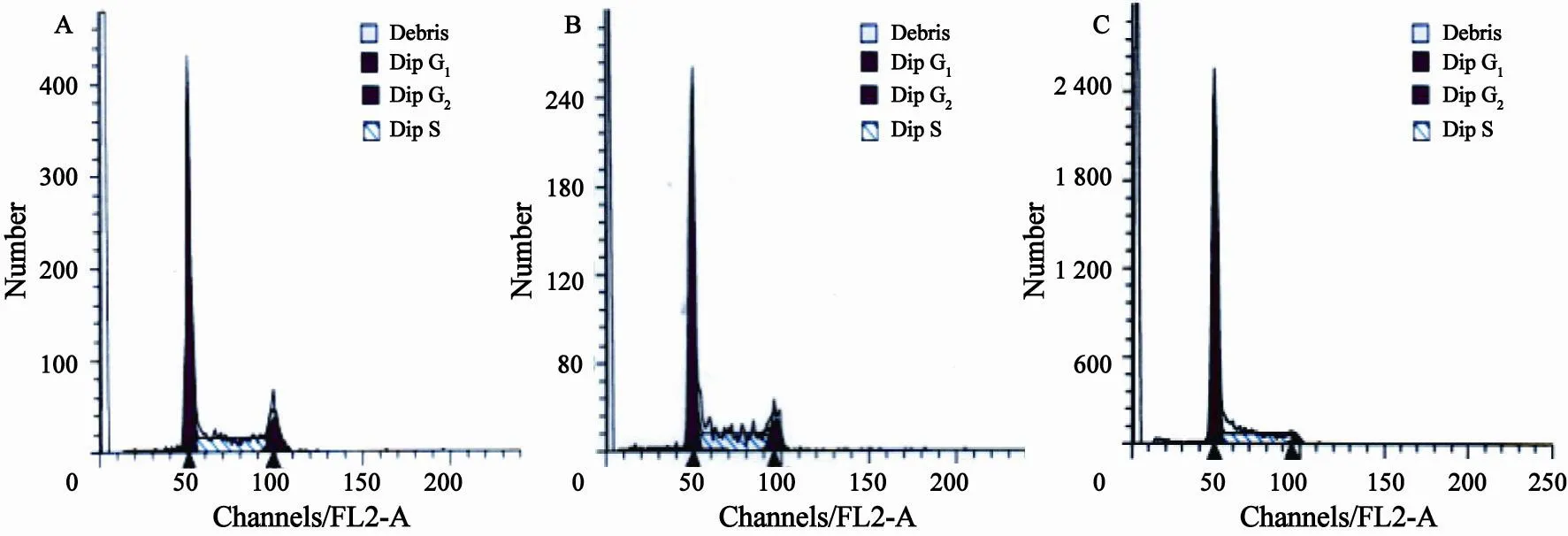
图 4 慢病毒转染5 d后各组细胞周期分布Fig. 4 Cell cycle distribution of three groups five days after lentivirus transfection
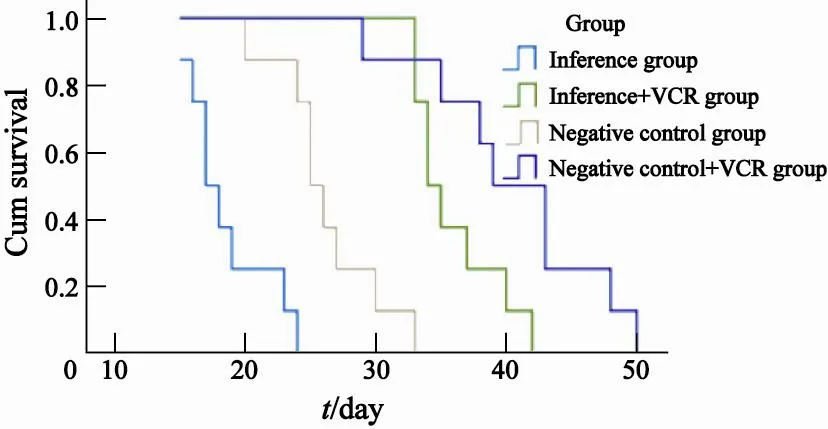
图 5 各组裸鼠生存曲线Fig. 5 Survival curves of nude mice
3 讨 论
白血病的发病机制与基因异常密切相关。急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和AML患者体内均存在CALM-AF10基因[2,7-9],然而仅有CALM-AF10基因高表达的白血病的发病周期较长,且症状不典型。混合谱系白血病(mixed lineage leukemia,MLL)基因是急性儿童白血病和治疗相关白血病的常见突变基因,存在MLL基因的患者预后不佳,Faber等[10]研究发现沉默HOXA9基因的表达,MLL基因阳性细胞在小鼠体内外的增殖受到抑制。BCR-ABL融合基因是慢性粒细胞白血病(chronic myeloid leukemia,CML)的典型基因突变,对CML的进展起促进作用,Tedeschi等[11]研究发现在CML患者体内均有HOXA9基因和BCR-ABL共同表达,提示HOXA9基因与BCR-ABL基因可能存在调节与被调节的关系,HOXA9基因对BCR-ABL基因导致的CML起协同作用。HOXA9基因可与其他基因发生融合,如NUP98-HOXA9基因可使斑马鱼发生骨髓增生性肿瘤[12]。以上提示HOXA9基因可通过与其他突变基因联合或自身发生突变促进白血病的发生,在白血病的发病机制中起了较为重要的作用。运用RNA干扰技术干扰HOXA9的表达可能会在白血病的治疗上取得突破性的进展。
本研究以慢病毒作为shRNA的表达载体,在体外干扰HOXA9基因的表达,发现U937细胞正常增殖周期受到影响,大部分细胞被阻滞于G0/G1期,DNA合成减少、有丝分裂减慢;细胞生长曲线可以明显看出干扰组U937细胞增殖速度慢于空白对照组和阴性对照组,下调HOXA9基因的表达水平使U937细胞体外的增殖受到抑制。Orlovsky等[13]沉默RS4;11细胞(前B细胞白血病细胞株)HOXA9基因后,RS4;11细胞从G0/G1期向S期的转变过程受阻,与阴性对照组细胞相比,G0/G1期细胞增加,S期细胞减少,细胞增殖同样受到抑制,与本研究结果一致。HOXA9基因参与细胞周期调控的具体机制尚不明确,有待进一步研究。
动物体内实验结果显示,干扰组较阴性对照组的生存期延长,在联合VCR的情况下干扰组较阴性对照组的生存期也得到延长,差异均有统计学意义(P<0.05)。这提示化疗前后运用RNA干扰技术下调HOXA9基因的表达水平均可延长小鼠的生存期,干扰联合VCR组小鼠的生存期最长,效果最好,下调HOXA9基因的表达水平有助于增强U937细胞对VCR的敏感性。Faber等[10]发现沉默HOXA9基因后,白血病细胞在免疫缺陷小鼠体内的增殖受到抑制,数量明显少于对照组,与本研究观察的时间点不同,但结果较一致,即沉默HOXA9基因可抑制白血病细胞在小鼠体内的增殖。
总之,HOXA9基因在白血病的发病机制中发挥一定的作用,下调HOXA9基因的表达水平后,U937细胞在小鼠体内外的增殖明显受到抑制,亦可增强白血病细胞对化疗药物的敏感性,为CALM-AF10和MLL基因突变的白血病患者提供更加有效的治疗措施。
[1] GOLUB T R, SLONIM D K, TAMAYO P, et al. Molecular classification of cancer: class discovery and class prediction by gene expression monitoring[J]. Science, 1999, 286(5439): 531-537.
[2] DREYLING M H, MARTINEZ-CLIMENT J A, ZHENG M, et al. The t(10;11)(p13;q14) in the U937 cell line results in the fusion of the AF10 gene and CALM, encoding a new member of the AP-3 clathrin assembly protein family[J]. Proc Natl Acad Sci U S A, 1996, 93(10): 4804-4809.
[3] BALEYDIER F, DECOUVELAERE A V, BERGERON J, et al. T cell receptor genotyping and HOXA/TLX1 expression define three T lymphoblastic lymphoma subsets which might affect clinical outcome[J]. Clin Cancer Res, 2008, 14(3): 692-700.
[4] NOVAK R L, HARPER D P, CAUDELL D, et al. Gene expression profiling and candidate gene resequencing identifies pathways and mutations important for malignant transformation caused by leukemogenic fusion genes[J]. Exp Hematol, 2012, 40(12): 1016-1027.
[5] TAN K B, LING L U, BUNTE R M, et al. In vivo efficacy of a novel liposomal formulation of safingol in the treatment of acute myeloid leukemia[J]. J Control Release, 2011, 160(2): 290-298.
[6] LIEM N L, PAPA R A, MILROSS C G, et al. Characterization of childhood acute lymphoblastic leukemia xenograft models for the preclinical evaluation of new therapies[J]. Blood, 2004, 103(10): 3905-3914.
[7] BOHLANDER S K, MUSCHINSKY V, SCHRADER K, et al. Molecular analysis of the CALM/AF10 fusion: identical rearrangements in acute myeloid leukemia, acute lymphoblastic leukemia and malignant lymphoma patients[J]. Leukemia, 2000, 14(1): 93-99.
[8] KOBAYASHI H, HOSODA F, MASEKI N, et al. Hematologic malignancies with the t(10;11) (p13;q21)have the same molecular event and a variety of morphologic or immunologic phenotypes[J]. Genes Chromosomes Cancer, 1997, 20(3): 253-259.
[9] CAUDELL D, ZHANG Z, CHUNG Y J, et al. Expression of a CALM-AF10 fusion gene leads to Hoxa cluster over expression and acute leukemia in transgenic mice[J]. Cancer Res, 2007, 67(17): 8022-8031.
[10] FABER J, KRIVTSOV A V, STUBBS M C, et al. HOXA9 is required for survival in human MLL-rearranged acute leukemias[J]. Blood, 2009, 113(11): 2375-2385.
[11] TEDESCHI F A, CARDOZO M A, VALENTINI R, et al. Coexpression of HoxA9 and bcr-abl genes in chronic myeloid leukemia[J]. Leuk Lymphoma, 2010, 51(5): 892-896.
[12] FORRESTER A M, GRABHER C, MCBRIDE E R, et al. NUP98-HOXA9-transgenic zebrafish develop a myeloproliferative neoplasm and provide new insight into mechanisms of myeloid leukaemogenesis[J]. Br J Haematol, 2011, 155(2): 167-181.
[13] ORLOVSKY K, KALINKOVICH A, ROZOVSKAIA T, et al. Down-regulation of homeobox genes MEIS1 and HOXA in MLL-rearranged acute leukemia impairs engraftment and reduces proliferation[J]. Proc Natl Acad Sci USA, 2011, 108(19): 7956-7961.
Effects of RNA interference targeting HOXA9 on the proliferation of U937 cells in vitro and in vivo
JIA Xiu-hong, ZHANG Yan-jun, LI Jian-chang (Department of Pediatrics, Affiliated Hospital of Binzhou Medical University, Binzhou Shandong 256603, China)
JIA Xiu-hong E-mail: jiaxiuhong001@163.com
Background and purpose:In most acute myeloid leukemia(AML) patients, HOXA9 was highly expressed, the high expression of HOXA9 is related to the poor prognosis of patients. This study aimed to investigate the effects of lentivirus-mediated short hairpin RNA targeting HOXA9 gene on the proliferation of U937 cells in vitro and in vivo. Methods:U937 cells were divided into interference group, negative control group and blank control group. The infection efficiency of lentivirus for U937 was detected by flow cytometry, the expression of HOXA10 at protein level was detected by Western blot. Cell cycle was assayed by FCM. Cell growth curves were obtained by calculating the cell number. In vitro experiments were performed using nude mice injected intraperitoneally with the interference group U937 cell(or negative group U937 cell) and subsequently treated with VCR or PBS intraperitoneally. Results:The ratio of GFP positive cells was up to 90%; the levels of HOXA9 protein in interference group were decreased by 54.44% compared with the blank control group(P<0.05). Interference group cells were blocked in G0/G1and their proliferation was significantly inhibited. In vivo: down-regulated expression of the HOXA9 gene combined with VCR could significantly prolong the survival time of nude mice. Conclusion:Lentiviral vector mediated shRNA can steadily reduce the expression level of HOXA9 gene, and then inhibits the proliferation of U937 cells in nude mice.
HomeoboxA9; RNA interference; U937 cells; Leukemia
R733.71
:A
:1007-3639(2013)02-0120-06
2012-09-17
2012-11-12)
贾秀红 E-mail:jiaxiuhong001@163.com
DOI: 10.3969/j.issn.1007-3969.2013.02.007

