血脂康对肥胖相关性肾病大鼠脂联素、炎症因子及尿蛋白的影响
马文玲 浙江中医药大学 杭州 310053
赵 湘 沈晓刚 沈 维 姚 炯 浙江省人民医院
·论 著·
血脂康对肥胖相关性肾病大鼠脂联素、炎症因子及尿蛋白的影响
马文玲 浙江中医药大学 杭州 310053
赵 湘 沈晓刚 沈 维 姚 炯 浙江省人民医院
目的:观察血脂康对肥胖相关性肾病(ORG)大鼠脂联素、炎症因子及尿蛋白的影响,探讨血脂康对ORG大鼠肾脏保护作用机制。方法:雄性Wistar大鼠30只,随机分为正常组、模型组和血脂康组,每组10只,分别给予普通饲料、高脂饲料、高脂饲料+血脂康喂养12周,观察各组大鼠血清脂联素、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、24h尿蛋白水平及肾脏病理变化。结果:12周后,模型组大鼠血清脂联素水平降低,IL-6水平升高,尿蛋白排泄增加,与正常组比较,差异有统计学意义(P均<0.01),TNF-α水平虽有升高,但与正常组比较差异无统计学意义(P>0.05),肾脏病理损害明显。血脂康组脂联素水平升高,IL-6水平下降,尿蛋白减少,与模型组比较,差异有统计学意义(P均<0.01),肾脏病理损害减轻。结论:血脂康可下调肥胖相关性肾病大鼠炎症因子IL-6表达,升高抗炎因子脂联素水平,减轻炎症反应,从而发挥肾脏保护作用。
大鼠 肥胖相关性肾病 脂联素 炎症因子 血脂康
肥胖作为一种特殊的病理生理状态,通过一系列代谢机制及血流动力学导致肾脏损害,炎症因子及细胞因子的参与在其中起重要作用。脂联素是由脂肪组织分泌的细胞因子,不仅与肥胖、胰岛素抵抗、2型糖尿病有关,还具有抗炎、抗动脉粥样硬化等作用。肥胖患者血浆中促炎细胞因子如白介素-6(Interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、C反应蛋白(C-reactive protein,CRP)等增加,抗炎细胞因子脂联素水平降低[1-3]。本研究通过观察血脂康对肥胖相关性肾病(obesity related glomerulopathy,ORG)大鼠脂联素、IL-6、TNF-α水平、尿蛋白及肾脏病理的影响,探讨其对肾脏的保护作用机制。
1 实验材料
1.1动 物 雄性Wistar大鼠30只,体质量(150± 10g),浙江中医药大学动物中心提供 [许可证号:SCXK(沪)2008-0016],饲养于浙江中医药大学动物中心,单笼饲养,每笼5只,环境温度(20±2)℃,湿度55%~65%,自由摄食、饮水。普通饲料由南京安立默科技有限公司提供;高脂饲料(配方:普通饲料70.75g、蛋黄粉10g、猪油8g、白沙糖10g、胆固醇1g、胆酸钠0.25g)由浙江省医学科学院提供。
1.2药物及试剂 血脂康胶囊(批号20090801,规格:每粒0.3g,北京北大维信生物科技有限公司,参照文献[4]换算大鼠每天所需剂量为240mg/kg,临用时以生理盐水溶解,浓度24mg/mL)。IL-6、TNF-α、脂联素试剂盒(Lot:20100711,美国R&D Systems公司),Elx50洗板机和Elx800酶标仪(美国BIO-TEK公司),AU5400生化仪以及原装试剂盒(日本Olympus公司),石蜡切片机(LEICA 35,德国),显微镜摄像机(OLYMPUS BX20型,日本),BMJⅢ型包埋机及冷冻台(中国江苏),GNP-9080型隔水式恒温培养箱(中国上海),透射电镜(Hitachi型号H7650,日本)。
2 实验方法
2.1分组及造模 大鼠适应性饲养7天后,随机分为正常对照组、模型组和血脂康组,每组10只。正常组喂养普通饲料,同时予生理盐水灌胃;模型组喂养高脂饲料,同时予生理盐水灌胃;血脂康组喂养高脂饲料,并予血脂康混悬液(根据体质量调整给药剂量,并不固定,例如体质量200mg大鼠,每天灌胃2mL,300mg大鼠每天灌胃3mL)灌胃,每天1次;每周称重,根据体质量调整给药剂量,共饲养12周。
2.2观察指标
2.2.1大体观察 包括精神状态、体质量、体长、大小便、食欲及毛发光亮度等。记录大鼠体质量及体长,计算Lee’s指数=体质量(g)1/3×103/体长(cm)。
2.2.224h尿蛋白测定 12周末,将大鼠置于代谢笼内,禁食不禁水24h,留取24h尿液,全自动生化分析仪测定24h尿蛋白(mg/24h)。
2.2.3脂联素、IL-6及TNF-α测定 10%的水合氯醛腹腔麻醉,经腹主动脉取血,分离血清,采用ELISA法测定脂联素、IL-6及TNF-α含量。
2.3肾脏组织病理学检查
2.3.1光镜观察 12周末处死大鼠,将左右肾脏去包膜称重。肾组织常规处理后,经苏木素-伊红(HE)、过碘酸雪夫(PAS)染色,光镜下观察肾小球病变。PAS染色切片数码相机拍摄图像(×200),随机选取含血管极和(或)尿极的最大肾小球区域拍摄图像,用Image-Pro Plus 5.0图像系统测量该肾小球相互垂直的两个最大直径,每张组织切片至少检测5个肾小球,取平均值。
2.3.2超微结构观察 每只大鼠肾组织进行电镜包埋,1μm超薄切片染色后电镜下观察2~3个肾小球,在1 5000倍电子显微镜下拍摄肾小球基底膜(GBM),每个肾小球拍摄2~3张照片,扫描入计算机后,用Image-Pro Plus 5.0图像分析系统,以电镜照片给定的标尺为标准,测量GBM厚度。
2.4统计学方法 数据用SPSS16.0软件进行统计处理,计量资料以() 表示,多组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
3 实验结果
3.1一般情况 正常组大鼠表现为体质量自然增加,反应灵敏,活动敏捷,毛发密集而有光泽,紧贴皮肤,鼻、唇湿润清洁,眼睛明亮。模型组大鼠形体肥胖,行动缓慢,反应迟钝,毛发干枯、蓬松且易脱落。血脂康组行为表现、体质量和营养状况等方面与模型组相比有一定改善。
3.2各组大鼠体质量、体长、Lee’s指数及24h尿蛋白水平比较 饲养至12周时模型组大鼠比正常组平均体质量增高约20.84%,符合大鼠肥胖标准[5]。12周末,模型组大鼠体质量、体长、Lee's指数及24h尿蛋白较正常组明显增加(P均<0.01);与模型组比较,血脂康组大鼠体质量、体长及Lee’s指数降低,24h尿蛋白排泄减少,差异有统计学意义(P均<0.01),见表1。
3.3各组脂联素、IL-6、TNF-α水平比较 与正常组比较,模型组IL-6水平明显升高(P<0.01),脂联素水平降低(P<0.01),TNF-α水平虽有升高,但差异无统计学意义(P>0.05);与模型组比较,血脂康组脂联素水平升高(P<0.01),IL-6水平降低(P<0.01),TNF-α水平虽有降低,但差异无统计学意义(P>0.05),见表2。
表1 各组大鼠体质量、体长、Lee's指数及24h尿蛋白水平比较()

表1 各组大鼠体质量、体长、Lee's指数及24h尿蛋白水平比较()
注:与正常组比较,△P<0.01;与模型组比较,*P<0.01
组别正常组模型组血脂康组n/只10 10 10体质量/g 343.10±8.67 414.60±9.62△350.54±1.70*体长/cm 21.86±0.39 22.52±0.38△21.95±0.06* Lee's指数320.32±4.47 331.13±3.73△321.29±0.50*尿蛋白/(mg/24h)3.66±0.23 4.53±0.79△3.67±0.07*
表2 各组脂联素、IL-6、TNF-α水平比较()
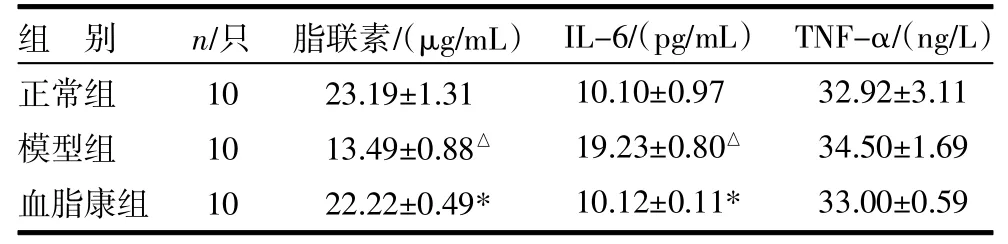
表2 各组脂联素、IL-6、TNF-α水平比较()
注:与正常组比较,△P<0.01;与模型组比较,*P<0.01
3.4肾脏病理观察 光镜下模型组肾小球体积增大,肾小球细胞数目增多,系膜区轻度增宽,可见系膜细胞增生,系膜基质少量增多,毛细血管扩张充血。肾小管上皮细胞肿胀变性,部分间质可见炎性细胞浸润。用Image-Pro Plus 5.0图像分析系统,测量模型组肾小球内径增加,较正常组差异有统计学意义(P<0.05),血脂康组肾小球内径较模型组减小(P<0.05),见表3,图1~3(封二)。电镜下正常组肾小球基底膜未见明显增厚,细胞足突形态结构正常;模型组肾小球基底膜较正常组显著增厚(P<0.01),足突明显融合,“窗孔”部分消失。血脂康组足突未见明显融合,肾小球基底膜厚度与模型组比较降低明显(P<0.01),见表3,图4~6(封二)。
表3 各组大鼠肾小球内径、肾小球基底膜比较()

表3 各组大鼠肾小球内径、肾小球基底膜比较()
注:与正常组比较,△P<0.01;与模型组比较,*P<0.01
10 10 10正常组模型组血脂康组119.53±3.39 134.19±7.35△121.48±2.01* 140.72±3.69 288.66±13.41△161.15±14.68*
4 讨论
肥胖被认为是一种慢性低度炎症,1974年Weisinger等首次报道严重肥胖可导致大量蛋白尿。1975年Cohen首先提出肥胖相关性肾小球疾病(ORG),是一种以肥胖、蛋白尿、不伴水肿和血白蛋白正常为特点的临床综合征,主要病理特点为肾小球肥大和局灶性节段性肾小球硬化。肥胖导致肾损伤的作用机制主要有肾素血管紧张素系统的激活、血流动力学的改变、脂质代谢紊乱及炎症因子的参与等[6]。肥胖患者血浆中炎症因子增加,如肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、C反应蛋白(CRP)、抵抗素等,抗炎因子如脂联素等减少。
IL-6可增加内皮细胞和血管平滑肌细胞黏附分子的表达,激活局部RAS(renin-angiotensin system,RAS)系统,引起细胞损伤;同时可增加转化生长因子-β1(transforming growth factor-β1,TGF-β1)的表达而促进肾脏纤维化。TNF-α与其受体的结合可导致巨噬细胞浸润,核转录因子-κB(nuclear transcription fator-κB,NF-κB)及TGF-β1表达上调,从而引起肾脏上皮细胞、系膜细胞和内皮细胞的损害[7]。曹竞文等[8]研究发现,TNF-α可促进脂肪细胞中IL-6 mRNA的表达,并呈时间依赖性抑制脂联素mRNA及PPAR-γmRNA表达,而PPAR-γ是脂联素最主要的转录因子。TNF-α可通过NF-κB依赖的机制减少klotho表达而引起肾脏损伤[9]。
脂联素是由脂肪组织分泌的特异性血浆蛋白。动物实验及临床研究均提示脂联素与肥胖、胰岛素抵抗(insulin resistance,IR)、2型糖尿病、动脉粥样硬化、代谢综合征等都有一定相关性。研究显示,肥胖患者血浆脂联素水平明显降低,体质量下降后脂联素水平上升,提示可能存在一种负反馈机制下调了脂肪细胞对脂联素的表达分泌。脂联素可抑制NF-κB的活性,减少脂肪细胞中IL-6、TNF-α的分泌,增加脂肪细胞PPAR-γ2的表达,从而抑制炎症反应[10]。体外试验发现脂联素可逆转TNF-α介导的外周单核细胞黏附所致的内皮细胞损伤,从而抑制炎症引起的血管损伤[11]。Sharma等[12]研究发现,脂联素可减少脂联素基因敲除小鼠的尿蛋白,且对足细胞有保护作用。脂联素可抑制系膜细胞中高糖诱导的活性氧自由基的产生,促进内皮一氧化氮合酶的产生,从而对系膜细胞内起保护作用[13]。肥胖患者脂肪细胞增多,炎症因子如IL-6、TNF-α等分泌增多,脂联素水平下降,两者相互作用,加剧炎症反应,加重细胞损伤。
血脂康是由中药红曲精炼而成的天然他汀类药物,主要成分为洛伐他汀,还含有多种不饱和脂肪酸和必需氨基酸。他汀类降脂药可调节和保护血管内皮细胞功能,直接抑制肾小球系膜细胞增殖,抑制细胞外基质及炎性因子的分泌,减少肾小球硬化的发生;还可直接抑制近端肾小管上皮细胞由受体介导的对白蛋白的内吞重吸收作用,减少肾间质纤维化的发生[14-15]。研究[16]发现,红曲中洛伐他汀的溶解速度及口服生物利用度高于洛伐他汀片剂,提示红曲药用效果更好,而红曲提取物血脂康的作用有过之而无不及。在非酒精性脂肪肝和高脂血症患者中,血脂康可显著降低血清TNF-α及IL-6水平,提示血脂康有抗炎作用[17]。
本实验中,模型组大鼠表现为体质量增加,尿蛋白增加,肾脏病理改变明显,提示肥胖相关性肾病大鼠模型复制成功。模型组大鼠炎症因子IL-6水平明显增加(P<0.01),TNF-α虽有增加,但差异无统计学意义(P>0.05),抗炎因子脂联素水平下降(P<0.01)。血脂康组IL-6明显低于模型组(P<0.01),脂联素水平升高(P<0.01),尿蛋白减少,肾脏病理损害减轻,提示血脂康可能通过降低炎症因子水平,增加抗炎因子水平,减轻炎症反应而对肥胖相关性肾病大鼠起到肾脏保护作用。
[1]Kern PA,Ranganathan S,Li C,et al.Adipose tissue tumor necrosis factor and interleukin-6 expression in human obesity and insulin resistance[J].Am J Physiol Endocrinol Metab,2001,280:E745-751.
[2]Visser M,Bouter LM,McQuillan GM,et al.Elevated C-reactive protein levels in overweight and obese adults[J]. Journal of the American Medical Association,1999,282(22):2131-2135.
[3] Engeli S,Feldpausch M,Gorzelniak K,et al.Association between adiponectin and mediators of inflammation in obese women[J].Diabetes,2003,52(4):942-947.
[4]黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[5]Chandler PC,Viana JB,Oswald KD,et al.Feeding response to melanocortin agonist predicts preference for and obesity from a high-fat diet[J].Physiol Behav,2005,85(2):221-230.
[6]Hunley TE,Ma LJ,Kon V.Scope and mechanisms of obesityrelated renal disease[J].Curr Opin Nephrol Hypertens. 2010,19(3):227-234.
[7]Wahba IM,Mak RH.Obesity and obesity-initiated metabolic syndrome:mechanistic links to chronic kidney disease[J].Clin J Am Soc Nephrol,2007,2(3):550-562.
[8]曹竞文,何庆,张明,等.肿瘤坏死因子-α对脂肪细胞脂联素和炎症因子mRNA表达的影响[J].天津医药,2010,38(5):401-404.
[9]Moreno JA,Izquierdo MC,Sanchez-Nino,MD,et al.The inflammatory cytokines TWEAK and TNF-α reduce renal klotho expression through NF-κB[J].Journal of the American Society Nephrology,2011,22(7):1315-1325.
[10]Ajuwon KM,Spurlock ME.Adiponectin inhibits LPS-induced NF-κB activation and IL-6 production and increases PPAR-γ2 expression in adipocytes[J].Am J Physiol Regul IntegrCompPhysiol,2005,288(5):R1220-R1225.
[11]Beige J,Heipmann K,Stumvoll M.et al.Paradoxical role for adiponectin in chronic renal diseases An example of reverse epidemiology[J].Expert Opin Ther Targets,2009,13(2):163-173.
[12]Sharma K,Ramachandrarao S,Qiu G,et al.Adiponectin regulates albuminuria and podocyte function in mice[J].J Clin Invest,2008,118(5):1645-1656.
[13]Yuan F,Li YN,Liu YH,et al.Adiponectin inhibits the generation of reactive oxygen species induced by high glucose and promotes endothelial NO synthase formation in human mesangial cells[J].Mol Med Rep,2012,6(2):449-453.
[14]Li H,Li X,Duan L,et al.Inhibition of lovastin on proliferation and expression of proinflammatory cytokines in cultured human glomerularme sangial cells[J].Chin Med J(Engl),2003,116(9):1366-1369.
[15]Verhulst AD,Haese PC,De Broe ME.Inhibitors of HMGCoA reductase reduce receptor-mediated endocy-tosis in human kidney proximal tubular cells[J].J AM Soc Nephrol,2004,15(9):2249-2257.
[16]Chen CH,Yang JC,Uang YS,et al.Improved dissolution rate and oral bioavailability of lovastatin in red yeast rice products[J].Int J Pharm,2013,444(1-2):18-24.
[17]Fan XF,Deng YQ,Ye L,et al.Effect of Xuezhikang Capsule on serum tumor necrosis factor-alpha and interleukin-6 in patients with nonalcoholic fatty liver disease and hyperlipidemia[J].Chin J Integr Med,2010,16(2):119-123.
Effects of Xuezhikang on Adiponectin,Inflammatory Cytokines and Proteinuria in Obesity-Related Glomerulopathy Rats
MA Wenling,ZHAO Xiang,SHEN Xiaogang,etal.Zhejiang ChineseMedicalUniversity,Hangzhou(310053),China
Objective:To observe the effects of Xuezhikang on adiponectin,inflammatory cytokines,and 24 h urinary protein in obesity-related glomerulopathy(ORG)rats,in order to investigate the renal protective mechanism of Xuezhikang on ORG rats.Methods:Thirty male Wistar rats were randomly divided into normal group,model group,and Xuezhikang group,10 rats in each group.Normal group was fed on normal diet,model group was fed on high fat diet,and Xuezhikang group was fed with both high fat diet and Xuezhikang,totally for 12 weeks.The followings were observed:serum adiponectin,interleukin-6(IL-6),tumor necrosis factor-α(TNF-α),24 h urinary protein,and renal pathological alterations.Results:After 12 weeks,compared with the normal group,the model rats'serum adiponectin reduced,and IL-6 and 24 h urinary protein increased,all with statistically significant differences(P<0.01),but TNF-α elevated without a significant difference between the two groups(P>0.05);and the alteration of renal pathology in the model group was more tremendous than that in the normal group.Compared with the model group,Xuezhikang group had higher adiponectin,lower IL-6 and 24 h urinary protein(P<0.01),and renal pathological damage mitigated.Conclusion:Xueazhikang may play a renal protective effect on ORG rats by downregulating the expression of inflammatory cytokines such as IL-6,and increasing anti-inflammatory cytokines levels like adiponectin.
rats obesity related glomerulopathy adiponectin inflammtary cytokines Xuezhikang
2013-03-05
浙江省中医药科技计划项目(No:2009CA048)
赵湘,Tel:13335885196;E-mail:13335885196@163.com

