HMD急性毒性实验
张 燕
(新疆实验动物研究中心,乌鲁木齐 830002)
药物作为一种特殊商品,由于其和人类的健康安全息息相关,国家制定了相应的药物安全性评价标准以确保新药的研发过程在标准、系统的监管下科学的进行。国家食品药品监督管理局(SFDA)于2003年正式发布《药物非临床研究质量管理规范》[1],规范中明确规定在新药的研发过程必须包括安全性评价内容主要涉及到药品临床前试验研究(应用药品非临床安全性研究质量管理规范GLP,Good Laboratory Practice)、临床小样本人体试验研究(应用药品临床研究质量管理规范GCP,Good Clinical Practice)、新药上市后的不良反应监测(国家监管)等。GLP是国际通用的临床前药品安全性评价规范标准[2],我国在1999年颁发了我国的《药物非临床研究质量管理规范》(GLP)[3]。2007年SFDA经修订发布了最新的《GLP认证管理办法》[4]。非临床安全性评价包括安全性药理(一般药理)、单次给药毒性(急性毒性)、重复给药毒性(长期毒性)、遗传毒性、生殖毒性、致癌性、依赖性、特殊毒性(过敏性、局部刺激性、溶血性)等方面的评价。本课题对天然来源的、具有抗肿瘤活性的有效成分作为先导化合物而合成新型β咔啉衍生物药物(代号:HMD)进行急性毒性研究。本次实验以经静脉注射给药的方式在小鼠上进行HMD急性毒性实验,得出HMD药物急性毒性的基本参考数据,为HMD应用于肝癌裸鼠移植瘤模型的抑瘤实验提供基本数据。
1 材料与方法
1.1 环境设施
新疆实验动物研究中心SPF屏障实验室(SYXK(新)2011-0002),温度变化范围为20~23℃,湿度变化范围为40%~50%,室内照明设置为12L:12D(光照时间为10:00~22:00,黑暗时间为22:00~10:00)。
1.2 实验动物与药物
新疆实验动物研究中心提供4~6周龄(18~22 g)昆明小鼠雌雄各半75只(SCXK(新)2011-0001)。动物饲料为本中心自产经Co60放射灭菌处理的全价小鼠饲料,饮水通过实验动物饮用水处理器(杭州永洁达净化科技有限公司)处理后加盐酸酸化,饮用水pH值为3.0~3.5,每周更换1~2 次水瓶和笼具。
药物HMD,呈白色粉末状,室温下水溶性好,溶液透明。
1.3 实验方法
1.3.1 预试验[5]
将60只雌雄各半昆明小鼠,雌鼠雄鼠分别随机分为六组,每组5只。以100 mg/kg、50 mg/kg、25 mg/kg、12.5 mg/kg、6.25 mg/kg、3.13 mg/kg HMD浓度注射体积0.2ml/20g小鼠体重单次静脉注射给药,观察3日内昆明小鼠死亡反应,预测HMD小鼠急毒反应的各项剂量值。
1.3.2 药物HMD半数致死剂量(LD50)的测定
根据急毒预实验测定剂量结果,确定出急毒试验的最小致死剂量(LD100)和最大耐受量(LD0),查照分组数与剂量比值表[6]确定受试剂量组及剂量梯度。取KM小鼠分组后按设计剂量浓度以静脉注射给药1次,注射体积0.2 ml/20g小鼠体重。连续观察期为14 d,分别记录每组动物的外观、体征(呼吸、运动、惊厥、反射和眼睑)和死亡情况等[7]。根据小鼠的死亡情况,采用Bliss法计算HMD的LD50值。在14 d观察期结束后,每只实验小鼠均进行解剖,仔细观察心、肝、脾、肺、肾、胃、肠、子宫/卵巢等主要脏器,若发现有组织器官发生异常改变时,必须进行病理学检查。
1.4 数据处理
记录正式急性毒性实验的各组动物只数、药物剂量、死亡时间、死亡数,经Bliss法软件测定得出HMD的LD50值。
2 结果
2.1 急性毒性实验观察结果
急性毒性试验中,昆明小鼠在静脉给药约1.5 h后,出现小鼠中枢神经极度兴奋状态,如叫声异常、全身性抽搐、跳跃随后出现抑制至死亡。其间小鼠出现眼部充血、大小便失禁及流涎现象。14 d观察期后,全部存活小鼠处死剖检,肉眼检查重要脏器(心、肝、脾、肺、肾、胃、肠、卵巢/睾丸等)未见有明显异常病理形态改变。
2.2 急性毒性预实验结果
预实验的结果见表1。根据表1的实验数据大致得出HMD的最小致死剂量(LD100)约为25 mg/kg和最大耐受量(LD0)约为3.13 mg/kg。

表1 HMD-272对小鼠静脉给药急性毒性预实验结果
2.3 HMD半数致死量(LD50)的测定
由预实验得出LD100:LD0=25mg/kg:3.13mg/kg≈8,查照分组数与剂量比值表得出分组为7组最为合适,剂量梯度设置为0.8。取雌雄KM小鼠各70只,分别分为7组,按设计剂量浓度以静脉注射给药一次,注射体积0.2ml/20g小鼠体重。实验结果见表2。
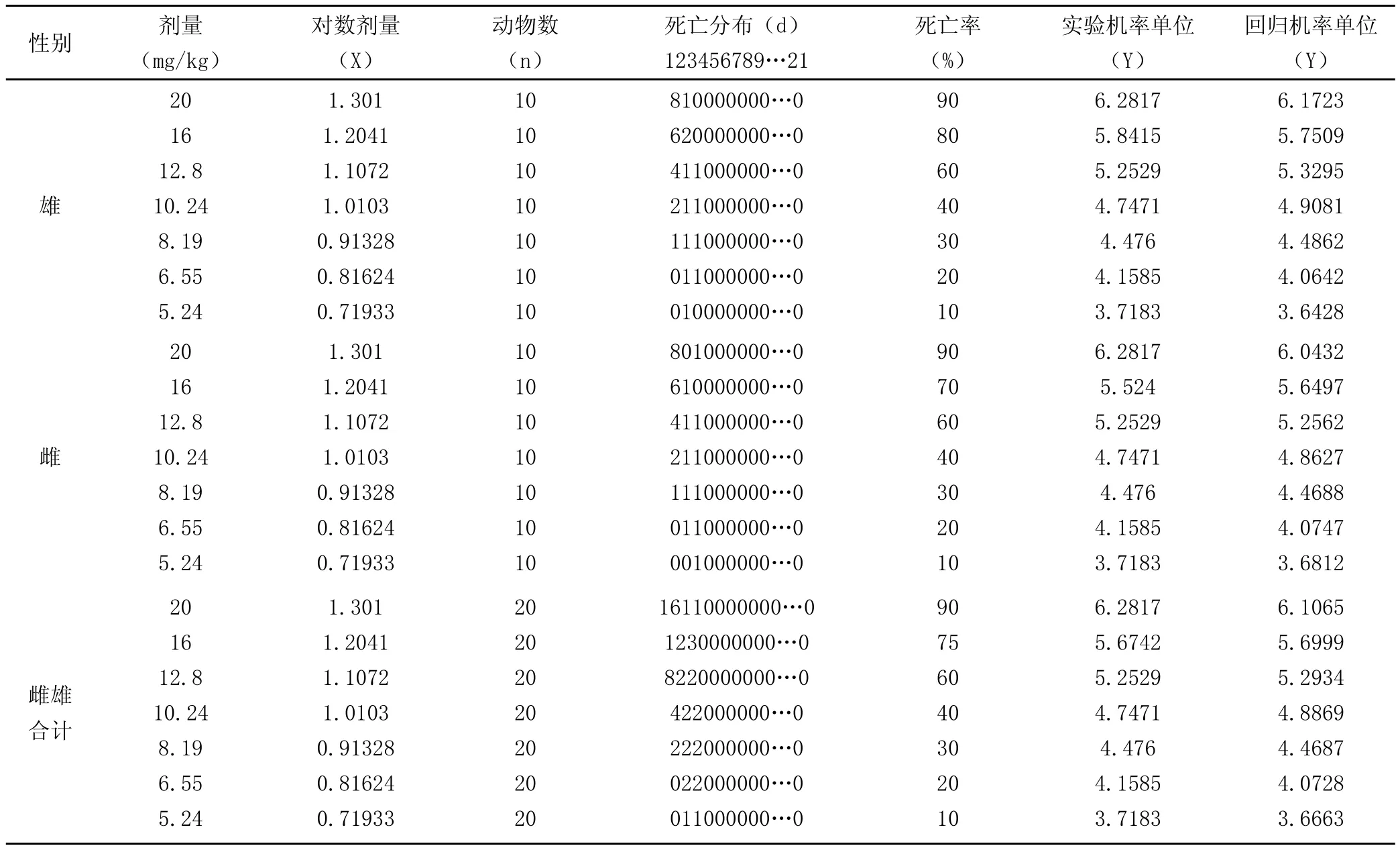
表2 小鼠静脉途径给药急性毒性试验
(1)用 Bliss 法计算雄性小鼠半数致死量得出:

(2)用 Bliss 法计算雌性小鼠半数致死量得出:

(3)用 Bliss 法计算雌雄合计半数致死量得出:

3 讨论
在进行急性毒性试验时,实验动物给药途径的选择,要根据药品的基本毒性和靶器官的吸收来确定,至少必须包括临床拟用和药物能原型进入循环这两种途径,但如果是临床拟采用静脉给药的方法,则进行急性毒性实验时采用静脉注射一种途径即可[7]。
急性毒性实验结束后检查实验组重要脏器(心、肝、脾、肺、肾、胃、肠、卵巢/睾丸等)与空白组对照组织结构正常,肉眼未见组织器官发生病变。仅有个别小鼠出现肺脓肿、肝组织小灶坏死等病变现象,考虑为自然病变,亦有小鼠出现肺出血情况,则可能与动物处死时胸部受到外力所致。实验组与空白组相比,没发现因为剂量而产生依赖性的病理学变化,则可认定为药物急性毒性实验检查无毒性发现[8]。
[1]国家食品药品监督管理局.药物非临床研究质量管理规范(局令第2号)[S/OL].(2003-8-6)[2012-1-21].http://www.sda.gov.cn/WS01/CL0053/24472.html.
[2]李琳,吕琳,陈金香,等.我国GLP规范与国际互认[J].中国药事,2008,12(7):531-533.
[3]房城.药物安全性评价中专题负责人的作用及应具备的能力[J].科技创新导报,2011,(13):230.
[4]王宏涛.药物安全性评价与GLP建设[J].中南药学,2010,8(10):775-777.
[5]卜瑞,曹日辉,黄正明.中药新药临床前安全性评价中若干问题的分析[J].中国药物应用与监测,2005,(5):19-24.
[6]张爱华,孙志伟.毒理学基础[M].北京:科学出版社,2008.
[7]《化学药物急性毒性试验技术指导原则》课题研究组.化学药物急性毒性试验技术指导原则[S/OL].(2005-6-24).http://www.sda.gov.cn/gsz05106/11.pdf.
[8]张银卿,王宁生,刘启德,等,五苓散的毒性评价[J].中国现代药物应用,2008,2(12):16-18.

