伤寒沙门菌高渗诱导基因osmY的克隆表达与多克隆抗体的制备
翁晓琴,张红,詹莉芳,张晓磊,生秀梅,徐顺高,黄新祥
(江苏大学基础医学与医学技术学院,江苏 镇江 212013)
伤寒沙门菌(Salmonella enterica serovar Typhi,S.Typhi)是一种人类重要的致病性革兰阴性杆菌,通过食源性传播导致一种全身系统性疾病—伤寒症,这种疾病在不发达地区仍有暴发[1]。细菌可以适应广范围的外环境渗透压变化,其分子机制非常复杂[2],例如伤寒沙门菌从食物的低渗环境突然进入肠道的高渗环境中,为了抵御高渗应激,许多细胞膜蛋白的表达量会发生变化,特别是那些周质蛋白(periplasmic protein),如ProU和OsmY 蛋白等[3-4]。
在大肠埃希菌中,osmY基因是一种渗透压诱导基因,其表达依赖于RpoS的激活[5]。在高渗应激的条件下,osmY基因的表达量明显升高8~10倍,能编码一种相对分子质量约22×103的周质蛋白OsmY,有研究者推测OsmY蛋白是运输某种渗透物的载体,但其确切功能至今未知[6]。我们通过基因表达谱分析发现,在高渗应激早期,伤寒沙门菌osmY基因缺陷株与野生株相比,有许多重要功能的基因表达发生变化,其中包括Vi荚膜基因、菌毛基因和侵袭相关基因等[7]。所以我们猜测,在高渗应激的环境下,OsmY蛋白可能作为一个重要蛋白参与调节某些基因的表达,或者与其他相关蛋白相互作用来帮助细菌抵御高渗环境。
本研究拟克隆表达重组蛋白OsmY-His6并制备兔抗重组蛋白的多克隆抗体,为进一步研究OsmY蛋白在高渗应激环境中所发挥的功能提供基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 野生型 S.Typhi GIFU 10007由日本岐阜大学医学院微生物学教研室馈赠;E.coli JM109(DE3)和质粒 pET22b(+)由本室保存。
1.1.2 主要试剂与材料 DNA聚合酶pfu和预染蛋白标准参照物均为Fermentas公司产品;rTaq、缓冲液、dNTP、DL2000、限制性内切酶 NcoⅠ和 XhoⅠ、T4DNA连接酶均为TaKaRa(大连)公司产品;弗氏完全佐剂和弗氏不完全佐剂为Sigma公司产品;IPTG为Promega公司产品;质粒提取试剂盒为Axygen公司产品。
1.1.3 主要仪器 高速冷冻离心机(Eppendorf),凝胶成像分析系统和蛋白电泳仪(Bio-Rad),PCR扩增仪2720 Thermal Cycler(ABI),核酸检测仪(Nano-Drop),恒温摇床(Thermo scientific),JY92-IIDN 超声破碎仪(宁波新芝生物科技股份有限公司)。
1.1.4 实验动物 家兔2只(江苏大学实验动物中心)。
1.2 方法
1.2.1 引物设计和目的基因的获取 利用基因库获取伤寒沙门菌osmY基因的核苷酸序列618 bp,通过Oligo 6.0软件设计PCR特异性上下游引物P-osmY-A/B,并分别在引物5'端加接NcoⅠ和XhoⅠ的特异性酶切序列,由上海生工生物技术公司合成,P-osmY-A:
GACCATGGATATGACTATGACAAGACTG(下划线为 NcoⅠ酶切位点),P-osmY-B:
ATCTCGAGCTGAACTTTCAGATCGTT(下划线为XhoⅠ酶切位点)。从LB平板挑取伤寒沙门菌GIFU 10007菌落,加入1 mL去离子水并振荡混匀,100℃ 煮10 min,离心取上清(含基因组DNA),以上清为模板,以P-osmY-A/B为引物,用高保真 DNA聚合酶 pfu扩增目的基因osmY。
1.2.2 重组质粒的构建与鉴定 用酚仿-乙醇法纯化PCR产物,纯化后的PCR产物和表达载体pET22b(+)经NcoⅠ和Xho I双酶切后,酶切产物经酚仿-乙醇法纯化后用T4DNA连接酶4℃连接过夜。将连接产物热激转化入E.coli JM109,从转化平板上挑取24个菌落接种在24等份含氨苄西林的LB平板上增菌培养过夜,将上述菌体和空载体转化菌体收集于30 μL蒸馏水的EP管中,向EP管中再加30 μL 酚/氯仿/异戊醇(25 ∶24 ∶1)混合液,在振荡器上剧烈振荡,离心取10 μL上清,用0.7%琼脂糖凝胶电泳初步筛选含阳性质粒的细菌。提取阳性克隆质粒,用PCR和双酶切验证阳性质粒,再通过DNA测序分析确认阳性质粒的序列正确(测序分析由上海生工生物技术公司完成)。原理见图1。

图1 伤寒沙门菌pET22b(+)-osmY重组质粒的构建原理Fig 1 The schematic diagram of the pET22b(+)-osmY vector of S.Typhi
1.2.3 OsmY蛋白表达条件 挑取分别含重组质粒 pET22b(+)-osmY和空质粒 pET22b(+)的E.coli JM109于1 mL LB培养液中(氨苄西林0.1 mg/mL),37℃振摇过夜,然后以1∶100的比例转接入20 mL LB培养液中,37℃振摇2~3 h至D(600 nm)为0.5,加入 TPTG 至终浓度为1 mmol/L,于18 ℃振摇诱导 12 h[8],冰浴 10 min,4 ℃,10 000 r/min离心10 min,用500 μL PBS缓冲液重悬菌沉淀,250 μL菌液用于全菌蛋白电泳,另外250 μL菌液用于4℃超声至清亮,12 000 r/min离心15 min,取上清和沉淀进行SDS-PAGE电泳。
1.2.4 OsmY蛋白的纯化 用上述诱导条件1 000 mL培养重组表达菌,冰浴 10 min,4℃,10 000 r/min离心10 min后取菌沉淀,并用PBS缓冲液(pH7.2)洗涤3次,将菌沉淀称重,在菌沉淀中加入相应体积的非变性结合缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,5 mmol/L 咪 唑 pH 8.0)(10 mL非变性结合缓冲液/1 g菌),4℃超声破碎后,4℃ 12 000 r/min离心30 min,收集上清液。用非变性结合缓冲液平衡Ni柱,再将收集的上清液以1 mL/min的速度上样于Ni柱,用非变性洗涤缓冲液 (50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L咪唑 pH 8.0)洗涤杂蛋白,直至紫外分光光度仪检测蛋白质量浓度接近0 μg/mL,此时用非变性洗脱缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,250 mmol/L咪唑 pH 8.0)洗脱融合蛋白,共收集5 mL,用紫外分光光度仪检测蛋白质量浓度并用SDS-PAGE电泳鉴定纯度。
1.2.5 兔抗 OsmY蛋白多克隆抗体的制备 用PBS缓冲液透析收集的融合蛋白OsmY-His6以去除咪唑,将透析好的融合蛋白OsmY-His6与等体积的弗氏完全佐剂研磨至完全乳化,每只家兔以1 mL乳化的免疫原(含50 μg融合蛋白),背部皮下多点注射。每隔2周将抗原与等体积的弗氏不完全佐剂研磨至乳化后免疫家兔,共免疫4~5次,末次免疫1周后颈动脉放血并获得抗血清,用半饱和硫酸铵盐析法和透析除盐法获得粗提的多克隆抗体,分装后保存于-20℃[9]。用双向免疫琼脂扩散法测定抗体效价,用蛋白质印迹法检测多克隆抗体与抗原反应的特异性。
2 结果
2.1 伤寒沙门菌 pET22b(+)-osmY重组质粒的构建
以S.Typhi野生株 GIFU 10007为模板,PCR扩增得到约633 bp的DNA片段,经NcoⅠ和XhoⅠ双酶切后与表达载体pET22b(+)相连接,连接产物转化入E.coli JM109,筛选阳性克隆质粒,并提取初筛阳性质粒pET22b(+)-osmY,经NcoⅠ和XhoⅠ双酶切与PCR鉴定,osmY基因已经成功与表达载体pET22b(+)相连(图2)。
2.2 重组蛋白OsmY-His6的表达与纯化
带有重组质粒 pET22b(+)-osmY的 E.coli JM109在18℃、TPTG终浓度为1 mmol/L的条件下诱导12 h后,经SDS-PAGE电泳鉴定:在超声后上清中可见大量的重组蛋白OsmY-His6,该上清经Ni柱纯化后获得重组蛋白OsmY-His6(图3)。

图2 伤寒沙门菌pET22b(+)-osmY重组质粒的构建Fig 2 Preparation of the pET22b(+)-osmY vector of S.Typhi
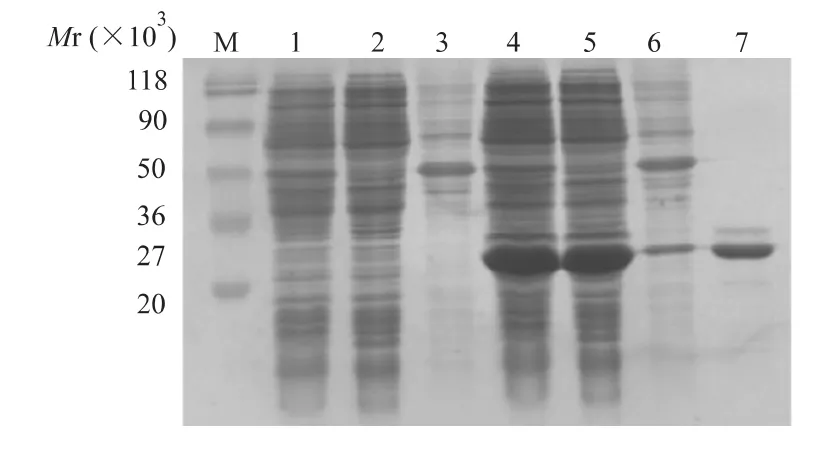
图3 重组蛋白OsmY-His6的表达与纯化Fig 3 SDS-PAGE analysis of recombinant protein OsmY-His6expression and purification
2.3 兔抗OsmY-His6蛋白的多克隆抗体制备
以纯化的OsmY-His6蛋白为免疫原免疫家兔,获得兔抗OsmY-His6的多克隆抗体,用双向免疫琼脂扩散测定效价为1∶8。蛋白质印迹显示多克隆抗体与抗原反应的特异性良好(图4)。
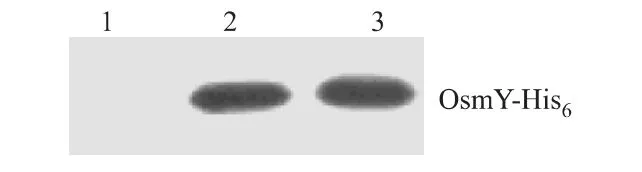
图4 抗体特异性的免疫印迹鉴定Fig 4 Western-blotting analysis of the anti-OsmY polyclonal antibody
3 讨论
伤寒沙门菌(S.Typhi)是沙门菌属中一种重要的人类肠道致病菌,通过污染的食物进入消化道后,侵入空肠M上皮细胞,并能在M细胞中存活和增殖,最终可穿过肠系膜淋巴组织进入淋巴循环和血液循环,从而进入肝、脾和肾等脏器,造成系统性感染[10]。在这个致病过程中,伤寒沙门菌需要克服肠道的高渗环境,其分子机制非常复杂,主要通过两种途径:一是蛋白活性的调节,作为一种立即反应;二是基因转录的调节,作为一种长期反应。细菌必需产生许多化学分子将环境外部的刺激信号转导入细胞内部,从而来实现这两种途径[11]。
大肠埃希菌在高渗应激的条件下,周质空间中的某些蛋白的表达量增多,如ProU和OsmY蛋白等[3-4]。周质空间又称壁膜空间,位于细胞壁与细胞膜之间的狭窄间隙,含有多种蛋白质,例如蛋白酶、核酸酶等各种水解酶和运送某些物质进入细胞内的结合蛋白,以及趋化性的受体蛋白等。osmY基因是一种渗透压诱导基因,在高渗应激的条件下,其表达量明显升高8~10倍,能编码相对分子质量约为22×103的周质蛋白OsmY。所以有研究者推测OsmY蛋白是运输某种渗透物的结合蛋白,但其确切功能至今未知[6]。我们的前期实验发现,与伤寒沙门菌野生株相比,osmY基因缺陷株在高渗应激早期,有许多基因的表达量发生显著变化,有表达量上调的基因(tviA、fimA、treC等)和表达量下调的基因(otsB、fimA、rpoS 等)[7]。据此,我们猜测 OsmY 蛋白在高渗应激的条件下可能有3种作用,一是作为调节蛋白来调节某些基因的表达;二是与其他相关蛋白相互作用来调节蛋白活性;三是作为结合蛋白来运输某种渗透物。
本研究克隆表达了重组蛋白OsmY-His6并制备兔抗重组蛋白的多克隆抗体,为进一步研究OsmY蛋白在高渗应激环境中所发挥的功能提供了基础。
[1] Marathe SA,Lahiri A,Negi VD,et al.Typhoid fever&vaccine development:a partially answered question[J].Indian J Med Res,2012,135:161-169.
[2] Csonka LN.Physiological and genetic responses of bacteria to osmotic stress[J].Microbiol Rev,1989,53(1):121-147.
[3] Barron A,May G,Bremer E,et al.Regulation of envelope protein composition during adaptation to osmotic stress in Escherichia coli[J].J Bacteriol,1986,167(2):433-438.
[4] Yim HH,Villarejo M.osmY,a new hyperosmotically inducible gene,encodes a periplasmic protein in Escherichia coli[J].J Bacteriol,1992,174(11):3637 -3644.
[5] Rosenthal AZ,Kim Y,Gralla JD.Poising of Escherichia coli RNA polymerase and its release from the sigma 38 C-terminal tail for osmY transcription[J].J Mol Biol,2008,376(4):938-949.
[6] Yim HH,Brems RL,Villarejo M.Molecular characterization of the promoter of osmY,an rpoS-dependent gene[J].J Bacteriol,1994,176(1):100 -107.
[7] 孟彦辰,王菲,杜鸿,等.OsmY缺失对伤寒沙门菌在高渗应激早期基因表达的影响[J].江苏大学学报:医学版,2012,22(4):286-290.
[8] Li Y,Yang P,Meng K,et al.Gene cloning,expression,and characterization of a novel beta-mannanase from Bacillus circulans CGMCC 1416[J].J Microbiol Biotechnol,2008,18(1):160 -166.
[9] 张海方,高宇琳,黄新祥,等.伤寒沙门菌鞭毛素基因fljB:z66的克隆表达及其多克隆抗体的制备[J].江苏大学学报:医学版,2009,19(5):376 -379.
[10] Everest P,Wain J,Roberts M,et al.The molecular mechanisms of severe typhoid fever[J].Trends Microbiol,2001,9(7):316 -320.
[11] Krämer R.Bacterialstimulusperception and signal transduction:response to osmotic stress[J].Chem Rec,2010,10(4):217-229.

