盐酸表柔比星长循环磁性脂质体的制备及表征
方瑜,陈进,吴询燊,吴修艮,姜德立,陈敏,谢吉民
(1.江苏大学化学化工学院,江苏 镇江 212013;2.江苏吉贝尔药业有限公司,江苏 镇江 212009)
盐酸表柔比星(EPI)是一种广谱的蒽环类化疗药物,抗癌谱广,疗效显著,可治疗多种肿瘤。但该药严重的毒副作用,尤其是严重的心脏损害、骨髓抑制等不良反应限制了其临床应用[1]。脂质体是将药物包封于类脂质双分子层内而形成的微型泡囊,可以有效保护被包裹药物、提高药物的治疗指数、减少药物的治疗剂量、降低药物的毒副作用、减轻变态反应及免疫反应并延缓药物释放[2-3]。研究结果表明,脂质体包裹EPI的毒性比游离药物的毒性降低50% ~70%[4]。磁性脂质体是近年来国内外大力研究的一种新型靶向制剂,这种制剂可使药物同时具有生物功能、磁靶向功能和治疗功能,因此具有更大的应用前景[5-8]。但是目前的磁性脂质体大多存在着许多不可避免的缺点,例如体内循环时间短,物理和化学稳定性不足,囊泡表面缺少靶向位点及水溶液中分散性不好等,因此开发一种具有优良性能的磁性脂质体势在必行。
本研究以聚乙二醇单甲醚(mPEG)为修饰膜材,采用乙醇注入-硫酸铵梯度法制备mPEG化EPI磁性脂质体,并对其进行表征;采用葡聚糖凝胶柱-紫外法测定脂质体中EPI的包封率,并考察制备条件对EPI包封率的影响,得到最佳制备条件;进一步研究该脂质体的稳定性和缓释效果。旨在为EPI系列新制剂的开发应用提供实验依据和理论基础。
1 材料与方法
1.1 材料
聚乙二醇单甲醚(mPEG)(阿拉丁试剂公司);胆固醇(生工生物工程有限公司);卵磷脂(国药集团化学试剂有限公司);注射用盐酸表柔比星(浙江海正药业有限公司);氯化铁、氯化亚铁、氯仿、异丙醇、磷酸氢二钠、磷酸二氢钠、盐酸、硫酸铵均购于国药集团化学试剂有限公司。
DF-101S集热式恒温加热磁力搅拌器、RE-52C旋转蒸发器(巩义市英峪予华仪器厂);电动搅拌器JJ-1(江苏金坛医疗仪器厂);气浴恒温振荡器(金坛市医疗器械厂);Nexus 470 FT-IR光谱仪(美国Nicolet公司);Philips Tecnai-12透射电子显微镜(荷兰Philips公司);UV-2450紫外可见分光光度计(日本岛津公司)。
1.2 方法
1.2.1 Fe3O4纳米颗粒的制备和表征 在搅拌条件下,将0.5 g氯化铁和0.17 g氯化亚铁加入150 mL除氧的蒸馏水中,缓慢滴入2 mol/L的氨水,待反应物变为黑色后,调节pH为9~10,在氮气保护下80℃回流2 h。反应结束后,蒸馏水洗涤2~3次,最终产物分散于无水乙醇中。
采用透射电镜(TEM)观察所制得Fe3O4纳米颗粒的形貌和粒径。
1.2.2 mPEG化EPI纳米磁性脂质体的制备和表征 按比例称量卵磷脂、胆固醇、mPEG和Fe3O4,超声溶于15 mL无水乙醇,用1 mL注射器将混合液缓慢注入装有25 mL硫酸铵溶液的圆底烧瓶中,水浴超声30 min,减压旋转蒸发,直至无明显乙醇味,制得空白脂质体。将空白脂质体装入透析袋中,用PBS溶液透析24 h。透析后的空白脂质体中加入一定量预热过的 EPI溶液,置于55℃水浴孵化30 min,用两层微孔滤膜(超强型,上海密粒膜分离技术有限公司)过滤,控制脂质体大小,并滤去未包封住的颗粒,即得磁性EPI脂质体,4℃保存。
采用透射电镜观察所制得磁性EPI脂质体的形貌和粒径;通过外加磁场的作用,考察所制得磁性EPI脂质体的体外磁响应性;通过红外光谱分析,研究mPEG对所制得的磁性EPI脂质体的修饰效果。
1.2.3 mPEG化EPI纳米磁性脂质体中EPI包封率的测定
1.2.3.1 回归方程 称取EPI标准品适量,以PBS为溶剂配置0.2 mg·mL-1的储备液,分别配成0.01,0.02,0.03,0.04,0.05 mg·mL-1的 EPI 标准溶液,在最高吸收波长(232 nm)下测定光密度(D)值,将D值与质量浓度(C)进行线性回归,得到回归方程和相关系数。
1.2.3.2 包封率的测定 取1 mL mPEG化EPI纳米磁性脂质体混悬液加到葡聚糖 G-50凝胶柱上,用PBS溶液以1 mL·min-1的流速洗脱,于最高吸收波长处进行紫外光谱检测,根据结果绘制洗脱曲线。
收集形成洗脱曲线的第1峰的洗脱液,得到除去游离EPI的含药脂质体溶液,加入异丙醇-盐酸(V∶V=9∶1)混合液使脂质体完全破裂,用紫外分光光度计于最高吸收波长处测定光密度,按照葡聚糖凝胶柱-紫外法(Sephadex-UV)测定mPEG化磁性EPI纳米脂质体的包封率。包封率的计算公式如下:
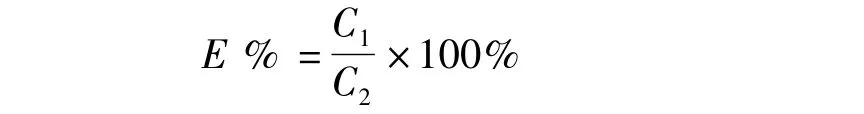
其中E为包封率,C1为1 mL样品中EPI包封量,C2为1 mL样品中EPI总量。
1.2.4 体外稳定性和缓释效果试验 测定所制备的mPEG化EPI纳米磁性脂质体样品中EPI的包封量C1后,将样品置于37℃气浴恒温振荡器中,振荡速度 100 r·min-1,分别于 0.5,1,1.5,2,2.5,3,3.5,4 h取样1 mL,测定脂质体内EPI的包封量C2。按下列公式计算EPI释放率(R):

根据EPI释放率的变化情况,评价所制得EPI长循环脂质体的体外稳定性和缓释效果。
2 结果与讨论
2.1 纳米Fe3O4形貌和粒径
图1为所制备的Fe3O4纳米粒子的TEM照片。由图1可见,产物Fe3O4纳米粒子为近球形颗粒,平均粒径约为20 nm,粒度均匀性良好,无明显团聚现象。

图1 Fe3O4纳米粒子的TEM照片Fig 1 TEM micrograph of Fe3O4nanoparticles
2.2 mPEG化EPI纳米磁性脂质体形貌和粒径
取适量脂质体,以PBS稀释至较低浓度,超声分散均匀,滴于铜网上,以质量分数为2%的磷钨酸负染,透射电镜下观察产物形貌。图2为所制备的EPI磁性脂质体的透射电镜照片,可以明显看出,所制得的mPEG修饰EPI磁性脂质体粒径约50 nm,近球形;Fe3O4粒子被包覆于脂质体膜内,包覆的磁性颗粒的尺寸大于未被包覆的Fe3O4纳米颗粒,可能是由于Fe3O4粒子团聚所致。

图2 mPEG化EPI纳米磁性脂质体的TEM照片Fig 2 TEM micrograph of mPEG modified magnetic long-circulating EPI liposomes
2.3 mPEG化EPI纳米磁性脂质体体外磁响应性
实验结果见图3。原本均匀分散在PBS溶液中的磁性脂质体(图3a)在3 min内迅速聚集在磁铁一侧(图3b),表明所制备的mPEG化EPI纳米磁性脂质体具有良好的磁响应性。

图3 mPEG化EPI纳米磁性脂质体被外磁场吸引Fig 3 The photo of mPEG modified magnetic long-circulating EPI liposomes in vitro magnetic induction
2.4 红外光谱分析
红外光谱图见图4。经对比,c中3 400 cm-1左右的宽扁峰是羟基的伸缩振动峰,2 900 cm-1左右的峰对应mPEG的—CH2CH2O—单元中的亚甲基碳氢吸收峰,1 750 cm-1处的中等强度吸收峰是羰基的振动吸收峰,1 100 cm-1代表C—O醚键的伸缩振动,可以初步表明形成了mPEG化EPI纳米磁性脂质体。
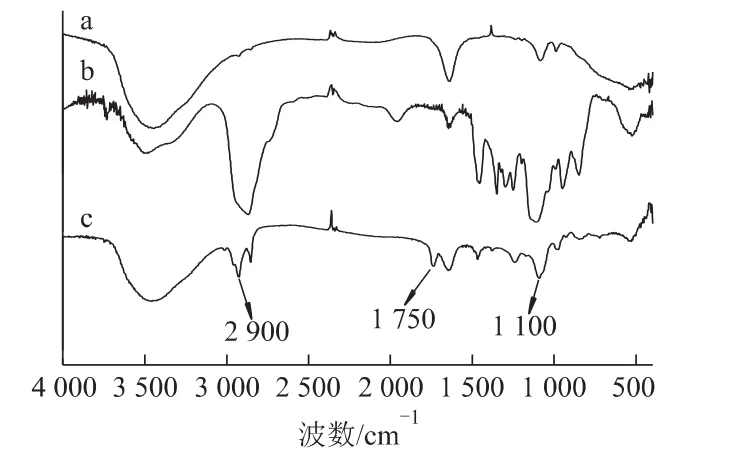
图4 mPEG化EPI纳米磁性脂质体的红外谱图Fig 4 Fourier transform infrared(FTIR)absorption spectra of mPEG modified magnetic long-circulating EPI liposomes
2.5 mPEG化EPI纳米磁性脂质体的包封率
采用葡聚糖凝胶柱-紫外法测定脂质体中EPI的包封率。由实验得到EPI的回归方程为 A=8.659 26C+0.055 87,r2=0.999 4。
图5为游离EPI和mPEG化EPI纳米磁性脂质体的洗脱曲线。由于游离EPI微粒本身直径小,易分散在葡聚糖凝胶间隙,因此过柱时间长;而mPEG化EPI纳米磁性脂质体微粒直径较大,过柱时间短,先被洗脱,这样就实现了两者较好的分离。曲线中第1个波峰对应先洗脱下来mPEG化EPI纳米磁性脂质体的量,而第2个波峰对应后洗脱下来游离EPI的量。从洗脱曲线中可以看出,游离EPI的洗脱体积为100~130 mL,而mPEG化EPI纳米磁性脂质体的洗脱体积为8~12 mL,说明凝胶柱可确保脂质体和游离EPI的完全分离,且无柱吸附现象。
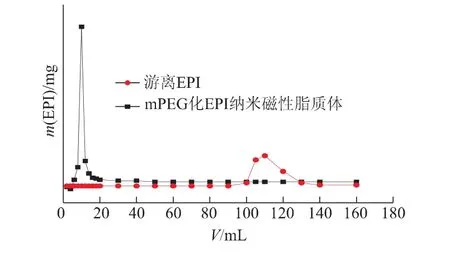
图5 游离EPI和mPEG化EPI纳米磁性脂质体的洗脱曲线Fig 5 Elution curve of the free EPI and mPEG modified magnetic long-circulating EPI liposomes
2.6 影响EPI包封率的因素
2.6.1 水浴孵化时间对包封率的影响 孵化时间对mPEG化EPI磁性脂质体包封率的影响见图6。制备条件:溶剂为无水乙醇(15 mL);m(卵磷脂):m(胆固醇)=5∶1;m(EPI)=0.55 mg;m(mPEG)=0.02 g。

图6 水浴孵化时间对包封率的影响Fig 6 Effects of incubation time in water bath on encapsulation efficiency of EPI
图6表明,mPEG化EPI磁性脂质体的包封率先随水浴孵化时间的增长而提高,当孵化时间为30 min时,EPI脂质体的包封率达到最大值57.5%,再继续增长水浴孵化时间,mPEG化EPI磁性脂质体的包封率基本保持不变。
2.6.2 卵磷脂与胆固醇质量比对包封率的影响卵磷脂与胆固醇质量比对包封率的影响如图7所示。制备条件:溶剂为无水乙醇(15 mL);m(EPI)=0.55 mg;m(mPEG)=0.02 g;t=30 min。

图7 卵磷脂与胆固醇质量比对包封率的影响Fig 7 Effects of mass ratio of lecithin to cholesterol on encapsulation efficiency of EPI
图7显示,mPEG化EPI磁性脂质体的包封率先随卵磷脂质量比的增加而提高,当m(卵磷脂)∶m(胆固醇)=5∶1时,EPI脂质体的包封率达到最大值57.5%,再继续增加卵磷脂用量,mPEG化EPI磁性脂质体的包封率反而降低。这可能是由于胆固醇是脂质体膜的一种收紧剂,当卵磷脂与胆固醇的比例合适时,脂质体膜会比较致密,内水相中的药物才能不渗漏出来。当卵磷脂用量过大时,胆固醇无法使其充分形成稳定致密的磷脂膜,反而降低了包封率。
2.6.3 EPI用量对包封率的影响 图8为EPI用量对包封率的影响。制备条件:溶剂为无水乙醇(15 mL);m(卵磷脂)∶m(胆固醇)=5∶1;m(mPEG)=0.02 g;t=30 min。从图8可以看出,mPEG化EPI磁性脂质体的包封率先随EPI用量的增加而提高,当EPI用量为0.55 mg时,EPI脂质体的包封率达到最大值57.5%,再继续增加EPI用量,EPI脂质体的包封率反而降低。这可能是由于EPI溶液呈弱碱性,大量的EPI溶液降低了原本的硫酸铵梯度,随着内外水相的硫酸铵梯度减小,产生的pH梯度和驱动力越小,EPI进入内水相的量也越小,包封率越低。

图8 EPI用量对包封率的影响Fig 8 Effects of EPI dosage on encapsulation efficiency of EPI
2.6.4 mPEG用量对包封率的影响 mPEG用量对EPI磁性脂质体包封率的影响见图9。制备条件:溶剂为无水乙醇(15 mL);m(卵磷脂)∶m(胆固醇)=5 ∶1;m(EPI)=0.55 mg;t=30 min。
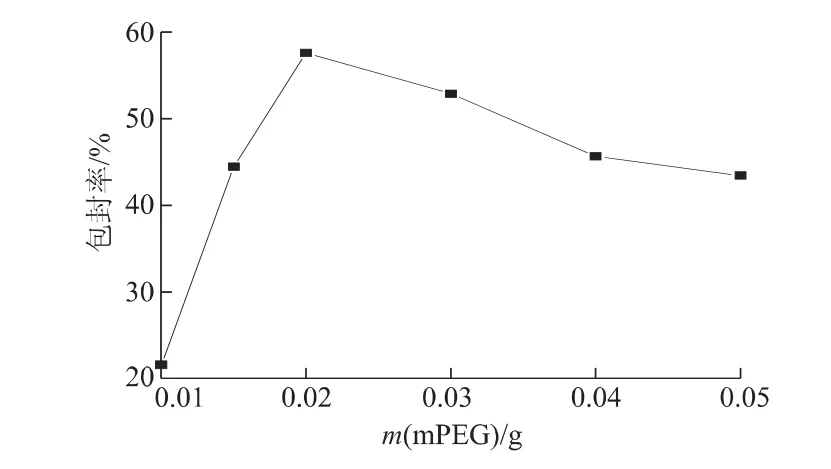
图9 mPEG用量对包封率的影响Fig 9 Effects of mPEG amount on encapsulation efficiency of EPI
图9显示,所制得脂质体的包封率先随mPEG用量的增加而提高,当 mPEG用量为0.02 g时,mPEG化EPI磁性脂质体的包封率达到最大值57.5%,再继续增加EPI用量,脂质体的包封率降低。这是由于mPEG具有疏水性长链,能插入脂质体膜,而亲水端伸展于脂质体的表面,由于这种物质本身的成膜性差,在脂质体膜中所占的比例过大时,会破坏脂质体膜的稳定性,从而降低脂质体对水溶性物质的包封率。
2.6.5 不同溶剂对包封率的影响 为观察不同溶剂对mPEG化EPI磁性脂质体包封率的影响,我们分别使用氯仿、二氯甲烷、无水乙醇和乙醚作为溶剂,制备条件:m(卵磷脂)∶m(胆固醇)=5∶1;m(EPI)=0.55 mg;t=30 min;溶剂15 mL。结果氯仿、二氯甲烷、无水乙醇和乙醚作为溶剂,mPEG化EPI磁性脂质体包封率分别为52.3%,46.5%,57.5%和24.1%。
可见无水乙醇作溶剂时包封率最好,可达到57.5%,同时,无水乙醇与其他溶剂相比,无毒,低廉。因此本实验选择无水乙醇作为溶剂。
2.7 mPEG化EPI纳米磁性脂质体的缓释效果
图10为mPEG化EPI纳米磁性脂质体的体外释放曲线,可以看出,EPI药物在0.5 h的释药率即达到了24.8%,1 h后释药率达到44.8%,2 h的释药率为60.3%。随后,mPEG化EPI纳米磁性脂质体的释药率缓慢减慢,4 h后维持在55.0%左右。以上实验结果表明所制备的mPEG化EPI纳米磁性脂质体具有优良的缓释效果。
本实验采用PBS溶液作为释放介质,考察了mPEG化EPI纳米磁性脂质体的缓释效果,因为PBS(pH=7.4)液与血液pH值相同。以上结果同时表明,mPEG化EPI纳米磁性脂质体在PBS液具有良好的缓释效果,但其血浆释放度和药物代谢动力学及生物利用度有待进一步研究。
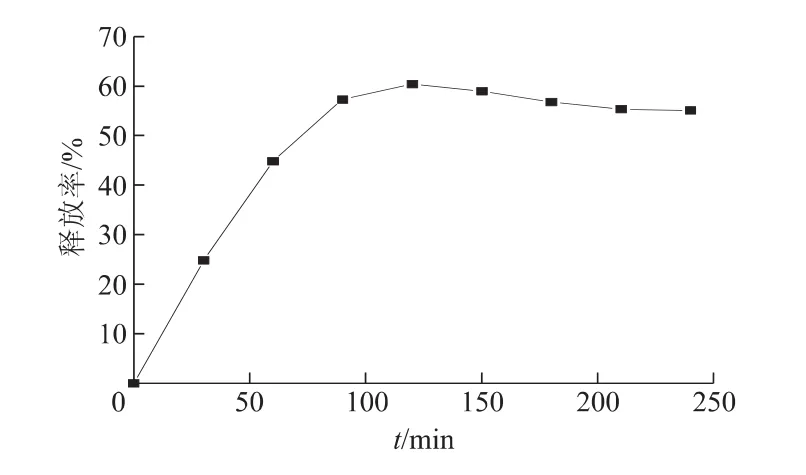
图10 mPEG化EPI纳米磁性脂质体的体外释放曲线Fig 10 Release profiles of EPI at pH 7.4 in PBS solution
3 结论
磁性长循环纳米脂质体与其他纳米磁性药物载体相比,尽管制备较复杂,成本较高,但对药物具有高包封和明显的长效缓释效果[9-10]。而且与其他抗癌药物制剂相比,应用脂质体包裹化疗药物后,能显著减轻药物的毒副作用,提高化疗药物的疗效指数,且脂质体为纳米生物膜,毒性低,与人体组织细胞有很好的生物相容性。
本研究以沉淀法制备纳米磁性Fe3O4为磁核,聚乙二醇单甲醚(mPEG)为修饰剂,采用乙醇注入法制备空白mPEG化磁性脂质体,硫酸铵梯度法包覆EPI,制备了mPEG化EPI纳米磁性长循环脂质体。实验结果表明,当以无水乙醇为溶剂(15 mL),m(卵磷脂)∶m(胆固醇)=5 ∶1,m(EPI)=0.55 mg,m(mPEG)=0.02 g时,制备的mPEG化EPI纳米磁性脂质体体颗粒为近球形,平均粒径约为50 nm,药物包封率达到57.5%,磁响应性和缓释效果均良好。作为一种新型药物制剂,随着科学技术的发展,纳米磁性长循环脂质体必将会有广阔的发展前景。
[1] 吴燕,吴诚,梅兴国,等.盐酸表柔比星长循环热敏冻干脂质体的处方工艺研究与体外释药机制探讨[J].军事医学科学院院刊,2010,34(2):134-145.
[2] 施靖,王红芳.脂质体作为药物载体的研究[J].中国医药导报,2008,5(11):29-30.
[3] 陈婧,韩美华,季字彬,等.脂质体及传递体的研究概况[J].中国医药技术经济与管理,2009,3(8):70-73.
[4] Budai M,Szógya M.Liposomes as drug carrier systems.Preparation,classification and therapeutic advantages of liposomes[J].Acta Pharm Hung,2001,71(1):114 -118.
[5] Pradhan P,Giri J,Banerjee R,et al.Preparation and characterization of manganese ferrite-based magnetic liposomes for hyperthermia treatment of cancer[J].J Magn Magn Mater,2007,311(1):208 -215.
[6] Hirao K,Sugita T,Kubo T,et al.Targeted gene delivery to human osteosarcoma cells with magnetic cationic liposomes under a magnetic field [J].Int J Oncol,2003,22(5):1065-1071.
[7] Zheng X,Lu J,Deng L,et al.Preparation and characterization of magnetic cationic liposome in gene delivery[J].Int J Pharm,2009,366(1/2):211-217.
[8] Dandamudi S,Campbell RB.Development and characterization of magnetic cationic liposomes for targeting tumor microvasculature [J].Biochim Biophys Acta,2007,1768(3):427-438.
[9] Lee H,Lee E,Kim do K,et al.Antibiofouling polymer-coated superparamagnetic iron oxide nanoparticles as potential magnetic resonance contrast agents for in vivo cancer imaging[J].J Am Chem Soc,2006,128(22):7383-7389.
[10] Yi DK,Lee SS,Papaefthymiou GC,et al.Nanoparticle architectures templated by SiO2/Fe2O3nanocomposites[J].Chem Mater,2006,18(3):614 -619.

