绞股蓝总皂苷对大鼠脑缺血再灌注损伤的保护作用
居立娟,王云东
(1.吉林市儿童医院 儿内科,吉林 吉林132001;2.北华大学第二临床医院·吉化总医院 眼科)
绞股蓝别名七叶胆、小芍药云、罗锅底、遍地生根等。其味苦、性寒,具有清热解毒、祛痰止咳之功效。绞股蓝的主要成分为绞股蓝总皂苷(Gypenosides,GP)。近年来,人们对GP进行了大量研究,发现其有广泛的药理作用,其中对心脑血管的研究引起了学者的广泛关注。研究发现,GP能够保护心脏的缺氧性损伤,改善心肌缺血时心脏的舒张功能[1],在一定程度上还能减轻甚至阻止心肌缺血所致心肌坏死,减少自由基的生成和钙离子内流[2-3]。GP能够舒张血管,降低血压,抑制血小板聚集,对氧自由基引起的脑血管痉挛具保护作用[4-6]。虽然绞股蓝总皂苷对脑缺血损伤具有一定的保护作用,但是其作用机制方面的研究资料报道较少。
本文通过建立大鼠脑缺血再灌注损伤模型,研究绞股蓝总皂苷对脑缺氧性损伤的保护作用并探讨其机制,为脑缺血的预防提供新的思路,同时也为开发抗脑缺血新药提供有价值的理论依据。
1 材料与方法
1.1 试剂与动物
绞股蓝总皂苷购于西安鸿生生物技术有限公司;H2O2购于北京鼎国生物技术发展中心;SOD、MDA检测试剂盒购于南京建成生物工程研究所;Bcl-2、Bax大鼠多克隆抗体购于美国Santa Crnz公司;DAB检测试剂盒购于福州迈新生物技术开发公司。
1.2 动物分组及给药
60只雄性Wistar大鼠,体重200-250g,按体重随机分为6组,每组10只,即假手术组、模型组、血塞通阳性药组(20mg·kg-1)、绞股蓝总皂苷高、中、低剂量组(100、30和10mg·kg-1)。每天腹腔注射(ip)给药1次(前两组为相同体积的生理盐水),连续给药7天。
1.3 大鼠脑缺血再灌注损伤模型的建立
末次给药30min后,模型组、阳性药组及受试药各剂量组用20%水合氯醛麻醉,分离右侧颈总动脉和颈内、颈外动脉,颈总动脉剪口后将一段一端加热变钝的3.5号鱼线插入颈内动脉并推入至前脑动脉约18mm(自颈内外动脉分叉处算起),用缝合线结扎固定尼龙线,缝合皮肤。术后2h出现竖毛,右眼horner's征,左侧偏瘫的大鼠为阳性,2h后进行缺血再灌注。假手术组只对颈内和颈外动脉进行分离,不结扎。
1.4 大鼠神经功能评分的测定
大鼠脑缺血再灌注22h后进行行为神经功能评分,标准为:活动正常者为0分;竖毛,轻度运动低下者为0.5分;前肢屈曲运动障碍者为1.0分;行动不协调,屈曲姿势,转圈运动者为2.0分;偏瘫,不能行走者为3.0分;昏迷者为4.0分;死亡者为5.0分(术后2h以上死亡者);运动障碍越明显者得分越高。
1.5 脑组织匀浆中SOD、MDA及NO含量测定
实验结束后,将大鼠立即断头取脑取血。取大约0.1g的脑组织制成均浆。SOD、MDA、NO的检测按照试剂盒说明书操作,分别在550nm、532nm和340nm处,用6010紫外分光光度计检测。
1.6 脑梗死范围的测定
实验结束后,将大鼠立即断头取脑,将脑组织进行冠状切片,间隔4mm共5片,放入2%TTC磷酸盐缓冲液(pH7.4)37℃水浴10min,缺血缺氧坏死的神经细胞因细胞膜损伤而导致脱氢酶缺失所以不染色,呈现白色,而非坏死的神经细胞呈现鲜红色。脑组织拍片后,应用BI2000软件计算,以白色区面积之和与脑组织总面积的百分比来计算脑梗死范围。
1.7 HE染色
实验结束后,将大鼠立即断头取脑,脑组织常规固定,石蜡包埋,切片,二甲苯脱蜡,梯度乙醇脱水,HE染色,梯度乙醇脱水,二甲苯透明,中性树胶封片,于光学显微镜(200×)下观察,选取大脑中动脉供血区不重叠的3个视野摄片。
1.8 免疫组化染色检测Bcl-2、Bax蛋白的表达
脑组织切片脱蜡和水化后,置于湿盒内,滴加50μl过氧化物酶阻断液(试剂A),室温孵育10 min,阻断内源性过氧化物酶的活性,PBS冲洗3 min×2,滴加50μl非免疫动物血清(试剂B)室温孵育10min,PBS冲洗3min×2,去除血清,滴加50 μl一抗(兔抗大鼠Bcl-2、Bax多克隆抗体,1:100稀释)4℃过夜,PBS冲洗3min×3,滴加50μl辣根过氧化物酶标记的二抗(羊抗兔多克隆抗体,试剂C)室温孵育10min,PBS冲洗3min×2,滴加50μl DAB,显微镜下观察3-10min,自来水冲洗,苏木素复染,氨水返蓝,梯度乙醇脱水,二甲苯透明,中性树胶封片。光镜下观察细胞浆中有棕黄色颗粒者为阳性细胞,每个标本在高倍镜下(400×)观察不重叠的2个视野,采用HPIAS-1000型图像分析仪计数阳性细胞数,取平均值。
1.9 结果处理和统计
所有数据均以平均值±标准差(x±SD)表示,应用SPSS11.5版统计学软件进行处理。各组间比较采用单因素方差分析,成组数据比较采用t检验,百分数的比较采用χ2检验,以P<0.05为具有统计学意义。
2 实验结果
2.1 绞股蓝总皂苷对大鼠神经功能评分的影响
结果显示,与假手术组比较,模型组大鼠神经功能评分明显升高(P<0.01),说明模型成立;与模型组比较,绞股蓝总皂苷100mg·kg-1、30mg·kg-1剂量组大鼠神经功能评分明显降低(P<0.05)与阳性对照药血塞通组作用相近;而绞股蓝总皂苷10 mg·kg-1剂量组大鼠神经功能评分与模型组比较差异无显著性(P>0.05)。结果见表1。
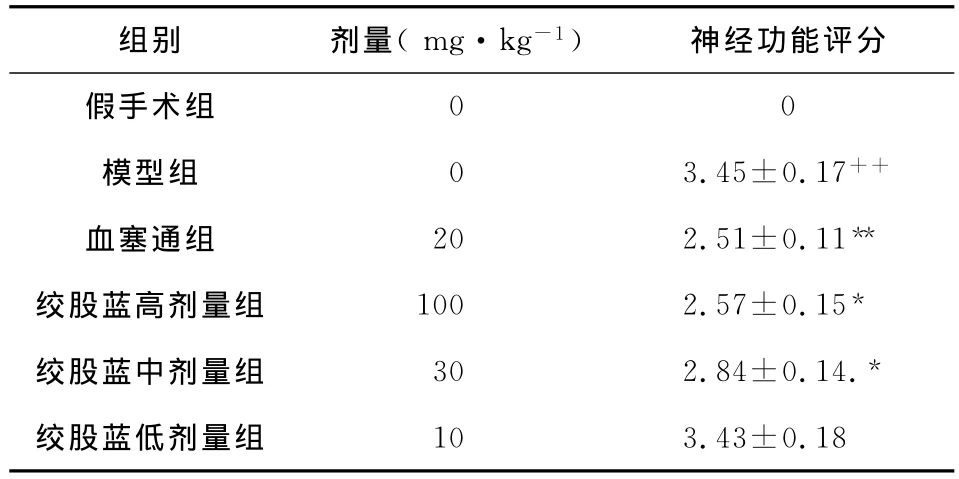
表1 绞股蓝总皂苷对大鼠神经功能评分的影响
2.2 绞股蓝总皂苷对大鼠脑组织中SOD及MDA、NO含量的影响
与模型组比较,绞股蓝总皂苷100和30mg·kg-1剂量组大鼠脑组织中SOD活性明显增强,MDA含量明显降低(P<0.05,P<0.01﹚;绞股蓝总皂苷10mg·kg-1剂量组SOD活性,MDA含量也分别有增强及下降趋势,但差异无显著性﹙P>0.05﹚;绞股蓝总皂苷各剂量组大鼠脑组织中NO含量均有下降趋势,但无统计学意义(P>0.05),结果见图1。
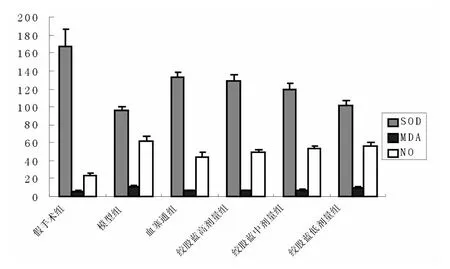
图1 绞股蓝总皂苷对大鼠脑组织中SOD,MDA和NO含量的影响
2.3 绞股蓝总皂苷对大鼠脑梗死面积的影响
模型组大鼠的脑梗死范围为(43.18±3.52)%明显高于假手术组(P<0.001);而绞股蓝总皂苷100和30mg·kg-1剂量组大鼠的脑梗死范围分别为(30.57±4.15)%、(35.84±3.84)%均明显低于模型组(P<0.05),其中100mg·kg-1剂量组大鼠的脑梗死范围与阳性对照药血塞通组相近;绞股蓝总皂苷10mg·kg-1剂量组大鼠的脑梗死范围与模型组比较差异无显著性(P>0.05),结果见表2。
表2 绞股蓝总皂苷对大鼠脑梗死面积的影响(n=10,±s)

表2 绞股蓝总皂苷对大鼠脑梗死面积的影响(n=10,±s)
与模型组比较**P<0.01,*P<0.05;与假手术组比较++P<0.001
?
2.4 HE染色结果
光镜下假手术组大鼠脑皮质神经元胞体呈圆形,胞核规整,染色质分布均匀,胞膜完整,胞质无明显嗜伊红染色;模型组变性坏死的神经元主要分布在大脑皮层,缺血坏死区脑组织水肿、疏松,可见大量神经元胞体为三角形,核固缩,核溶解,核仁消失,胞质嗜伊红染色,细胞周围间隙增宽,水肿空泡形成,神经元间隙扩大;绞股蓝总皂苷100mg·kg-1剂量组可见脑皮质局限性坏死灶,区域内脑组织结构水肿,疏松,可见少量神经元胞体呈三角形,胞质嗜伊红染色;阳性对照药血塞通组病理改变与绞股蓝总皂苷高剂量组相近;绞股蓝总30mg·kg-1剂量组较多神经元胞体呈三角形,胞质嗜伊红染色;绞股蓝总皂苷10mg·kg-1剂量组脑皮质区可见局限性坏死灶,神经元胞体呈三角形,胞质嗜伊红染色,结果见图2。
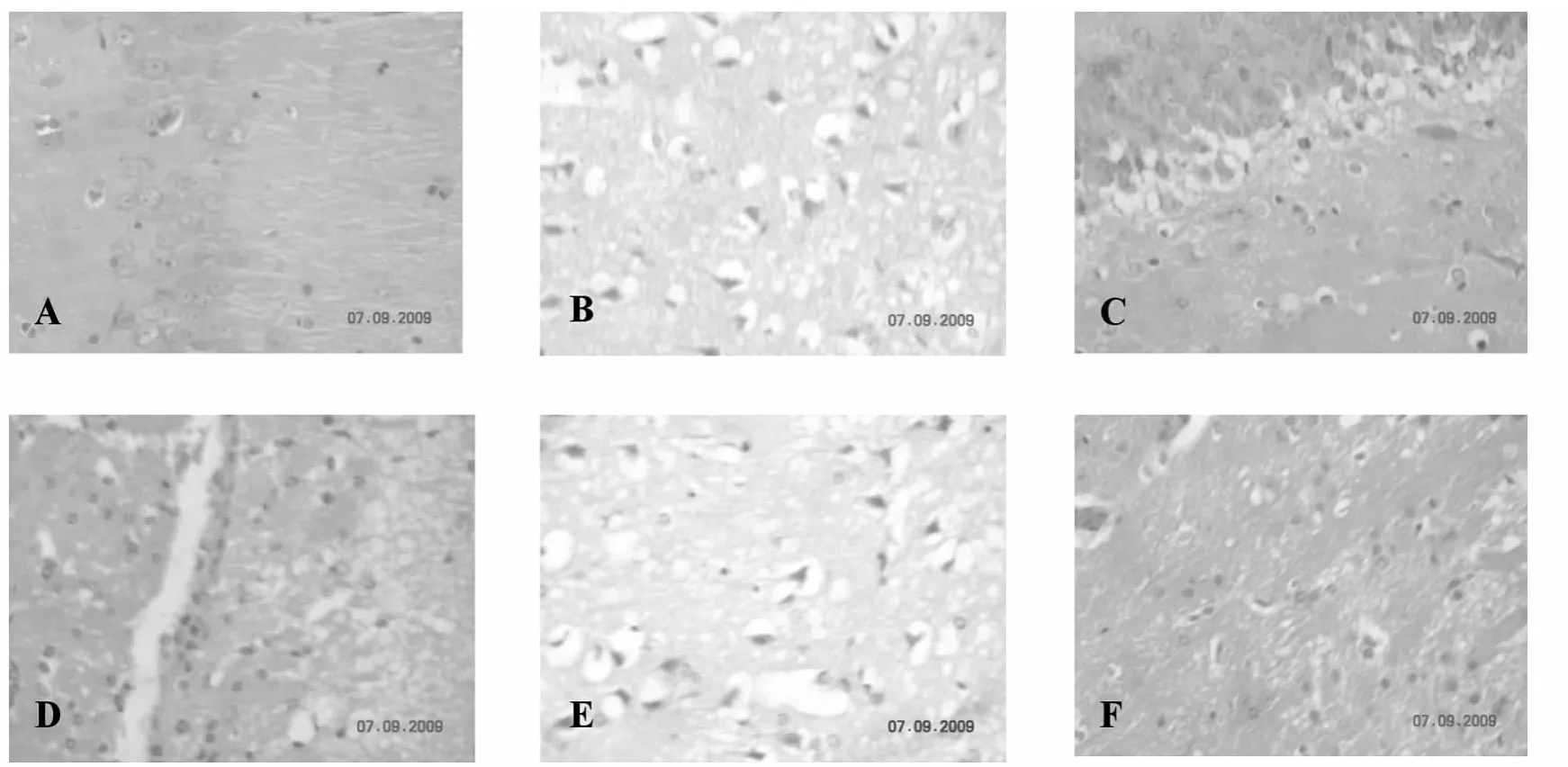
图2 绞股蓝总皂苷对脑缺血再灌注损伤大鼠脑组织HE染色的影响 (200×)
2.5 免疫组化染色结果
结果显示,光镜下观察细胞浆中有棕黄色颗粒者为阳性细胞,结果见表3。
表3 用免疫组化方法检测绞股蓝总皂苷对Bcl-2和Bax蛋白表达的影响(n=10,±s)
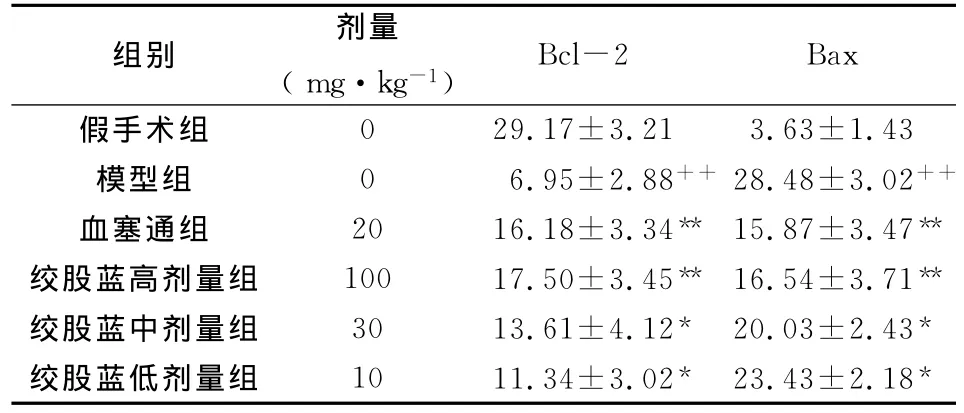
表3 用免疫组化方法检测绞股蓝总皂苷对Bcl-2和Bax蛋白表达的影响(n=10,±s)
与模型组比较**P<0.001,*P<0.05;与假手术组比较++P<0.001
?
3 讨论
大脑的正常功能活动依赖于血液的供应,当脑组织缺血时,会损伤神经细胞的功能,甚至造成不可逆的损伤。研究发现,脑组织在缺氧或缺血性损伤时能够产生大量的氧自由基。神经细胞膜中蛋白质、脂质因自由基的影响而遭到破坏,引起脂质过氧化,线粒体功能丧失、溶酶体破裂、以及组织水肿等一系列损害作用。SOD具有清除超氧阴离子,保护细胞膜,抗氧化等作用[7]。MDA是脂质过氧化反应中的代谢产物,通过检测 MDA含量可以预知机体中自由基的含量及自由基造成的损伤程度[8]。NO是一种新型自由基,脑缺血时大量产生将引起蛋白质、脂质以及DNA损伤的氧化应激,最终造成神经细胞死亡。
本实验结果显示,绞股蓝总皂苷可使脑缺血再灌注大鼠的行为指标评分明显降低,脑组织匀浆中SOD水平升高,MDA及NO的含量降低,减少脑梗死面积,形态学结果显示,绞股蓝总皂苷能够减轻脑组织水肿,改善神经细胞损伤,使空泡减少,表明绞股蓝总皂苷可减轻脑缺血再灌注所造成的损伤,改善脑功能。
Bcl-2蛋白及其家族成员通过一个非常复杂的网络来调控细胞的凋亡。Bcl-2蛋白家族分为2类:一类是抗凋亡的蛋白,包括Bcl-2、Bcl-w、Bcl-xL;另一类是促进凋亡的蛋白,主要有Bax、Bad、Bak。Bcl-2蛋白可作为氧化剂调节细胞的氧化还原状态,通过减少氧自由基的产生,减少Ca2+的释放,维持Ca2+的稳定而对抗细胞的凋亡。Bax蛋白在受到凋亡信号刺激时其构象会发生变化,导致细胞色素C释放,从而引起凋亡,所以Bcl-2/Bax比值高,细胞存活率高,比值低,细胞凋亡率高[9-10]。
本实验结果显示,假手术组可见Bcl-2表达的阳性细胞和少量的Bax表达的阳性细胞;模型组Bcl-2蛋白表达强度显著低于假手术组,Bax蛋白表达强度显著高于假手术组。而绞股蓝总皂苷各组Bcl-2蛋白表达明显高于模型组,Bax蛋白表达明显低于模型组,因而Bcl-2/Bax二者比例提高,说明绞股蓝总皂苷对大鼠脑缺血再灌注损伤的保护作用是通过在转录及翻译水平调节Bcl-2和Bax的表达实现。本实验结果将为临床脑缺血患者的治疗方面提供新思路,并为今后绞股蓝总皂苷应用于临床提供实验依据。
[1]陈剑雄,等.绞股蓝总皂甙对氧自由基所致脑血管痉挛的保护作用[J].中草药1997,24(4):219.
[2]Satoh I,Sakai N,Enokido Y,Uchiyama Y.Free radical independent protection by nerve growth factor and Bcl-2of PC12cells from hydrogenperoxidetriggered-apoptosis[J].Journal of Biochemistry,2002,20(4):320.
[3]Chen J,Zhu RL,Nakayama M.Expression of the apoptosis-effector gene,Bax,is upregulated in vulnerabl hippocampal CA1 neurons following global ischemia[J].J Neuron chem,1998,67(6):64.
[4]Fjimura M,Morita-Fujimura Y,Noshita N,et al.The cytosolic antioxidant copper/zinc-superoxide dismutase prevents the early release of mitochondrial cytochrome c in ischemic brain after transient focal cerebral ischemia in mice[J].J Neurosci,2000,20(8):2817.
[5]Loucks EB,Godin DV,Wallet'KR,et al.Role of platelet activating factor in cardiac dysfunction,apoptosis and nitric oxide synthase mRNA expression in the ischemic-reperfused rabbit heart[J].Can-J-Cardiol,2003,19(3):267.
[6]Fliss H,Gattinger D.Apoptosis in ischemic and reperfused rat myocardium [J].Circ Res,1996,79(5):949.
[7]Kristain T,Siesjo BK.Calcium-related damage in ischemia[J].Life Sci,1996,59(5):357.
[8]章军建,阮旭中,张苏明.大鼠局灶性脑缺血再灌注半暗带神经细胞坏死与凋亡的动态变化[J].中华老年医学杂志,1999,18:168.
[9]Qi J,Hong ZY,Xin H,Zhu YZ,et al.Neuroprotective effects of leonurine on ischemia/reperfusion-induced mitochondrial dysfunctions in rat cerebral cortex[J].Biol Pharm Bull.2010;33(12):1958.
[10]Chen J,Huang RB.Protective effect of Yulangsan polysaccharide on focal cerebral ischemia/reperfusion injury in rats and its underlying mechanism[J].Neurosciences(Riyadh).2009;14(4):343.

