真空紫外光电离质谱研究稻壳和稻秆的热解
孙韶波,翁俊桀,贾良元,王 毓,齐 飞,周忠岳
(中国科学技术大学国家同步辐射实验室,安徽 合肥 230029)
生物质能源是一种广泛存在的可再生能源,由于化石能源的日益枯竭及其带来的环境污染等问题,生物质能源的开发和利用越来越受到人们的重视。作为农业大国,我国生物质能资源十分丰富,开发前景广阔[1-2]。生物质可以通过热解转化为生物油、碳和可燃气3类能源产品,其中生物油被认为是今后化石能源的主要替代品[3]。但由于生物油的低热值、热不稳定以及成分不均等缺点,目前还不能得到大规模地推广应用[4]。因此,有必要通过探究生物质热解机理,以提高生物质油的产量并改进其品质。
传统的生物质热解研究主要是通过热重等分析方法来进行定量分析[5],这种方法只能从宏观上了解生物质热解的基本过程,而对于热解过程中的反应和产物无法进行实时地检测,所以得到的信息有限。而质谱技术以其检测速度快、检测精度和灵敏度高等优点,已经被广泛应用于生物质热解研究[6]。
同步辐射真空紫外光具有光子通量高、能量分辨高、可调节的宽光子能量范围等优点,将其与质谱技术相结合,通过选择合适的光子能量,可以获得只含有分子离子峰的谱图,避免了电子轰击电离等其他电离方式易产生离子碎片的缺点[7]。正因为这些优点,此技术已经成功应用于火焰探测[8]、有机分析[9]、化学成像及气溶胶分析[10]等复杂体系的研究。
本工作选取稻壳和稻秆生物质作为研究对象,利用同步辐射光电离质谱技术研究稻壳和稻秆的热解过程,并对实验结果进行分析。
1 实验方法
稻壳和稻秆的热解实验在国家同步辐射实验室完成。实验中使用同步辐射产生的真空紫外光作为电离源,使用一台改造后的Q-star pulsar i型三重四极杆飞行时间质谱仪(AB Sciex)检测热解产物[11]。改造后的Q-star主要由热解区、三重四极杆和飞行时间质谱3部分组成,三重四极杆主要功能是对离子进行冷却聚焦以及选择,反射式飞行时间质谱负责对热解产物进行检测辨析。Q-star前端联接的是自制的热解装置,主要分为3个区域:1)热解区,包括热解炉(岛津PYR-2A)、不锈钢进样杆以及取样锥等,炉子与进样杆之间用石英管隔绝以防止加热丝积碳;2)光电离区,同步辐射真空紫外光由侧面引入,与取样锥的中心轴线垂直相交,交点尽量靠近取样锥孔以获得最佳的离子传输效率。取样锥的前端装有一块带正电位的金属推斥板,用于将光电离产生的离子推送进入后级取样锥;3)质谱联接区,既热解装置与Q-star质谱相联接的部分。由于质谱工作时的真空环境与电离区的真空环境不同,所以需要通过取样锥来起到差分的作用。实验时,稻壳或稻秆样品放置在不锈钢进样杆前端的舟型凹槽中,经过一个自制的手动进样口进入热解炉的中心区域,每次进样(20±0.1)mg。热解区内通入高纯氮气,热解压力维持在373.3Pa。热解产生的气态产物通过取样锥形成分子束进入到电离区,并与真空紫外光垂直相交,中性物种被电离成离子。形成的离子束通过后级取样锥进入到联接区,随后由Q-star对产物离子进行冷却聚焦并检测。
为便于准确选取热解温度范围,实验前对稻壳和稻秆进行了热重分析。热重分析采用美国TA公司的Q500IR分析仪,每次进样(8±1)mg,升温速率分别为10、30、50℃/min,温度均由室温升至800℃。升温过程中通入高纯氮气进行保护,流量设定在75mL/min。
实验过程通过改变热解温度和光子能量的方法来获得不同条件下样品的热解实验数据,选取的实验温度为400、500、600℃,每个温度下调整光子能量在9.0、9.5、10.5、12.0eV 时,分别采集一组实验数据。
实验所用的稻壳和稻秆来自福建三明,实验前经过晾晒处理。样品中几种主要元素由元素分析仪进行分析,结果列于表1。
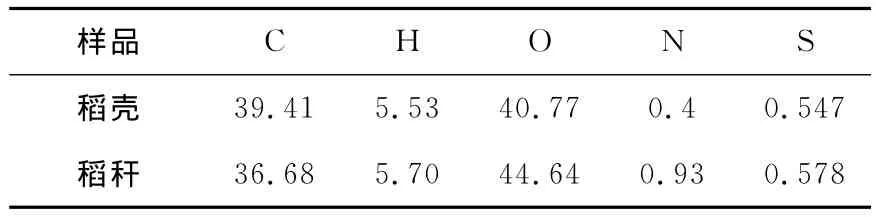
表1 稻壳和稻秆的元素组成 (wt%)Table 1 Element compositions of rice husk and rice straw (wt%)
2 结果与讨论
2.1 主要产物鉴定
将温度固定在400℃,改变光子能量获得的稻壳和稻秆热解产物的一系列质谱图示于图1。当光子能量为9.0eV时,由于热解产物的电离截面较小,探测到物种的信号强度较低。此外,部分电离能较高的物种在此光子能量下没有被电离,例如,羰基碎片 C2H3O(m/z43),其电离能为10.2eV。当光子能量提高到10.5eV时,由于物种电离截面的增大,质谱信号强度增强。当光子能量提高到12.0eV,由于电离效率基本达到饱和,质谱的信号强度变化不大。与此同时,高光子能量下杂质峰的强度在一定程度上增强了。综合来看,光子能量在10.5eV时可获得较为理想的热解产物质谱图。

图1 在400℃时,不同光子能量下的稻壳和稻秆的热解产物质谱图Fig.1 Mass spectra of pyrolysis products of rice husk and rice straw at 400 ℃
一般认为,生物质主要是由木质素、纤维素、半纤维素等几种物质构成[12],对于不同的生物质,这几种基本组成物的比重会有所不同,从而表现出不一样的热解特性。判断质谱峰归属的方法已经在之前的报道中介绍过[11,13-15],可以据此对图1中的一些主要产物进行判别。选取热解温度400℃,光子能量10.5eV时获得的稻壳与稻秆的热解质谱图作为参考,对主要热解产物进行对比分析。从图1b和1e中可以直观地看到这两种样品热解的主要产物及分布,详细信息列于表2。图1中m/z120的物种是乙烯基苯酚,它是一种稻科类植物木质素的主要小分子产物[16]。m/z150是4-乙烯基愈创木酚,属于木质素的热分解产物,此外还有松柏醇(m/z180)和4-丙烯基紫丁香醇(m/z194)。m/z126是呋喃甲醛衍生物,具有两种可能的同分异构体。m/z114是木聚糖的热裂解产物,同时也是草本及阔叶树的一个重要产物[13]。5-甲基糠醛(m/z110)和愈创木酚(m/z124)是木质素的二次裂解产物。甲基愈创木酚(m/z138)是木质素的次级小分子产物,主要在后期生成。C16H16O4(m/z272)也是来自于木质素的分解,是生物质热解中比较常见的大分子产物之一,一般来说,其在硬木中的产量要少于软木[13]。其余的一些小分子奇数峰主要是热解过程中的离子碎片,例如m/z43是很常见的羰基离子碎片,而m/z57是常见的糖类离子碎片。
对比图1发现,稻壳与稻秆的主要热解产物的种类基本一致,这表明,虽然水稻植物的不同部位的形貌和质地结构有显著差异,但它们的基本化学组分的种类大致相同。图1中的质谱图在处理数据时对光强、进样量进行了归一,质谱峰的强度可以粗略反应热解产物的相对丰度。稻壳和稻秆的主要差异在于一些质谱峰的相对丰度有所差别,例如稻壳的热解产物中,愈创木酚(m/z124)、4-乙烯基愈创木酚(m/z150)以及C16H16O4(m/z272)的丰度明显高于稻秆,而以上这几种产物主要都是来源于木质素的分解,可以推测稻壳中的木质素含量相对于稻秆更高。

表2 稻壳、稻秆的主要热解产物Table 2 Main pyrolysis products of rice husk and rice straw
2.2 温度对热解产物的影响
温度是影响生物质热解过程的一个重要参数,不同热解温度下产物的种类和比例也会有一定的差异。在进行光电离质谱实验前,先做了稻壳和稻秆的热重分析。
稻壳和稻秆在升温速率为10℃/min时获得的热重分析曲线示于图2。从图2可以看到,稻壳和稻秆的热失重过程非常相近,大致可以分为3个阶段:37~200℃温区为干燥阶段,该阶段是游离水、物理吸附水以及分子中的结晶水等[17]水分的挥发和脱除的过程;200~420℃温区为快速热解阶段,在此过程中,纤维素和半纤维素等一些分解温度较低的组分经历了快速的受热分解,产生大量的小分子挥发性产物;420~800℃温区为慢速热解阶段,主要对应于木质素的热解以及碳的生成过程。从单一的热重曲线图中无法直接看出这两种样品在热解过程中的差异,需要进一步对比它们的产物质谱图。微分热重曲线(DTG)表明,在400℃之前,纤维素和半纤维素经历了迅速而又充分的分解,其分解速度在300℃左右达到峰值,而木质素在400℃之后却有一个缓慢而长期的分解过程。一般来说,不同生物质所含木质素的种类和比重差别较大而且结构复杂,所以不同生物质之间的热解过程差别主要体现在木质素的热解过程上。

图2 稻壳(a)、稻秆(b)的热重分析曲线Fig.2 TG and DTG spectra of rice husk(a)and rice straw(b)
为了着重考察纤维素、半纤维素以及木质素在主热解区间的分解过程,结合热重曲线的分析结果选取光子能量在10.5eV,热解温度分别为300、400、500、600 ℃时的一系列质谱图进行对比分析。将主要热解产物的质谱信号强度经过归一化处理后,得到了更加直观的热解产物随温度的变化关系,示于图3。
图3a和3b中,随着温度升高,m/z126物种的相对丰度先升高,400℃后又显著减少。m/z126有两种可能的同分异构体,其中之一5-羟甲基-2-糠醛是一种初级热解产物,来源于纤维素的热解,在高温时容易发生二次分解;另一种是2-甲基-3-羟基-4-吡喃酮,其化学性质相对稳定。图3c中稻壳的几种半纤维素产物具有随温度升高而减少的趋势,与其相反,这几种产物在图3d稻秆变化图中却呈现上升的趋势。导致这种差异的原因是稻壳中的半纤维素开始分解温度更低、分解速度较快,m/z96、m/z114等热解产物在300℃左右大量生成,但从400℃开始产量又显著减少。同时从图3d中相对应的几种热解产物相对丰度以及随温度的变化趋势来看,稻秆中的半纤维素含量更高,而且在400℃左右才发生大量的分解。木质素的热解是一个缓慢而长期的过程,图3e和3f的产物变化趋势也印证了这一结论。木质素的几种主要小分子热解产物如m/z124、138、150等随温度升高有比较明显的增加趋势,当温度高于600℃之后,木质素的热分解过程趋于完成,大多数热解产物产量不再继续增加,甚至有部分产物由于发生了二次分解而略有减少。m/z272物种在低温下容易生成,但因其化学性质相对稳定,在高温下难以分解,所以随温度的变化不大。总体看来,400~500℃是稻壳和稻秆的初级热解过程基本完成,温度继续升高时,部分产物开始发生二次分解[18]。
2.3 热解产物随时间变化的关系
生物质不同组分在热稳定性上各不相同,因此它们的分解温度以及分解速度也会有所差异。根据某些特征热解产物随时间变化的谱图,可以间接了解稻壳的受热分解过程。由于稻壳和稻秆的组分类似,仅以稻壳为例进行分析。
图4是稻壳在热解温度500℃和10.5eV光子能量下的热解产物随时间变化谱图,实验中得到了若干特征产物随时间变化的谱图[19]。其中,m/z114是木聚糖的分解产物,而木聚糖又来自于半纤维素的分解。乙烯基苯酚(m/z120)、5-甲基 糠醛 (m/z110)、愈 创木酚(m/z124)和甲基愈创木酚(m/z138)是木质素分解的重要小分子产物,它们的离子流强度从侧面反映了木质素的分解情况。从图4可以看出,与其他木质素小分子产物相比,m/z120产生的最早,演变属性类似于木质素前驱单体[13]。紧随其后的是m/z114,说明半纤维素的分解温度相对较低,分解速度较快。而m/z110、124以及m/z138的峰值比较靠后,都在1.25min左右,而且整个峰形跨度大,它们是木质素的主要分解产物,主要在热解过程的后期生成,而且时间谱图横跨了很大一部分温度区间。此外,特别注意到m/z124和m/z138的时间变化谱图中存在两个峰值,这很可能是因为它们一方面在前期低温条件下由木质素直接热解生成,另一方面还能通过高温条件下其它产物的二次分解而得到。目前对于二次产物的区分主要是将温度作为衡量标准,直接产物的生成温度较低,而二次产物一般在相对较高的温度区间大量产生。如图4中愈创木酚(m/z124)在前期直接生成较多,后期也有少部分作为次级产物生成。与此相反,甲基愈创木酚(m/z138)很可能主要来自于二次分解。半纤维素主要由木聚糖、葡萄糖、半乳糖等各种糖类组成,是具有无定形结构并富含分支的复杂聚合物,这些分支在受热时非常容易脱离并降解为CO、CO2等可挥发物。木质素含有大量具有不同分支结构的苯环,而这些分支的化学键活性范围极其广泛,从而导致木质素的分解温度区间跨度很长[20]。对于大多数木质素小分子产物形成普遍较晚的原因,一种观点认为,随着烯芳香类化合物的早期分解,大量的木质素缺少氢供体。一部分的分子键在缺氢的基础上断裂,并经历了缩合反应,伴随着热解过程从而形成了更加耐高温的固体,经过进一步的氢转移液化作用,形成愈创木酚等稳定的芳香族化合物[13]。不过由于木质素的结构非常复杂[21],其热解机理到目前还尚不明确,需要更进一步的研究探索。

图3 归一化后的稻壳、稻秆热解产物随温度变化图Fig.3 Comparision of normalized intensity of pyrolysis products of rice husk and rice straw at different temperatures
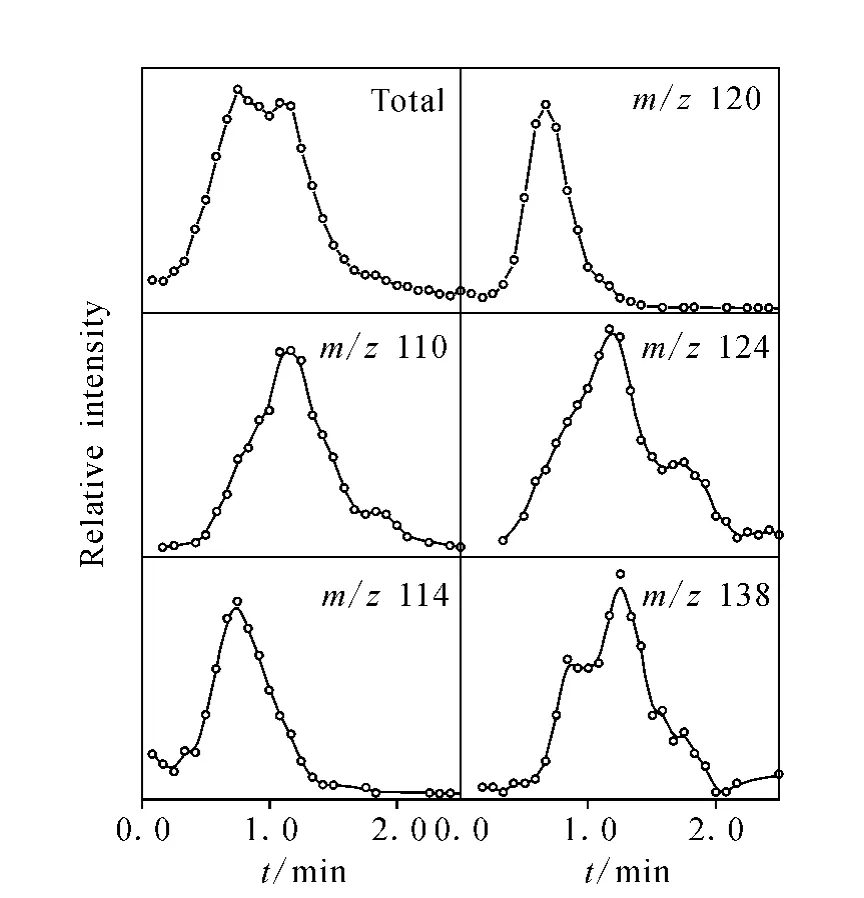
图4 在500℃,10.5eV时,稻壳热解产物随时间变化谱图Fig.4 Time-dependent profiles of rice husk pyrolysis product at 500 ℃ and 10.5eV
3 结论
本工作利用同步辐射真空紫外光电离质谱研究了稻壳和稻秆两种生物质的热解过程。通过改变光子能量,获得了一系列质谱图,并据此对稻壳和稻秆的主要热解产物进行了鉴定。
稻壳和稻秆的热重曲线非常相近,整个过程经历了干燥失水,纤维素和半纤维素的快速热解以及木质素的分解及碳化等3个阶段。对比二者的质谱数据可以发现,随着温度的升高,稻壳和稻秆热解产物的变化趋势存在较大差异,主要体现在半纤维素的热解过程上。总体来看,在400~500℃时,稻壳和稻秆的初级热解过程已经完成,更高的温度会导致初级热解产物的二次热解。热解产物随时间的变化关系反映了生物质内部不同组分的受热分解特性。实验结果表明,半纤维素和部分木质素分解温度较低,分解速度也较快。而大部分木质素产物的形成时间都相对较晚,而且时间跨度很长,伴随着整个热解过程。研究结果直观地反映了各种热解产物的种类分布以及形成时间,有助于推测和验证一些可能的反应机理。
[1] 陈益华,李志红,沈 彤.我国生物质能利用的现状及发展对策[J].农机化研究,2006,(1):25-27.
[2] 孙永明,袁振宏,孙振钧.中国生物质能源与生物质利用现状与展望[J].可再生能源,2006,(2):78-82.
[3] 柏 杰.发展生物柴油大有可为[J].中国科技产业,2002,(9):63-64.
[4] BRIDGWATER A V.Principles and practice of biomass fast pyrolysis processes for liquids[J].Journal of Analytical and Applied Pyrolysis,1999,51(1/2):3-22.
[5] 宋春财,胡浩权,朱盛维,等.生物质秸秆热重分析及几种动力学模型结果比较[J].燃料化学学报,2003,(4):311-316.
[6] BAHNG M K,MUKARAKATE C,ROBICHAUD D J,et al.Current technologies for analysis of biomass thermochemical processing:A review[J].Anal Chim Acta,2009,651(2):117-38.
[7] 齐 飞.同步辐射真空紫外单光子电离技术及其应用[J].中国科学技术大学学报,2007,(Z1):414-425.
[8] FEI Q.Combustion chemistry probed by synchrotron vuv photoionization mass spectrometry[J].Proc Combust Inst,2012,34(accepted).
[9] PAN Y,ZHANG L,GUO H,et al.Photoionisation and photodissociation studies of nonvolatile organic molecules by synchrotron vuv photoionisation mass spectrometry and theoretical calculations[J].International Reviews in Physical Chemistry,2010,29(2):369-401.
[10] FANG W Z,GONG L,SHAN X B,et al.Ther-mal desorption/tunable vacuum-ultraviolet timeof-flight photoionization aerosol mass spectrometry for investigating secondary organic aerosols in chamber experiments[J].Analytical Chemistry,2011,83(23):9 024-9 032.
[11] WENG J,JIA L,WANG Y,et al.Pyrolysis study of poplar biomass by tunable synchrotron vacuum ultraviolet photoionization mass spectrometry[J].Proceedings of the Combustion Institute,2012,34 (in press,DOI:10.1016/j.proci.2012.05.077,2012).
[12] 朱锡锋.生物质热解原理与技术[M].合肥:中国科学技术大学出版社,2006.
[13] EVANS R J,MILNE T A.Molecular characterization of the pyrolysis of biomass.1.Fundamentals[J].Energy &Fuels,1987,1(2):123-137.
[14] FAIX O,MEIER D,FORTMANN I.Gas chromatographic separation and mass spectrometric characterization of monomeric lignin derived products[J].Holz als Roh-und Werkstoff,1990,48(7/8):281-285.
[15] HODGSON E M,NOWAKOWSKI D J,SHIELD I,et al.Variation in miscanthus chemical composition and implications for conversion by pyrolysis and thermo-chemical bio-refining for fuels and chemicals[J].Bioresour Technol,2011,102(3):3 411-3 418.
[16] SIMONEIT B R T,ROGGE W F,MAZUREK M A,et al.Lignin pyrolysis products,lignans,and resin acids as specific tracers of plant classes in emissions from biomass combustion[J].Environ Sci Technol,1993,27(12):2 533-2 541.
[17] 王述洋.生物质热解动力学建模及锥式闪速热解装置设计理论研究[D].哈尔滨:东北林业大学,2002.
[18] LI R,ZHONG Z P,JIN B S,et al.Influence of reaction conditions and red brick on fast pyrolysis of rice residue(husk and straw)in a spout-fluid bed[J].Canadian Journal Of Chemical Engineering,2012,90(5):1 202-1 211.
[19] EVANS R J,MILNE T A.Molecular characterization of the pyrolysis of biomass.2.Applications[J].Energy &Fuels,1987,1(4):311-319.
[20] YANG H,YAN R,CHEN H,et al.Characteristics of hemicellulose,cellulose and lignin pyrolysis[J].Fuel,2007,86(12/13):1 781-1 788.
[21] REALE S,DI TULLIO A,SPRETI N,et al.Mass spectrometry in the biosynthetic and structural investigation of lignins[J].Mass Spectrometry Reviews,2004,23(2):87-126.

