丹酚酸A对实验性肺纤维化大鼠的保护作用研究
孔 勤,刘瑞敏,寿旗扬,肖 颖,朱科燕,陈民利
(浙江中医药大学动物实验研究中心 比较医学研究中心,杭州 310053)
肺纤维化(pulmonary fibrosis)是一种慢性、进行性、不可逆转的间质性肺疾病,也是最常见的一种肺部疾病,主要以肺泡上皮损伤、成纤维细胞大量异常增生和细胞外基质聚集增多为病理特征。临床症状主要表现为干咳、呼吸困难,后期多死于呼吸衰竭。流行病学研究表明,该病病因各异,发病机制不清,导致近年全球发病率呈现不断上升趋势,预后较差,死亡率较高,且目前缺乏行之有效的治疗方法[1]。因此寻找有效的治疗药物对于肺纤维化的防治就显的十分重要。
丹参(salvia miltiorrhiza Bunge)为我国传统重要药用植物,为活血化瘀第一要药。丹酚酸 A(salvianolic acid A,SAA)是从丹参中提取的水溶性酚酸类成分,也是其主要活性成分之一。现代基础研究发现,SAA具有多种药理作用,如抗氧化,抑制血栓形成,保护血管内皮细胞等[2-4],且对于防止纤维发生类似的药理作用亦有相关报道[5]。为了有效开发中药的现代化应用,本文主要观察SAA对博来霉素诱导的肺纤维化大鼠模型的保护作用并初步探究其可能机制。
1 材料和方法
1.1 实验动物与饲养环境
SPF级6~7周龄 Wistar雄性大鼠,体重200~220 g,60只,来源于中国科学院上海实验动物中心/上海斯莱克实验动物有限公司,生产许可证:[SCXK(沪)2008-0016];饲养于浙江中医药大学动物实验研究中心屏障环境[SYXK(浙)2008-0115]。
1.2 实验主要试剂与仪器
丹酚酸A粉针剂,北京本草天源药物研究院提供(批号:100611);氢化可的松注射液,山西晋新双鹤药业有限责任公司(批号:201001285);注射用盐酸博莱霉素(Bleomycin,BLM),日本化药株式会社(批号:Y91450);超氧化物歧化酶(Superoxide dismutase,SOD)、丙二醛(Malondialdehyde,MDA)及谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)试剂盒(批号:201000504);Allegra X-15R大容量离心机,美国贝克曼公司;MPA肺功能分析系统,上海奥尔科特生物科技有限公司;ALC压力传感器,上海奥尔科特生物科技有限公司;STP120组织脱水机、AP280包埋机、HM335E半自动石蜡切片机、Leica ST5010染色剂,美国 MICROM公司;尼康80I相差显微镜,日本 NIKON公司;Carl Zeiss Imaging Systems,德国 ZEISS公司;HITACHI-7650型透射电镜,Hitachi公司。
1.3 动物分组与模型制备
Wistar大鼠适应性饲养1周后编号,按体重分层随机分为6组,即正常对照组、模型组、丹酚酸A低(2.5 mg/kg)、中(5 mg/kg)、高(10 mg/kg)剂量组、阳性对照组,每组10只。参照 Li等[6]方法进行造模,正常对照组外,其余各组乙醚诱导麻醉,分离并暴露气管,缓慢刺入气管注入0.1 mL BLM(5 mg/kg)生理盐水溶液,造模后第2天开始给药,阳性对照组尾静脉注射给予剂量为5 mg/(kg·bw)的氢化可的松注射液,模型组和正常对照组尾静脉注射给予生理盐水10 mL/(kg·bw),每日一次,连续28 d。
1.4 肺指数的测定
大鼠麻醉后,取血,迅速取肺脏,用生理盐水洗去血迹,剥净表面粘连组织,滤纸吸干表面血液后,称重,并计算脏器指数。

1.5 自由基测定
处死动物,迅速打开腹腔,行腹主动脉取血,3 000 rpm离心10 min,分离血清,按试剂盒测定血清SOD和GSH-Px活性,MDA含量。
1.6 肺功能测定
大鼠麻醉后固定于鼠台,剪去颈部手术野毛,切开皮肤及肌层,分离气管,在气管上端剪一倒“T”字切口,插入“Y”型气管插管,固定结扎。注意气管插管要尽量靠近头端,以免插管时损伤气管隆凸或进入一侧肺。连接系统,待信号良好波形稳定后开始数据采集及分析,连续记录10 min。
1.7 肺组织苏木精-伊红(hematoxylin and eosin,HE)染色
取各组肺组织,10%中性甲醛固定,乙醇脱水,二甲苯透明,石蜡包埋,切片,进行HE染色。
1.8 肺组织透射电镜的观察
取大鼠左肺,从不同部位取3小块组织,2.5%戊二醛和1%锇酸双重固定,乙醇系列脱水,包埋,超薄切片。电镜观察。
1.9 数据统计学处理
2 结果
2.1 一般情况观察
正常大鼠精神状态良好、活泼好动、皮毛光泽发亮,体重日渐增加,呼吸平稳;模型对照组精神不振,行动迟缓,皮毛枯槁、无光泽、多见皮毛倒立,身体较其他组消瘦,呼吸急促;给药组及阳性对照组精神状态良好、行动相对灵活,饮食较好,毛发较润泽,状态较好于模型对照组。
2.2 丹酚酸A对博来霉素诱导的肺纤维化大鼠体重及肺指数的影响
通过气道给予博来霉素复制大鼠纤维化模型后,大鼠体型消瘦,体重增加缓慢,与正常组相比有显著性差异(P<0.05);给予丹酚酸 A后状态较好于模型组,体重增加略高于模型组动物,但均不具有显著性差异;给予丹酚酸A后肺指数均较模型组有下降趋势(图1,彩插3)。
2.3 丹酚酸A对博来霉素诱导的肺纤维化大鼠血清自由基代谢的影响
由图2可知,模型对照组大鼠血清中MDA含量显著升高,SOD与GSH-Px的活性显著降低,表明大鼠体内自由基代谢出现异常,有氧化应激反应,给予SAA50,各组大鼠具有不同程度的恢复,提示丹酚酸A能够增加氧自由基清除剂的含量,抑制体内脂质过氧化过程,降低脂质过氧化产物含量,降低氧自由基代谢产物的损害,达到调节氧化/抗氧化系统平衡的作用,从而使机体细胞和组织免受损害,表明丹酚酸A可能是通过此机制一定程度缓解肺纤维化引起的损伤。
2.4 丹酚酸A对博来霉素诱导的肺纤维化大鼠肺
功能的影响
本实验结果发现,造模4周后,大鼠各项肺功能均较正常组有下降,可能是由于肺间质存在大量成纤维细胞,导致呼吸不畅和限制性通气功能障碍。由表2可知,造模后肺纤维化大鼠潮气量(tidal volume,Vt)、每分钟通气量(minute ventilation,Ve)有显著的下降,给予丹酚酸A后Vt和Ve有明显增加;呼吸频率(respiratory frequency,RF)亦有下降,但无显著性差异。此外,与模型组大鼠相比,丹酚酸A还可改善肺纤维化大鼠吸气峰值流速(peak flow of inspiration,PIF),呼气峰值流速(peak flow of expiration,PEF),吸入75%和25%潮气量时吸气和呼气流速见表3~5。
表1 丹酚酸A对肺纤维化大鼠自由基SOD、MDA及GSH-Px的影响(±s,n=10)Tab.1 Effects of SAA on SOD、MDA and GSH-Px of pulmonary fibrosis rats

表1 丹酚酸A对肺纤维化大鼠自由基SOD、MDA及GSH-Px的影响(±s,n=10)Tab.1 Effects of SAA on SOD、MDA and GSH-Px of pulmonary fibrosis rats
注:与正常对照组比较,ΔP <0.05,ΔΔP <0.01;与模型对照组比较,*P <0.05,**P <0.01。Note:ΔP <0.05 and ΔΔP <0.01vs.control group;*P <0.05 and **P <0.01 vs.BLM group.
对照组 (Control) Saline,10 mL/kg 199.37±10.79 2.06±0.32 1074.16±152.64博来霉素 (BLM) Saline,10 mL/kg 186.47±8.66Δ 3.53±0.51ΔΔ 833.69± 81.00ΔΔ丹酚酸 A(SAA) 10 mg/kg 192.84 ±9.76 2.92 ±0.38** 919.37 ± 65.87*丹酚酸 A(SAA) 5 mg/kg 198.35 ±6.97** 3.24 ±0.72 1031.22 ±117.4**丹酚酸 A(SAA) 2.5 mg/kg 195.18±5.84* 3.23±0.78 947.51± 91.49*氢化可的松 (HYD) 5 mg/kg 199.48 ±7.33** 3.05 ±0.42* 993.40 ±123.81**

注:Δ:与正常对照组相比P<0.05;*与BLM组相比P<0.05。图2 肺纤维化大鼠血清自由基的变化。Note:ΔP < 0.05 and ΔΔP < 0.01 vs.control group;*P <0.05 and **P <0.01 vs.BLM group.Fig.2 Changes of SOD,MDA and GSH-Px of bleomycin-induced pulmonary fibrosis rats.
表2 丹酚酸A对肺纤维化大鼠肺功能RF、Vt及Ve的影响(x±s,n=10)Tab.2 Effects of SAA on respiratory frequency,tidal volume,minute ventilation of pulmonary fibrosis rats

表2 丹酚酸A对肺纤维化大鼠肺功能RF、Vt及Ve的影响(x±s,n=10)Tab.2 Effects of SAA on respiratory frequency,tidal volume,minute ventilation of pulmonary fibrosis rats
注:与正常对照组比较,ΔP <0.05,ΔΔP <0.01;与模型对照组比较,*P <0.05,**P <0.01。Note:ΔP < 0.05 and ΔΔP <0.01vs.control group;*P < 0.05 and **P < 0.01 vs.BLM group.
对照组 (Control) Saline,10 mL/kg 161.08±36.70 0.976±0.189 158.01±51.13博来霉素 (BLM) Saline,10 mL/kg 136.79 ±22.28 0.393 ±0.065ΔΔ 53.91 ±13.83ΔΔ丹酚酸 A(SAA) 2.5 mg/kg 136.57 ±19.28 1.003 ±0.259** 132.40 ±41.57**丹酚酸 A(SAA) 5 mg/kg 141.04 ±19.18 1.074 ±0.206** 150.90 ±36.18**丹酚酸 A(SAA) 10 mg/kg 147.42 ±18.84 0.940 ±0.184** 137.03 ±26.23**氢化可的松 (HYD) 5 mg/kg 141.67 ±27.99 0.942 ±0.224** 132.74 ±42.34**
表3 丹酚酸A对肺纤维化大鼠肺功能PIF和PEF的影响(±s,n=10)Tab.3 Effects of SAA on peak flow of inspiration and expiration of pulmonary fibrosis rats

表3 丹酚酸A对肺纤维化大鼠肺功能PIF和PEF的影响(±s,n=10)Tab.3 Effects of SAA on peak flow of inspiration and expiration of pulmonary fibrosis rats
注:与正常对照组比较,ΔP <0.05,ΔΔP <0.01;与模型对照组比较,*P <0.05,**P <0.01。Note:ΔP < 0.05 and ΔΔP <0.01 vs.control group;*P < 0.05 and **P < 0.01 vs.BLM group.
10 mL/kg 11.101±3.186 9.141±2.386博来霉素 (BLM) Saline,10 mL/kg 3.426±0.911ΔΔ 4.568±1.007ΔΔ丹酚酸 A(SAA) 2.5 mg/kg 10.744 ±2.919** 7.641 ±2.553**丹酚酸 A(SAA) 5 mg/kg 12.332 ±3.874** 8.827 ±1.368**丹酚酸 A(SAA) 10 mg/kg 12.557 ±3.209** 7.569 ±2.092**氢化可的松 (HYD) 5 mg/kg 10.845±3.334** 7.820±1.911对照组 (Control) Saline,**
表4 丹酚酸A对肺纤维化大鼠肺功能IF75和IF25的影响(±s,n=10)Tab.4 Effects of SAA on inspiration flow 75%and 25%of pulmonary fibrosis rats

表4 丹酚酸A对肺纤维化大鼠肺功能IF75和IF25的影响(±s,n=10)Tab.4 Effects of SAA on inspiration flow 75%and 25%of pulmonary fibrosis rats
注:与正常对照组比较,ΔP <0.05,ΔΔP <0.01;与模型对照组比较,*P <0.05,**P <0.01。Note:ΔP <0.05 and ΔΔP <0.01vs.control group;*P <0.05 and **P <0.01 vs.BLM group.
10 mL/kg 8.846±2.776 10.677±2.869博来霉素 (BLM) Saline,10 mL/kg 2.045±0.525ΔΔ 3.158 ±0.863ΔΔ丹酚酸 A(SAA) 2.5 mg/kg 7.333 ±2.906** 10.803 ±2.492**丹酚酸 A(SAA) 5 mg/kg 8.587 ±2.442** 11.902 ±2.723**丹酚酸 A(SAA) 10 mg/kg 9.305 ±2.916** 11.271 ±2.755**氢化可的松 (HYD) 5 mg/kg 7.792±2.615** 9.810±2.781对照组 (Control) Saline,**
表5 丹酚酸A对肺纤维化大鼠肺功能EF75及EF25的影响(±s,n=10)Tab.5 Effects of SAA on expiration low 75%and 25%of pulmonary fibrosis rats

表5 丹酚酸A对肺纤维化大鼠肺功能EF75及EF25的影响(±s,n=10)Tab.5 Effects of SAA on expiration low 75%and 25%of pulmonary fibrosis rats
注:与正常对照组比较,ΔP <0.05,ΔΔP <0.01;与模型对照组比较,*P <0.05,**P <0.01。Note:ΔP <0.05 and ΔΔP <0.01 vs.control group;*P <0.05 and **P <0.01 vs.BLM group.
4.866±1.161 10 mL/kg 7.040±2.159 7.492±1.863博来霉素 (BLM) Saline,10 mL/kg 3.099±0.813ΔΔ 3.966±0.833ΔΔ丹酚酸 A(SAA) 2.5 mg/kg 5.450±1.604** 4.810±1.104丹酚酸 A(SAA) 5 mg/kg 5.877±1.921** 5.418±1.314*丹酚酸 A(SAA) 10 mg/kg 5.179±0.999** 4.555±0.793氢化可的松 (HYD) 5 mg/kg 4.846±1.117**对照组 (Control) Saline,
2.5 肺组织HE染色结果
正常对照组肺组织结构完整,肺泡内未见炎性细胞,肺泡间隔无充血、水肿及增厚;给予博来霉素的大鼠肺组织有着明显的病变,肺泡间隔增宽,有纤维结缔组织增生,肺泡壁破坏,内见淋巴细胞及中性粒细胞浸润,间质血管充血,文献报道一致,可判断模型成功。给予高、中、低剂量的丹酚酸 A和氢化可的松注射液后,肺泡间隔轻度增宽,有少量炎性细胞浸润,肺泡炎不明显(图3,彩插3)。
2.6 丹酚酸A对博来霉素诱导的肺纤维化大鼠组织透射电镜的影响
正常大鼠肺I型、II型上皮细胞无变性损伤和增生,基底膜延续、无中断;给予博来霉素造模后,大鼠Ⅱ型肺泡上皮细胞轻度增生,肺组织呈现空泡样变,纤维细胞增生,胶原纤维明显增多;基底膜增厚,间质巨噬细胞增多;给予不同剂量的丹酚酸A和氢化可的松注射液后,虽与模型组大鼠表现出基本一致的病理变化,但胶原沉积减少,肺泡型细胞微绒毛破坏、脱落,线粒体肿胀,但线粒体清晰可见(图4)。
3 讨论
肺纤维化是临床上较常见的一种肺间质疾病,发病机制复杂,尚不明晰,对人类健康危害极大,确诊后3~5年内大多死于呼吸衰竭,传统药物疗效不理想,目前除肺移植外没有确切可行的治疗方法[7]。肺纤维化动物模型是探讨肺纤维化机制以及筛选抗纤维化药物研究的重要实验材料和手段。博来霉素为弱碱性糖肽类抗生素抗肿瘤药物,临床上主要被用于治疗淋巴瘤;但其可严重损伤肺组织,造成急性肺损伤和间质类纤维疾病,故博来霉素多被用于复制动物肺纤维化模型,利用其研究纤维化发病机制和开发新药之用[8]。
研究表明肺纤维化的发生机制非常复杂,涉及有氧化应激,上皮细胞的损伤与修复,炎性细胞及相关细胞因子的释放及成纤维细胞的异常增生,由于肺纤维化的发生对于肺组织结构有着严重的破坏,与此同时会造成肺功能的失调,肺泡微环境紊乱,结构破坏。本实验研究发现,给予博来霉素后,体重增加缓慢,肺指数升高,且一般生理特征较正常组均有一定下降;给予不同剂量的丹酚酸 A后,体重明显增加,肺指数明显提高,肺通气得到有效缓解,肺功能得到明显改善,表明丹酚酸A可有效减轻博来霉素诱导的大鼠肺纤维化。此外,病理检测发现给予丹酚酸A后肺组织肺泡间隔变窄,炎症减轻,肺纤维程度有明显减弱;投射电镜结果表明丹酚酸A可保护肺泡上皮细胞,保护肺组织结构和减少胶原纤维等生成,尤其是胶原的生成,会充斥着整个肺泡间隙并严重破坏肺组织结构[9]。通过电镜结果进一步发现丹酚酸A对于保护上皮细胞以及抑制胶原纤维的生成有着较好的作用。
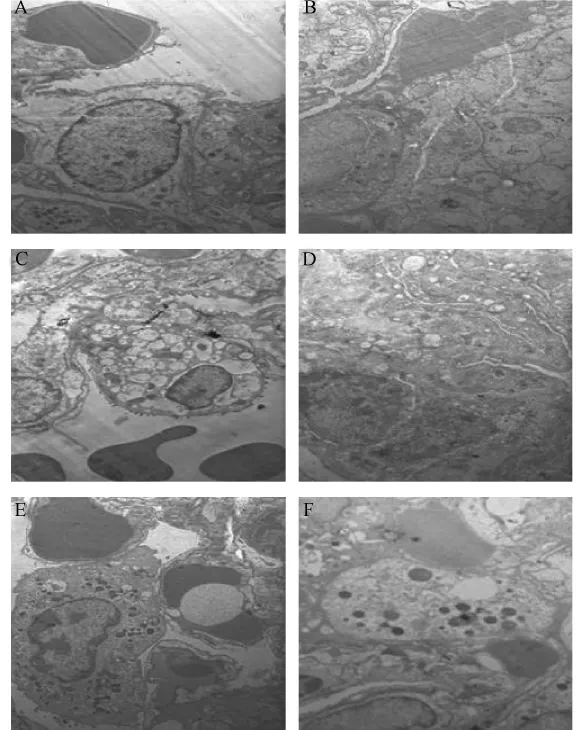
注:A:正常对照组 (×6000);B:模型对照组 (×5000);C:丹酚酸A高剂量组 (×5000);D:丹酚酸A中剂量组(×12000);E:丹酚酸A低剂量组 (×5000);F:阳性对照组 (×6000)。图4 肺纤维化大鼠肺组织透射电镜图Note:A:Controlgroup-Magnification×6000;B:BLM group-Magnification×5000;C:SAA(10 mg/kg)group-Magnification×5000;D:SAA(5 mg/kg)group-Magnification×12000;E:SAA(2.5 mg/kg)group-Magnification×5000;F:HYD group-Magnification×6000.Fig.4 Transmission electron microscopes of lung tissues
此外,研究发现肺纤维化发病过程中存在氧化/抗氧化失衡,过度的氧化损伤会造成细胞的坏死性死亡及机体损伤。氧自由基能破坏生物膜和损害细胞功能,研究表明丹酚酸A是丹参提取物中抗氧化作用最强的物质,且有研究报道丹酚酸A可一定程度的保护大鼠肝纤维化的发生[10],故我们还进一步观察了丹酚酸 A对血清中 SOD、MDA和GSH-Px的影响,研究表明丹酚酸A可提高 SOD和GSH-Px活性并降低MDA含量,从而达到抑制体内脂质过氧化过程、平衡系统的作用,具有较强的清除自由基作用和抗氧化作用,这表明丹酚酸A抗纤维化作用可能与其有关。
综上所述,本实验发现丹酚酸A可有效缓解博来霉素诱导的肺纤维化大鼠症状,有效改善限制性通气障碍,恢复肺功能;透射电镜观察显示,丹酚酸A具有减缓Ⅱ型肺泡上皮细胞增生,抑制纤维结缔组织沉积及保护肺泡壁的作用;同时,丹酚酸A具有抑制体内脂质过氧化过程,降低脂质过氧化产物含量,从而使机体细胞和组织免受损害,起到保护肺纤维化的作用。这也体现了丹酚酸A多靶点的药理作用,但具体相关机制仍需要我们进一步探讨研究。
(本文图 1,3 见彩插 3。)
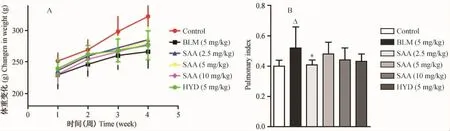
注:Δ:与正常对照组相比P<0.05;*与BLM组相比P<0.05.图1 肺纤维化大鼠体重及肺指数的变化Note: Δ P <0.05 vs. control group; *P <0.05 vs. BLM group.Fig.1 Changes of weight and pulmonary index of bleomycin induced pulmonary fibrosis rats

图3 肺纤维化大鼠肺组织切片HE染色(×400)Fig.3 HE staining of lung tissues of pulmonary fibrosis of rats (×400)
[1]King TJ,Pardo A,Selman M.Idiopathic pulmonary fibrosis[J].Lancet,2011,378(9807):1949 -1961.
[2]Huang ZS,Zeng CL,Zhu LJ,et al.Salvianolic acid A inhibits platelet activation and arterialthro mbosisvia inhibition of phosphoinositide 3-kinase[J].J Thromb Haemost,2010,8(6):1383-1393.
[3]Yang LL,Li DY,Zhang YB,et al.Salvianolic acid A inhibits angiotensin II-induced proliferation ofhuman umbilicalvein endothelial cells by attenuating the production of ROS[J].Acta Pharmacol Sin,2012,33(1):41-48.
[4]Yang XY,Qiang GF,Zhang L,et al.Salvianolic acid A protects against vascular endothelial dysfunction in high-fat diet fed and streptozotocin-induced diabetic rats[J].J Asian Nat Prod Res,2011,13(10):884-894.
[5]Tsai MK,Lin YL,Huang YT.Effects of salvianolic acids on oxidative stress and hepatic fibrosis in rats[J].Toxicol Appl Pharmacol,2010,242(2):155 -164.
[6]Li S,Yang X,Li W,et al.N-acetylcysteine down regulation of lysyl oxidase activity alleviating bleomycin-induced pulmonary fibrosis in rats[J].Respiration,2012,84(6):509 -517.
[7]Degryse AL,Tanjore H,Xu XC,et al.Repetitive intratracheal bleomycin models several features of idiopathic pulmonary fibrosis[J].Am J Physiol Lung Cell Mol Physiol,2010,299(4):L442 -452.
[8]Mouratis MA,Aidinis V.Modelingpulmonaryfibrosiswith bleomycin[J].Curr Opin Pulm Med,2011,17(5):355 - 361.
[9]Noble PW, BarkauskasCE, Jiang D.Pulmonary fibrosis:patterns and perpetrators[J].J Clin Invest,2012,122(8):2756-2762.
[10]Tsai MK,Lin YL,Huang YT.Effects of salvianolic acids on oxidative stress and hepatic fibrosis in rats[J].Toxicol Appl Pharmacol,2010,242(2):155 -164.

