不同饲养密度对斑马鱼生长发育的影响
巨英超,谢 英,刘 超,吴建华,刘树锋
(1.河北医科大学第四医院实验动物中心2.河北省实验动物重点研究室,河北医科大学实验动物学部,石家庄 050017)
斑马鱼作为一种新型的模式生物,正逐渐拓展和深入应用到生命科学各个领域的研究中。尽管斑马鱼作为国际上应用最广的实验鱼类,但其作为实验用动物尚未实现标准化。随着我国实验斑马鱼应用范围的拓展和深入,斑马鱼的标准化研究显得越来越重要[1-4]。目前国内已经有了斑马鱼资源信息网络数据库,可以为斑马鱼基因组及生物信息学分析提供参考依据[5],有关斑马鱼的人工繁殖、生态、生理等方面也已有报道[6-7],国内学者已经就斑马鱼的实验动物标准化工作开展了研究[8],但是就饲养密度对斑马鱼生长发育与存活的影响方面则未见报道。本文将就此进行探讨,以期为实验室斑马鱼相关研究工作及斑马鱼的实验动物标准化提供一些基础资料和数据支持。
1 材料与方法
1.1 材料
AB品系斑马鱼引自北京大学生命科学研究院,饲养于河北省实验动物中心斑马鱼实验室自制的斑马鱼养殖系统,自动控制光照,昼夜时间交替为14 h∶10 h。养殖系统中独立饲养单元的容积为3 L,水温(28.3 ±0.17)℃,pH 值(7.5±0.02),电导率(1.07 ±0.06)ms/cm,NH4+-N <0.04 mg/L[9]。
1.2 方法
试验分为 5 个组,密度分别为 1、2、4、6、8Tail/L。孵化后的幼鱼14 d之前饲养于1000 mL烧杯中,28℃水浴。4~10 d饲喂草履虫(Paramoecium),11 d开始加入丰年虾(Artemia)进行混合饲喂,并逐日增加丰年虾的比例。14 d后按组别转移到容量为3 L的独立饲养单元内,只投喂丰年虾;每天8∶00、18∶00投食,饲喂量为每条鱼 0.4 mL 用纯净水1∶3稀释的丰年虾[10]。20 d起每 10 d测量一次体长和体重,90 d时处死鱼只后分别测量体重、体长、心脏重量、肝脏重量并计算生长指数和脏器指数,比较各组的生长发育情况。
1.3 参数计算与数据统计
参数计算公式:
日增重(DWG)DWG=(W2-W1)/(t2-t1);
增重率(WGR)WGR=(W2-W1)/W1×100%;
增长率(LGR)LGR=(L2-L1)/L1×100%;
所有公式中,W1、W2为时间 t1、t2时的体重(mg),L1、L2为时间 t1、t2时的体长(mm)。根据lietal(2000)的计算方法,成年鱼脏器指数=脏器重量(mg)/成年鱼体重(mg)×100%。
所有数据使用 SPSS17.0进行统计分析,方差分析。
表1 斑马鱼不同饲养密度的生长参数(±s)Tab.1 The growth parameters of the zebrafish in different rearing density
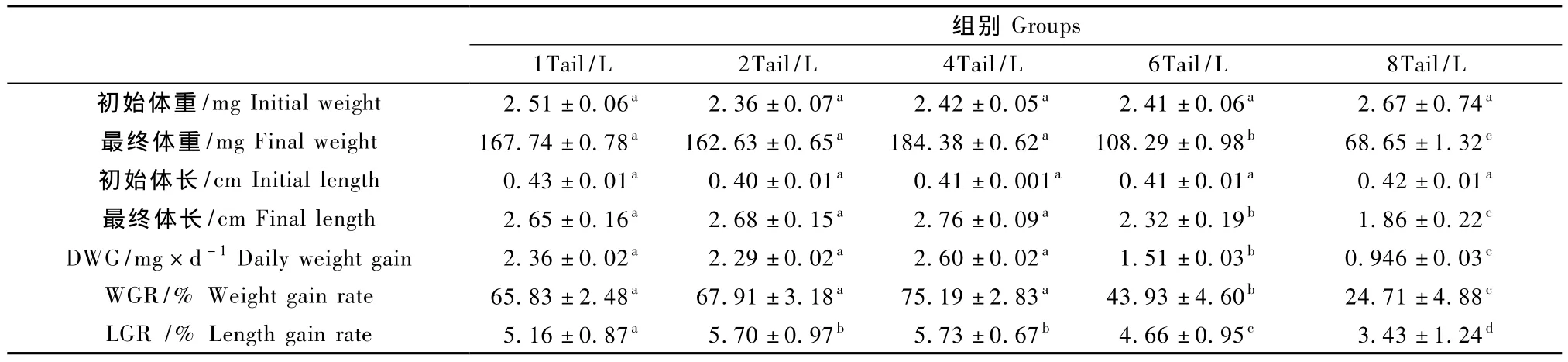
表1 斑马鱼不同饲养密度的生长参数(±s)Tab.1 The growth parameters of the zebrafish in different rearing density
初始体重/mg Initial weight 2.51±0.06a 2.36±0.07a 2.42±0.05a 2.41±0.06a 2.67±0.74a最终体重/mg Final weight 167.74±0.78a 162.63±0.65a 184.38±0.62a 108.29±0.98b 68.65±1.32c初始体长/cm Initial length 0.43±0.01a 0.40±0.01a 0.41±0.001a 0.41±0.01a 0.42±0.01a最终体长/cm Final length 2.65±0.16a 2.68±0.15a 2.76±0.09a 2.32±0.19b 1.86±0.22c DWG/mg×d-1Daily weight gain 2.36±0.02a 2.29±0.02a 2.60±0.02a 1.51±0.03b 0.946±0.03c WGR/%Weight gain rate 65.83±2.48a 67.91±3.18a 75.19±2.83a 43.93±4.60b 24.71±4.88c LGR/%Length gain rate 5.16±0.87a 5.70±0.97b 5.73±0.67b 4.66±0.95c 3.43±1.24d

表2 斑马鱼不同饲养密度的存活率Tab.2 The survival of the zebrafish in different rearing density
表3 斑马鱼不同饲养密度下90日龄的脏器指数(±s)Tab.3 The viscera index of zebrafish at 90 days of age in different breeding density

表3 斑马鱼不同饲养密度下90日龄的脏器指数(±s)Tab.3 The viscera index of zebrafish at 90 days of age in different breeding density
注:以上三表同一行中参数右上角处字母(a-d)相同代表差异性不显著(P>0.05),不同则差异性极显著(P<0.01)。Note:The values with same letters mean no significant difference in a line above three charts(P >0.05),and with different letters mean extremely difference(P <0.01).
脏器指数/%Viscera index 心脏 Heart 5.70±0.14a 5.74±0.21a 5.89±0.15a 4.87±0.19b 4.62±0.26b肝脏Liver 1.67±0.06a 1.58±0.08a 1.70±0.06a 0.96±0.09b 0.85±0.17b
2 结果
2.1 饲养密度与生长发育的关系
通过表1可以看出,饲养密度在1至4Tail/L之间,其最终体重、体长、DWG、GBW 略有变化,当养殖密度为4Tail/L时达到最大值 ,但各组间差异不显著。当进一步增加饲养密度时,各指标反而下降,8Tail/L组的生长速度、最终体重显著低于其它组。从图1(彩插2)的结果中可发现,在6Tail/L和8Tail/L组,鱼只的体重增长趋势在后期都明显表现放缓的迹象。日常饲养工作中观察该组的鱼只,发现体型也明显较其他组瘦弱。

图1 不同饲养密度下斑马鱼体重与体长增长曲线图Tig.1 The curve graph of length and weight gain of the zebrafish in different rearing density
2.2 密度对存活率的影响
1Tail/L、4Tail/L 两组未见死亡,2Tail/L、6Tail/L两组只在个别平行组中出现了1、2尾死亡,而8Tail/L组中几乎每个平行组都有2~5尾斑马鱼死亡,91.81%的存活率也明显的低于其他组。
2.3 密度与成年鱼脏器指数的关系
统计结果显示高密度组的各脏器指数都显著降低(表3)。解剖显微镜下观察,1、2、4Tail/L组中斑马鱼的心脏和肝脏都比6Tail/L、8Tail/L组的要明显,而且高密度组有很多斑马鱼很难找到肝脏,主要因为肝脏颜色太浅无法判断准确。
3 讨论
一般认为,鱼类的最终体重和日增重都随着养殖密度的增大而显著降低[11-13],但有报道认为,在适宜的饲养密度范围内,较高的饲养密度有利于其生长。如Baker等对红点鲑的实验结果表明,当饲养密度低于40~50 kg/m3时,红点鲑的生长率随饲养密度增大而呈增长趋势,但随着饲养密度的进一步增大,超过40~50 kg/m3时,鱼类个体的活动空间受到限制,继而间接导致鱼类个体的生长受到限制,生长率明显下降。
在本试验中,4Tail/L以下密度组的斑马鱼生长发育无明显差异,4Tail/L密度组的相对生长效果较其它组具有优势,成活率也高。密度过高则不利于斑马鱼的生长发育,在高密度组普遍存在2~5尾较其他鱼体型明显小很多的鱼,这在一些报道中也有提到[14-16],究其原因可能是在高密度饲养条件采食竞争激烈,少量鱼只的采食量不能满足其生长发育的需要。而且过高的饲养密度也会引起饲养水体代谢产物的浓度加大,不利于鱼只的生存。考虑到饲养空间利用率等因素,建议将饲养密度确定为4Tail/L。
此前,The Zebrafish Book中曾指出斑马鱼的饲养密度不应超过25Tail/45L即0.6Tail/L的密度,否则鱼只的生长发育将受到严重影响[10]。王天奇等也曾指出,成鱼饲养密度不应超过1Tail/L,幼鱼不应超过2Tail/L[8]。不同的研究结果可能是研究者采用不同的饲养繁育体系水处理效果的差异而致。本研究的结果反映了繁育设备中水环境对实验用鱼生长发育的重要性,提示高效的饲养繁育体系及合理的密度有利于斑马鱼正常的生长发育。
4 结论
本试验对不同饲养密度下斑马鱼的生长性能指标进行了比较,发现4Tail/L时斑马鱼有着较好的生长发育优势,同时发现饲养密度过高不利于斑马鱼的生长发育。斑马鱼作为一种新兴的实验动物,其标准化工作是必然的趋势,稳定的环境、严格的管理须配合合理的饲养密度才能实现其标准化。对于规模较小的实验室,在条件有限的情况下,合理的饲养密度对取得真实可靠的实验数据极为重要。
(本文图1,见彩插2)
[1]吴思,赵德明,孙德明,等.实验用斑马鱼主要疾病及其实验动物标准化研究过程面临的主要问题[J].实验动物科学,2009,26(4):51-56.
[2]孙德明,穆苑,高昌,等.模型动物斑马鱼及其特定病原净化[J].中国比较医学杂志,2009,19(12):52 -60.
[3]贾顺姬,孟安明.中国斑马鱼研究发展历程及现状[J].遗传,2012,34(9):1082 -1088.
[4]程烽,陈竺.斑马鱼:一种造血系统的遗传学研究模型动物[J].国外医学输血及血液学分册,2004,27(3):200 -202.
[5]陈宝增,李凤超,康现江.实验室斑马鱼的繁育与养殖技术[J].河北渔业,2008,(4):51 - 53.
[6]陈晓倩,殷浩文.斑马鱼饲养循环装置中的水生环境微生物群落代谢[J].中国比较医学杂志,2007(17):110-114.
[7]陈桑,李朝红,李志华,等.斑马鱼实验室繁育系统的建立[J].中山大学学报(医学科学版),2006,(27):81 -82.
[8]王天奇,孙荣泽,孙德明.实验用鱼类的水环境及其标准化[J].中国比较医学杂志,2009,19(12):44 -51.
[9]谢英,梁卫华,张曼,等.一种方便实用的实验室斑马鱼饲养系统[C].第十届中国实验动物科学年会论文集,扬州,2012:253-257.
[10]Westerfield M.The Zebrafish Book:A Guide for the aboratory Use of Zebrafish(Danio rerio)[M],4th edition.University of Oregon Press,2000.
[11]Daniel Scholfield,B.S.Information Resources on Zebrafish[M].2010(46).
[12]Kent ML,Spitsbergen JM,Matthews JM,etal.Diseases of Zebrafishin Research Facilites[M]. ZIRC Health Services Zebrafish Disease ManualCulfBreeze.Florida US:US Environmental Protection Agency.2007.
[13]Helfman G,Collette B,Facey D.The Diversity of Fishes[M].MA,Black well Pub lishing Company,1997:528.
[14]顾新国.斑马鱼的饲养与繁殖[J].河北渔业,2007,(12):30-31.
[15]Christian Lawrence.The huabandary of zebrafish(Danio rerio):A review.Aquaculture[M],2007,269:1 -20.
[16]陈春娜,黄颖颖,陈先均.养殖密度对长薄鳅稚鱼生长的影响[J].当代水产,2011,(6):65 -68.

