西藏小型猪肋软骨细胞的分离培养及鉴定
刘 薇,史俊文,岳 敏,张婷婷,唐 华,袁 进,肖 东,顾为望
(1.南方医科大学 比较医学研究所暨实验动物中心,2.肿瘤研究所,广州 510515)
猪在解剖、生理、生化代谢等方面与人类十分相似,近年来将猪用作医学实验动物呈越来越普遍的趋势[1]。软骨细胞是一种高分化的细胞,人体关节损伤之后,关节软骨在体内不能增殖修复受损关节,用组织工程的方法制作人工关节为临床上治疗关节损伤提供了一种可能的方法,可以通过将软骨细胞种植在特殊材料的支架上,构建人工组织,来修复受损关节[2,3]。小型猪体型适中,价格经济,获得容易,是进行关节软骨损伤的良好实验材料[4]。西藏小型猪是由南方医科大学实验动物中心顾为望教授等人于2004年由西藏自治区引种至广州培育而成的小型猪品系,在近几年,已基于其建立了几种转基因动物模型[5,6]。本研究拟分离培养西藏小型猪肋软骨细胞,并对其进行鉴定,为后续的软骨组织工程研究提供必备的实验材料。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物
西藏小型猪:3日龄普通级雄性西藏小型猪1头,南方医科大学实验动物中心提供【SCXK粤2011-0015】。
小鼠:8周龄BALB/c小鼠一只,南方医科大学实验动物中心提供【SCXK粤2011-0015】。
1.1.2 主要试剂及耗材
胎牛血清、高糖DMEM培养基、非必需氨基酸、L-谷氨酰胺购自 Hyclone公司。青霉素-链霉素溶液、胰蛋白酶、Ⅱ型胶原酶、DMSO等购自 Invitrogen公司。DAPI、甲苯胺蓝染料购自sigma公司。兔抗人Aggrecan一抗购自SANTA公司,鼠抗人CollagenⅡ一抗购自Invitrogen公司,羊抗兔和羊抗鼠Alexa Fluor 555红色荧光标记二抗购自 Invitrogen公司。培养瓶及培养板等购自Corning公司。其余试剂为国产或进口化学纯或分析纯。
软骨细胞完全培养基配方:DMEM培养基,加入10%胎牛血清、维生素 C(终浓度为50 μg/mL)。
1.2 方法
1.2.1 细胞培养
西藏小型猪肋软骨细胞(PCCs)分离培养:将3日龄西藏小型猪过量麻醉,处死,腹部皮肤剃毛,碘酊、75%酒精消毒,剪开腹部皮肤,无菌剪取肋软骨一段,置于装有含双抗的 PBS的10 mm平皿中,运回超净台进行后续操作。将取下的肋软骨用含双抗的PBS洗两遍,分离表面附着的软骨膜、肌肉等组织,将分离好的肋软骨剪成0.1 mm3的小碎块,收集到15 mL离心管中,加入0.1% Ⅱ型胶原酶2 mL,消化30 min,PBS洗两遍,然后加入新鲜 0.1%Ⅱ型胶原酶5 mL,37℃培养箱内消化5 h,每1小时吹打一次,观察大部分软骨块消化后,加入完全培养基终止消化,200 g,4℃离心10 min,弃上清,加入完全培养基,转入25 cm2细胞培养瓶中,于CO2培养箱内培养(培养条件:37℃、5%CO2、饱和湿度)。当原代细胞生长达80%~90%融合时,进行传代。先吸除旧培养液,PBS洗涤 2遍,弃 PBS并加入0.25%胰酶进行消化,37℃培养箱中消化约5 min,镜下观察细胞消化情况,当大多数细胞变圆,立即加入2 mL完全培养基终止消化,然后仔细吹打细胞悬液,将细胞悬液收集至15mL离心管中,200 g,4℃离心10 min。弃上清液后,再用完全培养液重悬细胞,并轻轻吹打使细胞分散均匀,传入新的培养皿中继续培养。
小鼠肋软骨细胞(MCCs)分离培养:取8周龄BALB/c小鼠一只,参照以上西藏小型猪肋软骨细胞分离培养的方法分离培养其肋软骨细胞。
西藏小型猪胚胎成纤维细胞(PEFs)和小鼠胚胎成纤维细胞(MEFs)的培养:使用本实验室冻存的PEFs[7]和 MEFs,复苏,传代至 P5,备用。
1.2.2 西藏小型猪肋软骨细胞的鉴定
甲苯胺蓝染色是软骨细胞的特异性染色,原理是软骨细胞分泌的蛋白聚糖经甲苯胺蓝染色显色为异染的蓝紫色。软骨细胞特异性分泌蛋白聚糖(Aggrecan)和Ⅱ型胶原蛋白(CollagenⅡ),通过对两种蛋白的检测阳性可证明所分离培养的细胞是软骨细胞[8]。本实验分别以 PEFs和 MEFs为阴性对照,对所分离培养的PCCs和MCCs进行甲苯胺蓝染色鉴定以及蛋白聚糖和Ⅱ型胶原的免疫荧光染色鉴定,如果待鉴定的PCCs和MCCs为甲苯胺蓝阳性及蛋白聚糖和Ⅱ型胶原的免疫荧光阳性,即可证明所分离培养的PCCs为软骨细胞。
甲苯胺蓝染色:0.5 g甲苯胺蓝溶于100 mL PBS中配成0.5%甲苯胺蓝染液,将以上四种细胞传代至3.5 cm平皿中,PCCs和 MCCs均为 P1代,PEFs和MEFs为P5代,四种细胞分别用4%多聚甲醛固定10 min,PBS洗三次,甲苯胺蓝染色30 min,光镜下观察拍照。
取西藏小型猪膝关节处5 mm×5 mm×5 mm软骨组织 (用作细胞染色的阳性对照),按照常规步骤进行固定、脱水、石蜡切片的制作。将石蜡切片脱蜡去水,用以上甲苯胺蓝染色液染色30 min,95%酒精分化5 s,浸入二甲苯5 min,中性树胶封片。
蛋白聚糖和Ⅱ型胶原的免疫荧光检测:在六孔板内铺盖玻片,四种细胞分别各接种两个孔,制作细胞爬片,待细胞密度达到70% ~80%时,PBS洗三次,用4%多聚甲醛将细胞固定10 min,PBS洗三次,0.5%Triton-100透化 10 min,PBS洗三次,山羊血清封闭20min(常温),加入KB稀释的一抗(稀释倍数:Aggrecan和 CollagenⅡ均为 1∶200),37℃孵育2 h,PBS洗三次,加入 KB稀释的红光二抗(80μl/片),37℃避光孵育 1 h,PBS 洗三次,避光加DAPI(0.2 mg/μL)10 μL 于载玻片上,加入等量的防荧光淬灭封片剂,盖上盖玻片(细胞面朝下),指甲油封片,正置荧光显微镜下观察。
抗体稀释液KB十倍储存液的配制方法:Tris 1.21 g;NaCl 8.8 g;BSA 3 g溶于100 mL ddH2O中。
2 结果
2.1 细胞形态
原代培养24 h后,可见西藏小型猪肋软骨细胞开始贴壁生长,细胞形态呈三角形、梭形、成纤维状,细胞核为圆形或椭圆形,位于胞体中心,细胞在培养3天后,融合度达到90%左右。而同期培养的小鼠肋软骨细胞,则呈现圆形和多角形两种形态,其中圆形细胞占大多数,且细胞长满后排列紧密,呈现典型的“铺路石”状。PCCs虽然为成纤维细胞状,但是与典型的成纤维细胞PEFs相比,PCCs的细胞大小要小很多,因此它并不同于成纤维细胞(图1,封二)。

注:PEFs:西藏小型猪胚胎成纤维细胞;PCCs: 西藏小型猪肋软骨细胞;MCCs:小鼠肋软骨细胞;MEFs:小鼠胚胎成纤维细胞图1 西藏小型猪肋软骨细胞的原代培养Note: PEFs: pig embryonic fibroblasts; PCCs: pig rib chondrocytes; MCCs: mouse rib chondrocytes;MEFs: mouse embryonic fibroblastsFig.1 Primary culture of rib chondrocytes of the tibetan miniature pig
2.2 甲苯胺蓝染色
经甲苯胺蓝染色可见,西藏小型猪关节软骨组织甲苯胺蓝染色阳性,软骨基质为异染的蓝紫色,切片上可见处于不同成熟阶段的软骨细胞,而所分离培养的PCCs和MCCs均呈甲苯胺蓝染色阳性,软骨细胞内可见蓝紫色异染颗粒(图2,封二)。

注: A: PEFs; B: PCCs; C: MEFs; D: MCCs; E: 西藏小型猪关节软骨组织切片图2 西藏小型猪肋软骨细胞甲苯胺蓝染色Note: A: PEFs; B: PCCs; C: MEFs; D: MCCs; E: histological sections of articular cartilage of Tibetan miniature pigsFig.2 Toluidine blue staining of tibetan miniature pigs rib chondrocytes
2.3 蛋白聚糖和Ⅱ型胶原的免疫荧光
经免疫荧光检测,PCCs和MCCs均呈蛋白聚糖和Ⅱ型胶原阳性(图3,见彩插1)。

注:蓝色示DAPI标记的细胞核;红色示蛋白聚糖和II型胶原;PEFs:西藏小型猪胚胎成纤维细胞;PCCs: 西藏小型猪肋软骨细胞;MCCs:小鼠肋软骨细胞,MEFs:小鼠胚胎成纤维细胞图3 西藏小型猪肋软骨细胞免疫荧光染色Note: blue: nucleus marked by DAPI; red: Aggrecan and Collagen II; PEFs: pig embryonic fibroblasts;PCCs: pig rib chondrocytes; MCCs: mouse rib chondrocytes; MEFs: mouse embryonic fibroblastsFig.3 Immunofluorescence stain of tibetan miniature pigs rib chondrocytes
3 讨论
软骨主要由软骨细胞和软骨基质组成,采用胶原酶消化的方法就可以获得种类单一的软骨细胞。软骨基质主要包括胶原和蛋白聚糖,其中Ⅱ型胶原占胶原的95%,软骨细胞分泌的蛋白聚糖可以通过甲苯胺蓝染色显色为异染的蓝紫色,因此,可以采用甲苯胺蓝染色法对所分离培养的软骨细胞进行鉴定,同时用Ⅱ型胶原和蛋白聚糖的免疫荧光也可以对软骨细胞进行鉴定。
本实验采用二步消化法成功分离培养获得西藏小型猪肋软骨细胞,所培养的原代西藏小型猪肋软骨细胞呈三角形、梭形及成纤维状。而典型的大小鼠和兔的软骨细胞均是圆形与多角形的,细胞密集时会呈现“铺路石”状[8,9,10],本实验同期培养的小鼠原代肋软骨细胞也呈现圆形和多角形,与文献一致。经甲苯胺蓝染色以及蛋白聚糖和Ⅱ型胶原免疫荧光反应,均证实所分离培养的PCCs为软骨细胞。因此,西藏小型猪的肋软骨细胞的特殊形态,可能与猪这个物种有关。PCCs的成纤维状与典型的成纤维细胞并不相同,由图1可以看出,与PEFs相比,PCCs要小很多,说明两者有很大的形态差异。
本实验成功分离了西藏小型猪的肋软骨细胞,这为进一步用西藏小型猪进行软骨损伤修复的研究提供了良好的实验材料。
(本文图1,2见封二,图3见彩插1。)

图1 野生型实验组小鼠肝组织Fig.1 Liver biopsy of Wild-type experimental group mouse

图2 野生型对照组小鼠肝组织Fig.2 Liver biopsy of Wild-type control group mouse
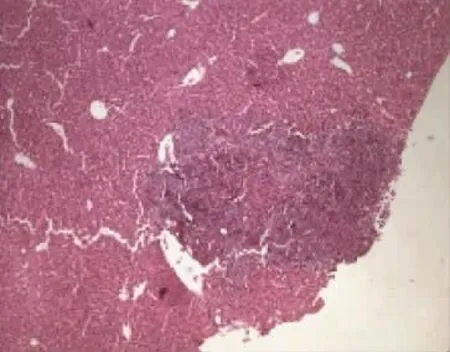
图3 野生型实验组小鼠肝组织切片(HE)Fig.3 Liver biopsy of Wild-type experimental group mouse(HE)

图4 敲基因型实验组小鼠肝组织切片(HE)Fig.4 Liver biopsy of Knock genotype experimental group mice(HE)
[1]顾为望,刘运忠,唐小江,等.西藏小型猪血液生理生化指标的初步研究[J].中国实验动物学报,2007,15(1):60 -63.
[2]余方圆.组织工程关节软骨研究进展[J].中国矫形外科杂志,2004,12(10):785-787.
[3]Frenkel SR,Di Cesare PE.Degradation and repair of articular cartilage[J].Front Biosci,1999,4(10):D671- D685.
[4]Daar AS,Phi l D.Ethics of xenotrans plantation:animal tissues,consent and likely transformation of transplant ethics[J].World J Surg 1997;21:975.
[5]Deng W,Yang D,Zhao B,et al.Use of the 2A peptide for generation of multi-transgenic pigs through a single round of nuclear transfer[J].PLoS One,2011,6(5):e19986.
[6]Yang D,Wang CE,Zhao B,et al.Expression of Huntington’s disease protein results in apoptotic neurons in the brains of cloned transgenic pigs[J].Hum Mol Genet,2010,19(20):3983-3994.
[7]张晟,肖高芳,黄黎珍,等.借助慢病毒将EGFP基因导入西藏小型猪胎儿成纤维细胞[J].中国比较医学杂志,2010,04:34-36.
[8]王正辉,李国光,杨壮群,等.大鼠肋软骨细胞体外培养及老化对基质代谢的影响[J].组织工程与重建外科,2007,6:312-316.
[9]袁亚江,梅晰凡,高蔚然,等.SD大鼠肋软骨细胞的原代培养和去分化现象的观察[J].辽宁医学院学报,2009,05:396-399.
[10]桂传枝,王长松,于燕妮,等.体外兔肋软骨细胞的培养及鉴定[J].贵阳医学院学报,2004,04:299-301.

