金黄色葡萄球菌拮抗菌株的筛选及鉴定
李成海,贠建民,艾对元,张紊玮,颜东方
(甘肃农业大学食品科学与工程学院,甘肃兰州730070)
随着食品工业的快速增长,人们对食品防腐剂的安全性以及食品的保质期问题提出了更高的要求。一些食品腐败菌如金黄色葡萄球菌(Staphyloccocus aureus)、大肠杆菌(Escherichia coli)等严重危害着食品安全,如何防止食品腐败变质及开发安全的食品防腐剂越来越受到重视。研究表明,一些化学合成防腐剂存在一定的安全隐患,如苯甲酸盐可能会引起食物中毒现象,硝酸盐和亚硝酸盐可能会生成致癌的亚硝胺[1]。而微生物防腐剂如Nisin、Natamycin等因其安全性高、性能好,而且不影响食品风味,在食品防腐方面具有很高的应用价值[2]。因此,开发安全、高效、健康的新型微生物防腐剂成为当今食品工业发展的趋势。从极端生境中分离具有活性功能的微生物已越来越受到重视。目前有研究已经从干旱生境中筛选出具有活性功能的微生物[3],如能产生纤维素酶、淀粉酶和蛋白酶的沙漠放线菌产抗癌菌素湿性链霉菌(Streptomyces humidus subsp.Antitumoris)、达松威尔拟诺卡菌(Nocardiopsis dassonvillei)和易变链霉菌(Streptomyces mutabilis),以及产胞外多糖高达7445.80mg/L的苏云金芽孢杆菌(Bacillus thuringiensis)[4]。为此,本实验拟以甘肃中部干旱生境土壤为分离材料,开展拮抗金黄色葡萄球菌的菌株筛选,旨在为构建和丰富防腐微生物种质资源库提供菌种来源,为相关企业开发微生物防腐剂新产品提供参考和依据。
1 材料与方法
1.1 材料与仪器
1.1.1 土样来源 从甘肃中部定西市干旱北山山坡,用灭过菌的铲子除去表面1~2cm的土层,以表层下3~4cm深度为基准采集土样,密封,4℃保存备用。
1.1.2 供试菌株 金黄色葡萄球菌(Staphyloccocus aureus)、大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillussubtilis)、植物乳酸杆菌(Lactobacillus plantarum)、表皮葡萄球菌 (Stapyloccocush epidermidis)均由甘肃农业大学食品科学与工程学院微生物实验室保藏;结核分歧杆菌(Mycobacterium tuberculosis)由兰州大学医学院微生物实验室提供。
1.1.3 培养基 高氏1号培养基,用于样品中细菌的分离;牛肉膏蛋白胨琼脂培养基,用于拮抗细菌的活性菌株筛选;牛肉膏蛋白胨液体培养基,作为指示菌的活化及发酵培养基。
1.1.4 主要实验仪器 SW-CJ-2FD超净工作台 苏州净化;YX-280A高压灭菌锅 上海三申;HG303-4电热恒温培养箱 南京实验仪器厂;THZ-82N台式恒温振荡器 上海跃进;PB203-N电子天平 上海精密科学仪器厂;XP-200显微镜上海绘统光学仪器有限公司;PCR反应扩增仪 加拿大BBI公司;3730测序列分析仪 美国ABI公司;DK-8D型电热恒温水槽 上海森信实验仪器有限公司;DYY-8型稳压稳流电泳仪 上海琪特分析仪器有限公司;YXJ-2离心机 湘仪离心机仪器有限公司;H6-1微型电泳槽 上海精益有机玻璃制品仪器厂;凝胶成像系统 Gene Genius公司;移液器 加拿大BBI公司。
1.2 菌株的分离、纯化[5]
称取研细土样5g,加入盛有45mL无菌水的三角瓶中,摇床振荡20min。吸取1mL土壤悬浮液到9mL无菌水中稀释得10倍液,依次按10倍法稀释到10-6一系列稀释液。分别取10-4、10-5和10-6稀释液0.2mL,用涂布平板法均匀接种到高氏1号培养基上,每个处理三个重复。将培养皿倒置于28℃恒温培养箱内培养4~7d。挑取单菌落,分离纯化后,保存备用。
1.3 拮抗菌株的筛选
1.3.1 指示菌的活化 将各供试指示菌斜面菌苔分别接种于牛肉膏蛋白胨液体培养基,37℃摇床振荡培养36h;连续培养3~4代种子液,用无菌水稀释至浓度为107CFU/mL[6]的菌悬液,制备长有指示菌的营养固体平板。
1.3.2 拮抗菌株的初筛 采用点接法筛选。将分离出的菌株分别点接在涂有指示菌的营养固体平板上,每个平板三个重复,以未涂指示菌的平板为对照,培养72h,观察抑菌情况。
1.3.3 拮抗菌株的复筛 发酵液的制备[7]:将拮抗菌在无菌条件下接种到牛肉膏蛋白胨液体培养基中,37℃摇床振荡培养5d;发酵液在4500r/min离心15min后,取上清液,备用。
参照马永全等[8]的方法,取已灭菌的牛津杯置于涂有指示菌的平板上,吸取拮抗菌发酵液0.3mL滴加于牛津杯中,每个平板放3个牛津杯,设空白对照,培养24h,观察抑菌情况。并用游标卡尺测量抑菌圈直径,计算抑菌效价。

式中:X为抑菌圈直径(mm);Y为牛津杯直径:8mm;V为发酵液体积(μL)。
1.3.4 抑菌最低浓度稀释梯度的测定 吸取1mL待测菌发酵液到9mL无菌水中稀释得10倍液,依次按10倍法稀释到10-7一系列稀释液。分别对各梯度发酵液通过牛津杯法对指示菌进行抑菌实验,每个平板放3个牛津杯,并设置空白对照,培养24h,观察抑菌情况。
1.4 拮抗菌的鉴定
1.4.1 形态学特征 用接种针挑取拮抗菌菌苔少许进行涂片,然后用酒精灯加热固定,对固定好的菌株采用美蓝染液染色1min,水洗后干燥,镜检。
革兰氏染色[9]:用接种针挑取拮抗菌菌苔少许涂片固定;用草酸铵结晶紫染1min,水洗;加碘液媒染1min,水洗;经95%乙醇脱色20s后水洗;蕃红复染2min后,水洗;干燥,镜检。
1.4.2 生理生化特征 将拮抗菌株在牛肉膏蛋白胨琼脂培养基上36℃活化培养48h,参照东秀珠等[10]的方法,对其培养物分别进行接触酶、V-P测定、产色素、还原硝酸盐、硝酸盐和亚硝酸盐厌氧生长、H2无机化能营养、水解明胶、水解淀粉、乙酰胺水解、糖产酸、醋酸盐、己二酸盐、庚二酸盐、辛二酸盐、酒石酸盐、衣康酸盐、异-戊酸盐、正-戊酸盐及糖醇类发酵实验。
1.4.3 16S rDNA分子生物学鉴定 菌株基因组的提取:菌株基因组按照生工SK1201-UNIQ-10柱式细菌基因组DNA抽提试剂盒说明书提取。
1.4.4 16S rDNA基因扩增序列测序及分析 将提取的基因组DNA委托生工生物工程(上海)有限公司进行16S rDNA基因扩增序列测序。测序结果提交GenBank数据库,进行Blast比对,选择近缘10株菌的 16S rDNA 序列,用 MEGA 4.0[11]进行多重比对,构建系统发育树,并进行Bootstrap测试,设置重复次数为1000次。
2 结果与分析
2.1 菌株分离、纯化结果
把土壤悬液经系列稀释后采用涂布法接种于高氏1号平板培养基上,培养后挑取单菌落,共分离得到32株菌,编号,将这些菌株在高氏1号斜面上培养,4℃保存,备用。
2.2 抗菌活性菌株的筛选结果
2.2.1 初筛结果 对分离到的32株菌开展拮抗实验,初筛到一株对金黄色葡萄球菌具有拮抗作用的菌株A-2,见图1。

图1 拮抗菌A-2对金黄色葡萄球菌的抑菌效果Fig.1 The antibacterial effect of antagonistic strain A-2 on S.aureus
2.2.2 复筛结果及抑菌谱测定 以菌株A-2的发酵液通过牛津杯法复筛,证明其对金黄色葡萄球菌、大肠杆菌、植物乳酸杆菌和表皮葡萄球菌具有显著的抑菌效果,而对枯草芽孢杆菌和结核分歧杆菌没有抑菌效果。由于本实验发酵液中菌体未经破壁处理,表明该抗菌活性物质为胞外产物。
2.2.3 抑菌最低浓度稀释梯度的测定结果 A-2发酵液经稀释后,对金黄色葡萄球菌进行抑菌实验,抑菌效果见表2。
由表2可知,发酵液稀释到10-6浓度梯度仍对金黄色葡萄球菌、大肠杆菌、植物乳酸杆菌和表皮葡萄球菌具有抑菌效果,发酵液在10-7浓度梯度对各指示菌没有抑菌效果,表明拮抗菌的抑菌最低浓度稀释梯度为10-6,因此,该拮抗菌株有深入研究的价值,有必要对其种属进行鉴定。
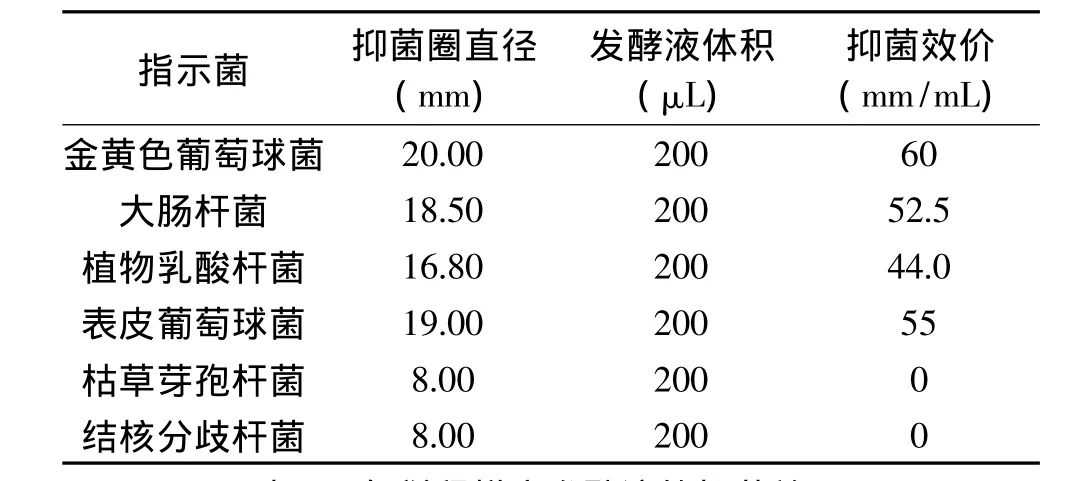
表1 拮抗菌A-2的抑菌效价Table 1 The antibacterial titer of antagonistic strain A-2

表2 各稀释梯度发酵液的抑菌效果Table 2 The antibacterial effect of the dilute fermented broth
2.3 拮抗菌株A-2的鉴定结果
2.3.1 菌株A-2的形态特征 菌株A-2的形态如图2。

图2 拮抗菌A-2的形态照片(10×100)Fig.2 Form photo of antagonistic strain A-2(10×100)
由图2可知,拮抗菌株A-2的细胞形态为球状或短杆状,0.5~2μm ×0.5~2.6μm,菌体单一或链状排列,无芽孢。经革兰氏染色后镜检为红色,为革兰氏阴性细菌。
2.3.2 A-2菌株的生理生化特征 实验结果见表3。
综合拮抗菌A-2的各项生理生化特征,对照《常见细菌系统鉴定手册》中相应的属、种的相关性状,将拮抗菌A-2鉴定为产碱杆菌属(Alcaligenes)。
2.3.3 16S rDNA分子生物学鉴定结果 A-2菌株的PCR产物电泳图谱如图3。由图3电泳图谱可知,从该菌株提取16S rDNA的PCR产物,其纯度很高,只有一个条带,根据Mark比对,其碱基对为1300bp左右。将拮抗菌 A-2的16S rDNA序列提交到GenBank数据库,进行Blast比对,选择近缘10株菌的16S rDNA序列,应用MEGA 4.0软件进行多重比对,构建系统发育树,并进行Bootstrap测试,设置重复次数为1000次。A-2的系统进化树如图4。

图3 PCR产物电泳图谱Fig.3 The electrophoresis pattern of PCR products
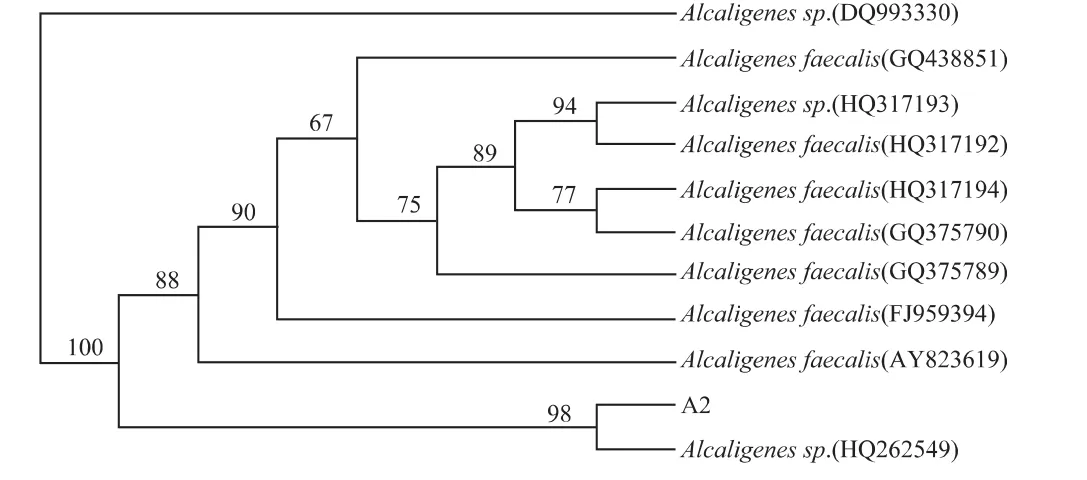
图4 A-2系统进化树Fig.4 System evolutionary tree of the strain A-2

表3 拮抗菌A-2的生理生化特征Table 3 The physiological and biochemical characters of antagonistic strain A-2
由图4可知,金黄色葡萄球菌拮抗菌A-2与Alcaligenes sp.(HQ262549)位于同一分支,1000次bootstrap分析支持该分支;并且A-2菌株在GenBank数据库比对中与Alcaligenes sp.(HQ262549)的相似度高达99.1%。
综合其形态特征、生理生化特征及16S rDNA序列分析结果,将该拮抗菌株A-2鉴定为Alcaligenes sp.(HQ262549)。
3 结论与讨论
微生物产生的活性物质大多为次级代谢产物,次级代谢产物形成的途径及种类与其生存环境息息相关,由于适应环境的结果,它们形成极为特殊的生理机制,并产生特殊的代谢产物[12]。有关Alcaligenes属菌株产生抗菌活性物质的研究已有报道,例如,沈颖从细薄星芒海绵中分离得到的一株粪产碱杆菌(Alcaligenes faecalis)A72,其次级代谢物(环D-脯氨酸D-苯丙氨酸)对多株指标菌有抗菌活性[13];林建朋从深海中筛选的海洋粪产碱杆菌(Alcaligenes faecalis)WL24,其次级代谢产物(一种抗菌蛋白)对水稻纹枯病、柿子炭疽病、玉米小斑病及蔬菜灰霉病等多种植物病原真菌有较强拮抗效果[14];Haruyama等人从(Alcaligenes faecalis SANK 74291的发酵产物中分离得到的B-1015是一种广谱抗生素,可以抑制革兰氏阳性细菌和革兰氏阴性细菌[15];Tokunaga等人从粪产碱杆菌(Alcaligenes faecalis)YL-026325发酵产物中分离的Kalimantacins A、B、C对表皮葡萄球菌(Staphylococcus epidermidis)和金黄色葡萄球菌(S.aureus)有很好的抑制作用[16]。总之,现已研究报道的这些菌株均为来自海泥或海洋动物共生菌。而本研究是以甘肃中部典型干旱生境(年降雨量仅为413.94mm)土壤为分离材料,首次分离获到了一株Alcaligenes属细菌,经形态学、生理生化及16S rDNA分子生物学方法鉴定,该拮抗菌为产碱杆菌属菌株Alcaligenes sp.。其对金黄色葡萄球菌、大肠杆菌、植物酸杆菌和表皮葡萄球菌均具有显著抑菌活性,其发酵液对4株供试食品腐败菌的抑菌最低浓度稀释梯度均为10-6,具有开发新型微生物防腐剂的潜力。
由于其干旱、营养贫瘠的生活环境与海洋生境迥异,因而长期的生长适应性必然导致微生物具有独特的生存对策及生理代谢途径,很可能不同于海洋微生物的代谢机制,并产生独特种类及结构的次级代谢产物。鉴于此,对于Alcaligenes sp.A-2菌株产生的次级代谢活性物质结构及其特性有待进一步深入研究。
[1]张红艳,林凯,阎春娟.国内外天然食品防腐剂的研究进展[J].粮食加工,2004(3):57-60.
[2]刘美玲,孔慧清,朱媛,等.新型微生物防腐剂-纳他霉素在食品研究中的应用[J].保鲜与加工,2007,7(5):1-3.
[3]魏艳红,阿不都克里木·热依木,熊鹰,等.三株沙漠放线菌XJSS-21、XJSS-39和XJSS-58的多相分类及特性研究[J].微生物学通报,2009,36(4):569-574.
[4]王正荣,生吉萍,田小磊,等.沙漠生物结皮高产胞外多糖菌株的筛选与鉴定[J].食品科学,2011,32(21):207-209.
[5]周德庆,胡宝龙,祖若夫,等.微生物实验教程[M].北京:高等教育出版社,2006:131-133.
[6]林敏,宁喜斌.具抑菌活性海洋微生物的筛选[J].微生物学杂志,2005,25(5):23-25.
[7]Ohno A,Ano T,Shoda M.Production of a lipopeptide antibiotic surfactin with recombinant Bacillus subtilis[J].Biotechnol Lett,1992,14(1):1165-1168.
[8]马永全,于新,黄雪莲,等.南药五味子提取物的抗菌及抗氧化作用[J].食品与发酵工业,2010,36(6):45-48.
[9]李清春,张景强.肉制品中微生物的分离及初步鉴定[J].食品工业科技,2005,26(3):83-85.
[10]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:349-388.
[11]Tamura K,Dudley J,Nei M,et al.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Molecular Biology and Evolution,2007,24(8):1596-1599.
[12]姜怡,李文均,徐平,等.盐碱环境放线菌多样性研究[J].微生物学报,2006(2):191-195.
[13]沈颖.海绵共附生粪产碱杆菌活性代谢产物的研究[D].上海:上海交通大学,2007.
[14]林建朋.拮抗植物病原真菌的海洋细菌筛选及其活性物质研究[D].武汉:华中农业大学,2011.
[15]Haruyama,Hideyuki,Kodama,et al.Antibiotic B-1015 and its fermentative manufacture with Alcaligenes[J].Jpn Kokai Tokkyo Koho,1993,3(1):7-12.
[16]Kazuma K,Yasuto S,Mitsuyoshi S et al.Kalimantacin A,B and C,novel antibiotics from Alcaligenes sp.YL-02632S[J].J Antibiot,1996,49(2):136-139.

