甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的发酵条件优化
李润静,张 涛,江 波,沐万孟,缪 铭
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
果聚糖(Levan)是一种以蔗糖为底物由果聚糖蔗糖酶(levansucrases,EC2.4.1.10)催化转移果糖残基到蔗糖的碳链上,促进碳链延伸,形成的β-2,6-果聚糖(图1)[1]。果聚糖结构上的特异性决定了它的性能不同于大多数天然聚合的多糖。果聚糖具有促进双歧杆菌增殖,改善肠道微环境;降低胆固醇和脂肪的吸收;调节血糖水平,降低糖尿病引起的氧化应激反应等生理功能。此外,果聚糖还具有保湿作用,可以应用于化妆品中。果聚糖蔗糖酶是糖基转移酶家族中的一员,它除了具有转糖基活性,还有水解活性,可以将蔗糖水解为葡萄糖和果糖。目前已经发现的可以产果聚糖蔗糖酶的微生物主要为细菌,如枯草芽孢杆菌(Bacillus subtilis)[2]、淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)[3]、多黏芽孢杆菌(Bacillus polymyxa)[4]、运动发酵单胞菌(Zymomonas mobilis)[5-6]、 金 山 乳 杆 菌 (Lactobacillus sanfranciscensis)[7-8]、肠 膜 明 串 珠 菌 (Leuconostoc mesenteroides)[9]、丁 香 假 单 胞 杆 菌 (Pseudomonas syringae)[10]、地衣芽孢杆菌(Bacillus licheniformis)[11]等。但它们产果聚糖的能力差别很大,产量大约在1~40g/L之间,其中大部分产量偏低。目前研究主要集中在微生物发酵产果聚糖上,而对发酵产果聚糖蔗糖酶的研究较少,然而用生物发酵法直接生产果聚糖会使果聚糖的后期纯化分离难度加大[12]。本研究主要针对本实验室筛选到的一株高产果聚糖蔗糖酶的新菌株进行发酵产酶条件优化,为进一步研究利用果聚糖蔗糖酶生产果聚糖奠定基础,这样通过果聚糖蔗糖酶与蔗糖直接反应,会简化后期果聚糖的分离纯化。

图1 果聚糖结构图Fig.1 Structure chart of levan
1 材料与方法
1.1 材料与仪器
甲基营养芽孢杆菌 SK21.002(Bacillus methylotrophicus SK 21.002)实验室筛选获得,前期工作中已鉴定该菌可以产生果聚糖蔗糖酶;种子培养基(g/L):蔗糖20,酵母提取物10,鱼粉蛋白胨5,K2HPO44.5,pH7.5;发酵基础培养基(g/L):同种子培养基。
高速冷冻离心机 德国eppendorf centrifuge 5804R;高效液相色谱仪 美国Agilent 1200;色谱分离柱 美国WATERS公司SugarparkⅠ;检测器 日本Shodex示差折光检测器。
1.2 实验方法
1.2.1 种子培养 取生长良好的斜面菌种2环,接种于种子培养基中,在30℃ 160r/min下培养15h得到种子液。
1.2.2 发酵培养 将活化的种子液按体积分数2%接到装有20%(v/v)发酵培养基的三角瓶中,30℃160r/min,振荡培养24h。
1.2.3 粗酶液的制备 取30mL发酵液冷冻离心(4℃,7500r/min,15min),所得菌体用去离子水洗涤两次,重新振荡悬浮于25mL磷酸缓冲溶液(pH6.0,20mmol/L)中,冰水浴超声破碎12min,最后将破碎的细胞液冷冻离心(4℃,10000r/min,10min),取上清液即为粗酶液。
1.2.4 酶活力测定方法 将0.5mL 20%(w/v)的蔗糖溶液与0.5mL粗酶液在pH6.0、20mmol/L的磷酸盐缓冲体系下混合均匀,在40℃水浴下反应20min,最后沸水浴煮沸10min终止反应,用高效液相法测定果糖、葡萄糖的生成量,确定酶活。色谱条件为:色谱柱:SugarparkⅠ钙型柱;柱温:85℃;流动相:纯水(经 0.45μm膜过滤);流速:0.4mL/min;上样体积:10μL。
果聚糖蔗糖酶酶活定义为:将40℃,pH6.0条件下每分钟转移1μmol葡萄糖所需的酶量定义为一个果聚糖蔗糖酶活力单位。
1.2.5 菌体生物量测定 采用细胞光密度(OD600nm)分析法:取发酵液适量,经过适当的稀释后,采用分光光度法测定OD值。
OD600nm=OD600读数×稀释倍数。
1.2.6 单因素实验 依次改变发酵基础培养基的碳源、氮源、金属离子,确定合适的发酵培养基组成,然后研究发酵培养条件(培养温度、初始pH、接种量、装液量和培养时间)对菌体生物量和果聚糖蔗糖酶产量的影响。
1.2.7 正交实验 选取蔗糖、酵母提取物、胰蛋白胨、K2HPO4、MgSO4、NaCl 6 个因素,采用 6 因素 3 水平的正交表(L18(36))设计实验,优化条件的因素水平如表1。
2 结果与讨论
2.1 培养基成分对甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的影响
2.1.1 碳源对甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的影响 改变起始发酵基础培养基中碳源的种类,分别以20g/L的葡萄糖、果糖、乳糖、麦芽糖、蔗糖、半乳糖、可溶性淀粉、甘油和菊糖作为唯一碳源配制发酵培养基,接种进行发酵产酶培养。从图2可以看出,在所用碳源中,以甘油为碳源时菌体的生长量最大,但产酶能力较低;在以蔗糖为碳源时菌体的生长良好,且对产酶的促进最明显。这可能是由于蔗糖作为该酶催化反应的底物对产酶有一定的诱导作用,这一结果与Karima[12]研究结果一致。故选用蔗糖作为碳源做进一步研究。
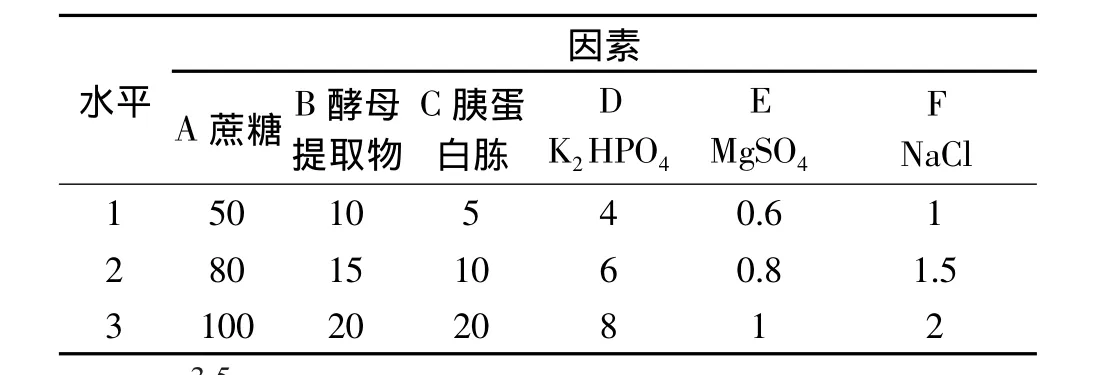
表1 正交实验因素水平表(g/L)Table 1 Factors and their levels in orthogonal array design(g/L)

图2 不同碳源对生物量和产酶的影响Fig.2 Effect of carbon source on biomass and levansucrase production
2.1.2 蔗糖浓度对甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的影响 将种子液分别接种于含有不同蔗糖浓度(20、50、80、100、150、200、250、300、350、400g/L)的发酵培养基中进行发酵产酶培养,结果如图3所示。
当蔗糖浓度在20~80g/L范围内时菌体生物量随着蔗糖浓度的增大而增大,之后随着蔗糖浓度继续增大菌体产量逐步下降。酶的产量变化也呈现相同的趋势,分析出现这种趋势的原因可能为:较高的蔗糖浓度会抑制菌体的生长。故选择蔗糖浓度80g/L做进一步研究。

图3 蔗糖浓度对生物量和产酶的影响Fig.3 Effect of sucrose concentration on biomass and levansucrase production
2.1.3 氮源对甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的影响 分别以15g/L的NaNO3、NH4NO3、尿素、鱼粉蛋白胨、胰蛋白胨、酵母膏、酵母提取物等为无机或有机单一氮源,以及复合氮源酵母提取物+鱼粉蛋白胨、酵母提取物+胰蛋白胨(2∶1,w/w),配制发酵培养基,进行最佳氮源筛选。实验结果如图4所示,甲基营养芽孢杆菌对无机氮源的利用率很低,菌体产量和酶产量均很低;而采用有机氮源时菌体和酶的产量都较高,其中采用复合有机氮源酵母提取物和胰蛋白胨时菌体和酶的产量都达到最大值。故选用复合有机氮源酵母提取物和胰蛋白胨作为氮源做进一步研究。

图4 氮源对甲基营养芽孢杆菌SK21.002生物量和产酶的影响Fig.4 Effect of nitrogen source on biomass and levansucrase production
2.1.4 金属离子对甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的影响 微生物生长繁殖和产物合成中需要供给无机盐和微量元素,如硫、镁、钙、锌、钻、钾、钠、锰等,作为其生理活性物质的组成或生理活性作用的调节物。这些物质一般在低浓度时对微生物生长和产物合成有促进作用,在高浓度时常表现出明显的抑制作用。在发酵培养基中分别加入0.8g/L 的 BaCl2、CaCl2、CuCl2、FeSO4、KCl、MgSO4、MnCl2、NaCl、ZnCl2进行发酵产酶培养,以只添加磷酸盐的培养基作为对照,考察金属离子对产酶的影响。由图5可以看出,Mg2+对菌体生长和产酶有显著的促进作用,这可能是因为Mg2+一般是微生物代谢路径里很多酶的激活剂,能促进糖代谢、核酸合成、磷酸盐转化等。另外Na+和K+对产酶也有一定的促进作用,而 Ba2+、Ca2+、Cu2+、Fe2+、Mn2+、Zn2+对菌体的生长和产酶有明显的抑制作用。但Karima对一株Bacillus sp.研究显示Fe2+对产酶有显著促进作用[12],可知果聚糖蔗糖酶的微生物来源不同对金属离子的依赖性也不同。由此确定,选取Mg2+、Na+和K+做进一步研究。

图5 金属离子对生物量和产酶的影响Fig.5 Effect of metal ions on biomass and levansucrase production
2.2 正交实验
比较本实验中 A、B、C、D、E、F 6个因素中 R 值的大小,可以看出C因素,即胰蛋白胨含量为重要因素,其次是D因素,即K2HPO4含量,再者是A因素,即蔗糖浓度,而E因素,即MgSO4浓度为不重要因素。6个因素的主次关系是:C>D>A>B>F>E。
根据各因素的最好水平选取A2B1C2D3E3F3为最优组合,即蔗糖80g/L,酵母提取物10g/L,胰蛋白胨10g/L,K2HPO48g/L,MgSO41g/L,NaCl 2g/L。经多次验证,用此培养基进行发酵产酶培养21h后产酶活力可达9.76U/mL。
2.3 培养条件对甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的影响
2.3.1 培养温度对甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的影响 温度可以影响微生物体内的许多反应,进而影响微生物的代谢活动。在一定温度范围内,生化反应速率随温度上升而加快;但当温度过高时,细胞功能下降以至死亡。为进一步研究培养温度对菌体生长和产酶的影响,将接种的发酵培养基分别在 26、28、30、32、34、36℃条件下进行发酵产酶培养。由图6可知,当培养温度低于30℃时菌体生长量和产酶量随温度的升高而增大,30℃时两者的产量都达到最大值,高于30℃时两者产量都会受到抑制,故选择最适发酵温度为30℃。
2.3.2 初始pH对甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的影响 分别调节培养基初始pH为4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5 进行发酵产酶培养,实验结果如图7所示,当初始pH低于6.5时,菌体生长量和产酶量随pH的增大而增大,pH6.5时菌体生长量和产酶量均达到最大值,但菌体的生长量在pH6.5左右变化不明显。目前报道的果聚糖蔗糖酶的最适pH大部分集中于5~6.5之间[12-13],故选择初始pH6.5做进一步研究。
2.3.3 装液量对甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的影响 摇瓶装液量的变化反映了溶氧水平的变化和营养的供应量。参考《伯杰氏手册》知,芽孢杆菌多数是好氧菌或者兼性厌氧菌,故在固定摇床转速160r/min的条件下,研究了250mL三角瓶中装液量10%~40%范围内菌体的生长量和产酶情况。由图8可以看出,在装液量低于35%时,菌体的生长随着装液量的增加而增大,当装液量大于35%时,菌体的生长量下降。同时装液量对产酶量也有显著影响,在30%的装液量时,酶合成最为旺盛,而在高于30%的装液量时酶的合成会受到抑制。故选择装液量30%做进一步研究。

表2 正交实验设计方案及结果Table 2 Orthogonal array design scheme and experimental results

图6 培养温度对生物量和产酶的影响Fig.6 Effect of temperature on biomass and levansucrase production

图7 初始pH对生物量和产酶的影响Fig.7 Effect of initial pH on biomass and levansucrase production
2.3.4 接种量对甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的影响 接种量对微生物的生长和代谢有一定的影响,合适的接种量对于缩短菌体在发酵培养基中生长延滞期,提高产率有着重要的影响。在其他条件相同的情况下,改变接种量,研究接种量对菌体生长量和产酶的影响。结果如图9所示,接种量在1%~3%之间时,无论是菌体的生长量,还是产酶量都较高,之后随着接种量的增加两者的产量均略有降低,故选择接种量2%为最适接种量。
2.3.5 发酵时间对甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的影响 从图10中可以看出,在0~48h的发酵过程中菌体产量和酶产量都出现较明显变化,但二者的变化趋势基本一致,这可能是因为本文所研究的果聚糖蔗糖酶为胞内酶,故菌体量的多少会直接影响酶的产量。在0~21h之间菌体的生长量和酶产量呈明显上升趋势,随着发酵时间的继续延长,菌体生长量和酶产量会逐渐降低。这主要因为随着发酵时间的延长培养基内营养物质减少,有害代谢产物增加,菌体生长进入衰亡期。因此,确定最佳发酵时间为21h。

图8 装液量对生物量和产酶的影响Fig.8 Effect of liquid medium volume on biomass and levansucrase production

图9 接种量对生物量和产酶的影响Fig.9 Effect of inoculation on biomass and levansucrase production
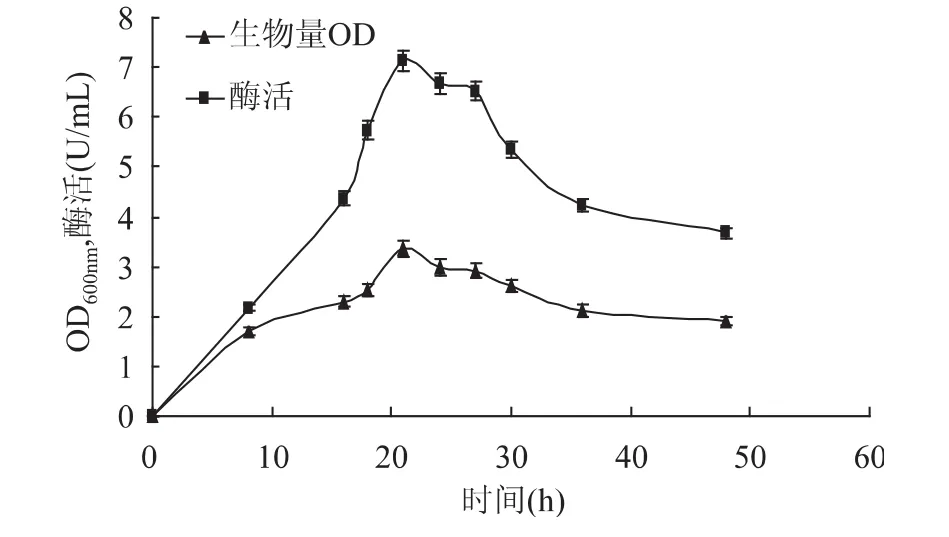
图10 发酵时间对生物量和产酶的影响Fig.10 Effect of time on biomass and levansucrase production
3 结论
对实验室筛选、保藏的甲基营养芽孢杆菌SK21.002产果聚糖蔗糖酶的条件进行了单因素实验和正交实验优化,确定了最适产酶发酵培养基为:80g/L,酵母提取物10g/L,胰蛋白胨10g/L,K2HPO48g/L,MgSO41g/L,NaCl 2g/L;最适产酶发酵条件为:初始 pH6.5,发酵温度30℃,装液量30%,接种量2%,发酵周期21h。在该培养条件下所产果聚糖蔗糖酶的酶活达到9.76U/mL,约为优化前的3.75倍,酶的产量得到了很大提高,为下一步利用果聚糖蔗糖酶生产果聚糖奠定了基础。
[1]Pierre M,Sophie B,Cécile A,et al.Homopolysaccharides from lactic acid bacteria[J].International Dairy Journal,2001(11):675-685.
[2]Ing-Lung S,Li-Dar C,Jane-Yii W.Levan production using Bacillussubtilisnatto cells immobilized on alginate[J].Carbohydrate Polymers,2010(82):111-117.
[3]FengT,LotthidaI,Salwa K,etal.Purification and Characterization of Levansucrase from Bacillus amyloliquefaciens in Intra-and Extracellular Forms Useful for the Synthesis of Levan and Fructooligosaccharides[J].Biosci Biotechnol Biochem,2011,75(10):1929-1938.
[4]Han Y W,Watson M A.Production of microbial levan from sucrose,sugarcane juice and beet molasses[J].Journal of Industrial Microbiology,1992,9(3/4):257-260.
[5]M Bekers,J Laukevics,D Upite,et al.Fructooligosaccharide and levan producing activity of Zymomonas mobilis extracellular levansucrase[J].Process Biochemistry,2002(38):701-706.
[6]Chiang C J,Wang J Y,Chen P T,et al.Enhanced levan production using chitin-binding domain fused levansucrase immobilized on chitin beads[J].Applied Microbiology and Biotechnology,2009,82(3):445-451.
[7]Kaditzky S,Seitter M,Hertel C,et al.Performance of Lactobacillus sanfranciscensis TMW 1.392 and its levansucrase deletion mutant in wheat dough and comparison of their impact on bread quality[J].Europe Food Research Technology,2008,227(2):433-442.
[8]Tieking M,Ehrmann M A,Vogel R F,et al.Molecular and functional characterization of a levansucrase from sourdough isolate Lactobacillus sanfranciscensis TMW 1.392[J].Applied Microbiology and Biotechnology,2005,66(3):655-663.
[9]Morales-arrieta S,Rodriguez M E,Segovia L.Identification and functional characterization of levS,a gene encoding for a levansucrase from Leuconostoc mesenteroides NRRL B-512 F[J].Gene,2006,376(1):59-67.
[10]Triinu V,Karin M,Cristina M,et al.Levansucrases from Pseudomonas syringae pv.tomato and P.chlororaphis subsp.aurantiaca:Substrate specificity,polymerizing properties and usage of different acceptors for Fructosylation[J].Journal of Biotechnology,2011(155):338-349.
[11]陆娟,肖敏,卢丽丽.地衣芽孢杆菌产Levan果聚糖发酵条件的优化[J].食品科学,2011,32:183-187.
[12]Karima S B,Imen D,Hafedh B,et al.Microbal production of levansucrase for synthesis of fructooligosaccharides and levan[J].International Journal of Biological Macromolecules,2012,50:451-458.
[13]Lazaro H,Juan A,Carmen M,et al.Isolation and enzymic properties of levansucrase secreted by Acetobacter diazotrophicus SRT4,a bacterium associated with sugar cane[J].Biochem J,1995,309:113-118.

