分子印迹交联壳聚糖树脂对镉的吸附性能研究
冯 沙,吴晓萍,王 涛
(广东海洋大学食品科技学院,广东湛江524088)
近年来,随着海洋资源的开发与利用,海洋污染程度逐渐加剧,近海环境中的重金属污染颇受到关注[1-3]。重金属离子可在海洋生物体内或组织中积累,再通过生物富集作用,直接或间接威胁到人类的健康。重金属离子在低浓度时就会对人体造成一定的伤害,必须采用物理方法去除污水中的重金属离子以满足越来越严格的环境质量标准的要求,而吸附法被认为是去除重金属离子既有效又经济的方法[4-5]。壳聚糖(CTS)是甲壳素脱乙酰化产物,资源丰富,是具有广泛应用价值的天然高分子材料,由于其分子中含有大量游离的氨基和羟基基团,因此对重金属离子具有很好的吸附性能,但壳聚糖质软、酸溶、难成型、难回收、专一性不强等缺陷制约了它的实际应用[6-7]。近年来,以壳聚糖作为分子印迹的载体也已有一些报道,主要集中于金属离子、小分子有机物等吸附性能的研究。本文通过实验室条件,利用柠檬酸与镉能形成络合物的特点,并采用戊二醛作为交联剂,对壳聚糖分子进行改性而制备的分子印迹交联壳聚糖树脂(MICCR)为基础材料[8],系统研究了MICCR对Cd(Ⅱ)的吸附性能,并考察了pH对MICCR吸附性能的影响以及MICCR的重复吸附性能,为MICCR作为重金属吸附剂的应用提供了一定的理论依据。
1 材料与方法
1.1 材料与仪器
MICCR 自制;氯化镉 分析纯;柠檬酸 分析纯;盐酸 优级纯;氢氧化钠 分析纯;无水乙醇分析纯;实验用水为超纯水。
Z-5000偏振塞曼原子吸收光谱仪 日本日立公司;TD5台式离心机 长沙英泰仪器有限公司;PHS-3B酸度计 上海雷磁仪器厂;HYA恒温摇床 中国科学院武汉仪器厂。
1.2 实验方法
1.2.1 吸附容量的测定 准确称取0.1000g MICCR,置于100mL的锥形瓶中,量取20mL CdCl2和柠檬酸(均为0.05mol/L)的混合溶液加入其中,室温摇床振荡4h,过滤,滤液用1%的硝酸溶液稀释,用石墨炉原子吸收光谱法测定吸附前后溶液中Cd(Ⅱ)的浓度,依照公式(1)计算吸附容量Q:

式中:Q为吸附容量,mg/g;C0为吸附前溶液中Cd(Ⅱ)的浓度,ng/mL;C1为吸附后溶液中Cd(Ⅱ)的浓度,ng/mL;V为溶液的体积,mL;W为MICCR的用量,g。
1.2.2 pH的影响 准确称取0.1000g MICCR若干份,置于100mL的锥形瓶中,量取20mL pH分别为3.5、4.0、4.5、5.0、5.5、6.0 的 CdCl2和柠檬酸(均为0.1mol/L)的混合溶液加入其中,室温摇床振荡4h,按1.2.1方法测定MICCR对Cd(Ⅱ)的吸附容量,以pH为横坐标,吸附容量为纵坐标绘制曲线。
1.2.3 吸附动力学实验 准确称取0.1000g MICCR若干份,分别置于100mL的带塞锥形瓶中,量取20mL CdCl2和柠檬酸(均为0.01mol/L)的混合溶液加入,调pH4.5,在不同时间后分别取样,过滤,用1%的硝酸溶液稀释,用石墨炉原子吸收光谱法测定溶液中Cd(Ⅱ)的浓度,并分别计算不同时间的吸附容量。以吸附容量Q对时间t作图,可得到MICCR对Cd(Ⅱ)的吸附动力学Q-t曲线。
1.2.4 吸附热力学实验 准确称取0.1000g MICCR若干份,分别置于100mL的带塞锥形瓶中,量取20mL不同浓度的CdCl2和柠檬酸的混合溶液加入其中,调pH4.5,室温摇床振荡4h,过滤,用1%的硝酸溶液稀释,用石墨炉原子吸收光谱法测定溶液中Cd(Ⅱ)的浓度,平衡浓度Ce和吸附容量Q,作Q-Ce曲线。
1.2.5 重复吸附性能 用MICCR吸附水溶液中的Cd(Ⅱ),过滤,取已吸附Cd(Ⅱ)的MICCR放入带塞三角瓶中,用0.1mol/L的盐酸浸泡过夜,并反复淋洗,直至洗脱液中用原子吸收光谱法检测不出Cd(Ⅱ)为止,而后用水反复淋洗,洗去多余的盐酸,再用0.1mol/L的NaOH溶液浸泡树脂2h,最后用水清洗至洗脱液为中性后于60℃干燥。重复实验5次,分别测定MICCR的吸附容量。
2 结果与讨论
2.1 吸附容量的测定
从表1中可以看出,CTS对Cd(Ⅱ)的吸附容量较高,MICCR对Cd(Ⅱ)的吸附容量稍有下降,这可能是因为CTS与戊二醛发生交联反应时,部分-NH2、-OH等活性基团发生反应,且MICCR的机械强度增强,空间位阻增加,部分活性官能团被包埋于网状结构内部,阻碍与Cd(Ⅱ)的配位作用,因此MICCR对Cd(Ⅱ)的吸附容量稍有降低。

表1 MICCR和CTS对Cd(Ⅱ)的吸附容量比较Table 1 Comparison of the adsorption capacity of MICCR and CTS on Cd(Ⅱ)
2.2 吸附镉最佳pH的确定
MICCR对Cd(Ⅱ)的吸附与介质的pH关系曲线如图1所示,MICCR对Cd(Ⅱ)的吸附实际上是通过对Cd-柠檬酸络合物的吸附而实现的,这一原理与相同条件下壳聚糖对Cd(Ⅱ)的吸附原理[9]相符。从图中可以看出,当溶液的pH为4.5时,其吸附容量达到最大值,吸附容量达170.4mg/g。随着pH的升高,吸附率随之下降,这可能是因为:在 pH过低时,MICCR上-NH2形成-NH+3,对Cd-柠檬酸络合物的络合能力下降,从而对Cd(Ⅱ)的吸附率也降低;随着pH的升高,H+与-NH2间的相互作用减弱,-NH2游离,从而对Cd(Ⅱ)的络合能力也随着增强;但当pH超过4.5时,Cd-柠檬酸络合物会发生解离,溶液中Cd-柠檬酸络合物的数量减少,MICCR对Cd(Ⅱ)的吸附率会随之降低。因此可确定,MICCR吸附Cd(Ⅱ)的最佳pH为4.5。
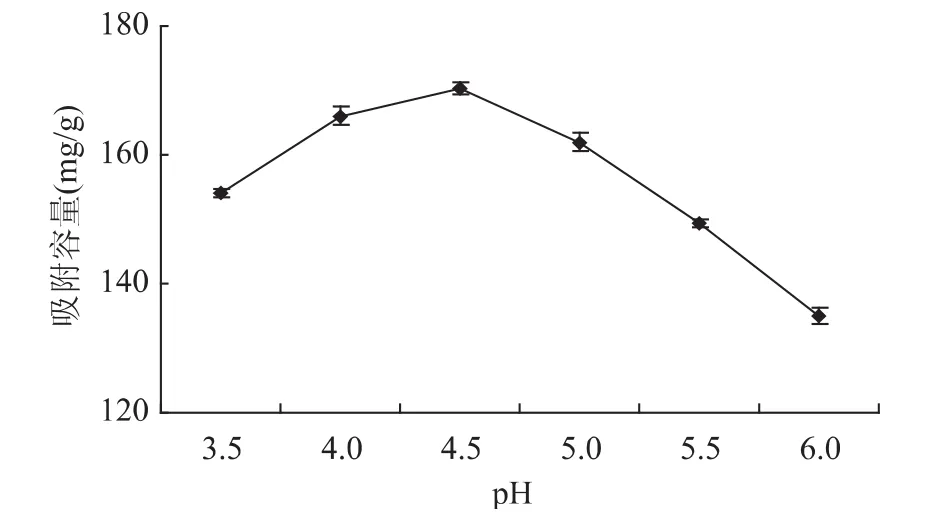
图1 pH对MICCR吸附容量的影响Fig.1 The effect of the pH value on the adsorption capacity of MICCR
2.3 吸附动力学的建立
图2为时间对MICCR吸附容量的影响,由图可知,在前1.33h(80min)内,随着时间的增加,MICCR对Cd(Ⅱ)的吸附量急剧增大,由于MICCR是不溶于水的固体,因此,此阶段主要是Cd(Ⅱ)穿过液膜到达MICCR表面;当吸附时间在1.33~1.67h(80~100min)时,吸附量增加缓慢,此阶段主要是Cd(Ⅱ)从MICCR表面进入内部,到达吸附位点,决定了吸附总过程的速度;而在吸附时间为1.67~4h(100min~4h)内,吸附量迅速增加,吸附量达到166.4mg/g,此阶段为Cd(Ⅱ)被MICCR的吸附位点吸附;此后,随着时间的延长,吸附量变化平缓,这是因为随着Cd(Ⅱ)扩散进入MICCR内部完成吸附后,MICCR中吸附位点逐渐减少,当MICCR对Cd(Ⅱ)吸附饱和后,延长吸附时间,吸附量不再增大,因此吸附时间以4h为宜。
为考察MICCR吸附Cd(Ⅱ)的动力学规律,分别应用一级动力学模型和二级动力学模型对实验结果进行拟合。
一级吸附动力学方程[10]为:
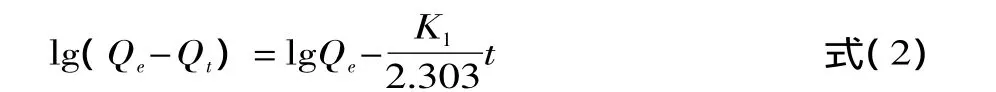
二级吸附动力学方程[11]为:


表2 MICCR对Cd(Ⅱ)吸附动力学参数Table 2 Parameters of MICCR on the the adsorption of Cd(Ⅱ)

图2 时间对MICCR吸附容量的影响Fig.2 The effect of time on the adsorption capacity of MICCR
式中,K1为一级吸附速率常数,h-1;K2是吸附动力学常数,g·mg-1·h-1;Qt为t(h)时刻吸附容量,mg/g;Qe为平衡时刻吸附容量,mg/g;t为吸附时间,h。
以lg(Qe-Qt)为纵坐标,t为横坐标,可求出K1。由图3(a)可看出,R2仅为0.7100,相关性不明显,因此MICCR对Cd(Ⅱ)的吸附并没有完全遵循一级动力学模型。
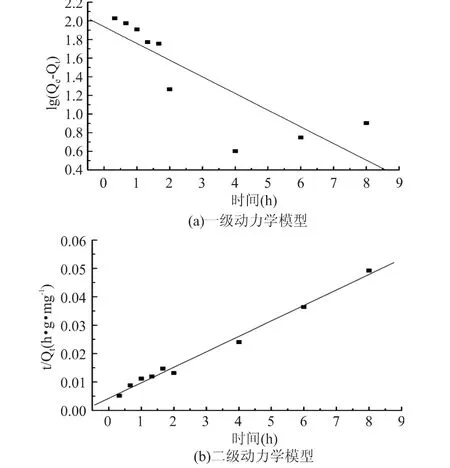
图3 MICCR对Cd(Ⅱ)的吸附动力学Fig.3 Adsorption kinetics of MICCR on the adsorption of Cd(Ⅱ)
以t/Qt为纵坐标,t为横坐标,可求出K2。由图3(b)可看出,R2达到0.9905,说明MICCR对Cd(Ⅱ)的吸附较好地符合二级动力学模型,吸附速率为6.97g·g-1·h-1。
根据一级动力学和二级动力学模型公式可以计算平衡吸附容量以及吸附常数,结果见表2。从表2中可看出,由一级动力学模型计算得到的平衡吸附容量值(86.4mg/g)比实验平衡吸附容量值(170.4mg/g)相差84.0mg/g,而由二级动力学模型计算得到的平衡吸附容量值(183.5mg/g)比实验值仅相差13.1mg/g,进一步验证了MICCR对Cd(Ⅱ)的吸附更符合二级动力学模型。这表明MICCR与金属离子Cd(Ⅱ)之间形成了配位结合[12]。
2.4 吸附热力学的建立
金属离子的等温吸附方程常用Langmuir模型和Freundlich模型来描述。Langmuir等温吸附方程[13-14]:

式中:Ce是重金属溶液平衡浓度,mg/L;Qe是吸附容量mg/g;KL是吸附分配系数L/mg;Qm是最大吸附容量,mg/g。
Freudlich 等温吸附方程[15-16]:

式中,Qm是最大吸附容量,mg/g;n是表示吸附强度的常数。
图4(a)和(b)分别为一元线性回归Ce/Qe-Ce的Langmuir曲线和lgQe-lgCe的Freundlich曲线。比较两图可以看出,Langmuir吸附等温线能更好地描述MICCR对Cd(Ⅱ)的吸附行为,而对Freundlich吸附等温线符合程度要差一些。Langmuir认为吸附剂固体表面有大量的活性吸附中心点组成,吸附只在这些活性中心点发生,活性中心的吸附作用范围大致与分子大小相当,每个活性中心只能吸附一个分子,当表面活性吸附中心全部被占满时吸附量达到饱和值,在吸附剂表面上分布被吸附物质的单分子层。即MICCR对Cd(Ⅱ)的吸附是以单分子层吸附形式进行的。
通过对Langmuir和Freundlich模型计算,结果见表3。MICCR对Cd(Ⅱ)的理论最大平衡吸附容量分别是214.6和7.690mg/g。由于MICCR对Cd(Ⅱ)的吸附更适用于Langmuir模型,所以室温下,溶液pH为4.5的条件下,MICCR对Cd(Ⅱ)的理论最大平衡吸附容量是214.6mg/g。

表3 MICCR对Cd(Ⅱ)吸附的Langmuir和Freundlich参数Table 3 Langmuir and Freundlich parameters of MICCR on the adsorption of Cd(Ⅱ)
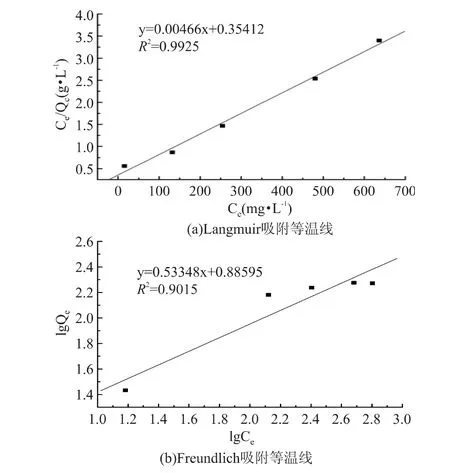
图4 MICCR对Cd(Ⅱ)的吸附等温线Fig.4 Adsorption isotherm of MICCR on the adsorption of Cd(Ⅱ)
2.5 重复吸附性能
用MICCR吸附水溶液中的Cd(Ⅱ),将已吸附Cd(Ⅱ)的MICCR分别用盐酸和氢氧化钠将Cd(Ⅱ)洗脱,使MICCR再生,用再生后的MICCR继续吸附水溶液中的Cd(Ⅱ),由图5可以看出,重复再生5次,MICCR对溶液中Cd(Ⅱ)的吸附容量变化不大,初始吸附容量为170.4mg/g,重复再生5次后吸附容量为163.2mg/g,其变化差仅为7.2mg/g,表明MICCR对Cd(Ⅱ)的重复使用性良好。因此,通过交联反应和分子印迹技术改进了壳聚糖吸附剂的重复吸附性能,MICCR吸附镉的性能稳定。

图5 MICCR对Cd(Ⅱ)重复吸附性能Fig.5 Repeated adsorption performance of MICCR on the adsorption of Cd(Ⅱ)
3 结论
MICCR对 Cd(Ⅱ)的吸附容量为 170.4mg/g,MICCR吸附Cd(Ⅱ)的最佳pH为4.5。MICCR对Cd(Ⅱ)的吸附较好地符合二级动力学模型,R2=0.9905,吸附速率为6.97g·g-1·h-1,且由二级动力学模型计算所得的平衡吸附容量值183.5mg/g与实验平衡吸附容量值170.4mg/g很接近。Langmuir模型能更好地描述MICCR对Cd(Ⅱ)的吸附行为,且通过对Langmuir模型计算,MICCR对Cd(Ⅱ)的理论最大平衡吸附容量是214.6mg/g。通过交联反应和分子印迹技术改进了壳聚糖吸附剂的再生性能,MICCR吸附镉的性能稳定。
[1]宋德宏.大连近岸海域贝壳与海水重金属含量的相关性研究[D].大连:大连海事大学,2007.
[2]马元庆,张秀珍,孙玉增,等.栉孔扇贝对重金属的富集效应研究[J].水产学报,2010,34(10):1572-1578.
[3]陈海刚,林钦,蔡文贵,等.3种常见海洋贝类对重金属Hg、Pb和Cd的积累与释放特征比较[J].农业环境科学学报,2008,27(3):1163-1167.
[4]黄君涛,熊帆,谢伟立,等.吸附法处理重金属废水研究进展[J].水处理技术,2006,32(2):9-12.
[5]Lothen B B,Furrer G.Immobilization of Zinc and Cadmium by montmorillonite compounds:Effects of aging and subsequent acidification[J].Environment Science Technology,1999,33(17):2945-2952.
[6]王爱勤.甲壳素化学[M].北京:科学出版社,2008.
[7]庄金娟,王香梅.改性壳聚糖的研究进展及其应用前景[J].天津化工,2011,25(3):7-9.
[8]广东海洋大学.一种印迹交联壳聚糖树脂的制备及其脱除马氏珠母贝匀浆液中镉的应用:中国,101928404[P].2010-12-29.
[9]吴晓萍,廖艳,章超桦,等.柠檬酸和琥珀酸提取牡蛎匀浆液中镉的研究[J].上海海洋大学学报,2011,20(3):462-465.
[10]Ho Y S.Adsorption of dye from aqueous solution by peat[J].Chemical Engineering,1998,70:115-124.
[11]Ho Y S.Review of second-order models for adsorption systems[J].Hazard Materials,2006,136:681-689.
[12]Ngahw S,Kamari A N.Adsorption behavior of Fe(ò)and Fe(ó)ions in aqueous solution on chitosan and cross-linked chitosan beads[J].Bioresource Technology,2005,96:443-450.
[13]Langmuir.The constitution and properties of liquids[J].American Chemical Sosiety,1916,38:2221-2295
[14]Langmuir.The adsorption of gases on plane strafes of glass mien and plat[J].Process Biochemical Society,1918,40:1361-1403.
[15]Freundlieh.HMF.Over the adsorption in solution[J].Physical Chemitry,1906,57:385-470.
[16]符迈群,唐兰模,张萍,等.壳聚糖吸附Cr(VI)的机理研究[J].四川联合大学学报:工程科学版,1997,1(5):8-13.

