利用变温提高汉逊酵母发酵生产谷胱甘肽的研究
钱卫东,付云芳
(陕西科技大学生命科学与工程学院,陕西西安710021)
谷胱甘肽是一种广泛存在于生物体内的活性三肽,可参与多种生物学反应[1],在临床,医药,食品加工以及化妆品等领域具有广阔的应用前景[2]。目前,GSH的生产方法主要有萃取法、化学合成法、发酵法、固定化酶法[3]。其中,利用微生物发酵生产GSH日益受到广泛关注,这主要由于微生物具有培养简单、易于高密度发酵、成本相对较低等优点,已成为生产GSH最有效的方法[4]。发酵生产GSH所用菌种最为常用的是酵母菌,其中酿酒酵母属、假丝酵母属、汉逊酵母属和裂殖酵母属胞内谷胱甘肽含量较高。张文燕等[5]利用流加培养基进行高密度培养产朊假丝酵母,其GSH的产量达1458mg/L;陈珊[6]高密度培养酿酒酵母,其GSH的产量只有68.49mg/L。值得注意的是,多形汉逊酵母(Hansenula polymorpha,H.polymorpha)作为生产GSH菌种研究较少,该酵母是一种耐热酵母,最高生长温度达49℃,其具有如下优点如生长、分裂速度较快,生存力强,易于高密度发酵培养,能在廉价的合成或半合成培养基上高密度生长[7-8]。这不仅可以缩短发酵时间,降低对发酵设备的制冷要求,从而极大地减少大规模培养成本和其发酵时受污染的风险。因此,本研究以H.polymorpha DL-1作为出发菌株,运用两阶段温度调控进行高密度培养发酵生产GSH。
1 材料与方法
1.1 材料与仪器
多形汉逊酵母(Hansenula polymorpha DL-1) 为中国科学院微生物研究所邱并生研究员惠赠;YEPD固体培养基(g/L) 葡萄糖20;蛋白胨20;酵母膏10、琼脂粉10,pH6.5,0.1MPa灭菌20min;种子培养基(g/L) 葡萄糖20,蛋白胨20,酵母膏10,pH6.5,0.1MPa灭菌20min;发酵培养基(g/L) 葡萄糖20,(NH4)2SO415,K2HPO4,MgSO41.8,CaCl20.28,微量元素母液1mL;微量元素母液(mg/L) KI 207.5,Na2MOO4·2H2O 484,MnSO4·H2O 76;GSH标准品 华美生物工程公司;5,5-二硫代双(2-硝基苯甲酸)(简称DTNB) Sigma公司;其余试剂 均为国产分析纯,陕西西安永屹化学试剂有限公司。
752紫外光栅分光光度计 上海第三分析仪器厂;TCL-16C高速离心机 上海离心机仪器有限公司;5L全自动发酵罐BIOTECH-5BGZ 上海保兴生物设备工程有限公司。
1.2 实验方法
1.2.1 培养方法
1.2.1.1 种子培养 将斜面种子在37℃活化3~4h后,取一环酵母菌体接种至装有50mL种子培养基的250mL三角瓶中培养,摇床转速110r/min,温度37℃,培养时间24h。
1.2.1.2 摇瓶分批发酵培养 将培养好的种子培养液按照10%(v/v)的接种量,接种至装有50mL发酵培养基的250mL三角瓶中进行发酵培养,发酵时间48h,转速为110r/min。每批实验设计都安排有3组平行对照样,取实验结果的平均值进行分析和计算。
1.2.1.3 变温发酵 45℃,110r/min,初始pH6.5,45℃发酵16h后将温度调节为37℃,同时pH调节为5.5,继续发酵32h。
1.2.1.4 发酵罐分批培养 5L全自动发酵罐BIOTECH-5BGZ装液量3L,接种量10%(v/v),通气量5.0L/min,溶氧和pH分别采用溶氧电极和电极在线测量,通过流加50%(v/v)NH3·H2O溶液自动调节pH6.5左右,转速为200r/min。
1.2.2 分析测定方法
1.2.2.1 谷胱甘肽的测定 取新鲜的发酵液5mL,7000r/min离心10min,上清液用于胞外GSH的测定,沉淀的酵母细胞用于胞内GSH测定。GSH的测定采用DTNB[5,5′-二硫双2-(硝基苯甲酸)]法,取上述上清液0.5mL,加入1.5mL 0.06%NaOH,0.5mL 0.03%(v/v)甲醛,摇匀,静置2min,加入2.5mL DTNB分析液,摇匀,在25℃水浴中保温5min,测定412nm吸光度[9-10]。
1.2.2.2 胞内谷胱甘肽的提取 将得到的新鲜酵母用蒸馏水洗涤两次,加入等量的磷酸缓冲溶液-20℃冷冻过夜后取出煮沸10min,7000r/min离心10min得上清液[11],用于胞内GSH检测。
1.2.2.3 细胞干重的测定(Dry Cell Weight,DCW) 一定量的发酵液离心后用蒸馏水洗涤两次得到的新鲜细胞在85℃下烘至恒重,称量。
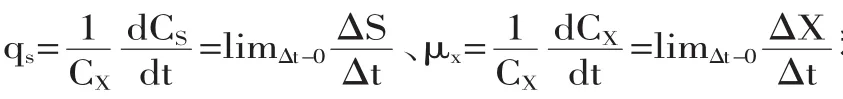
1.2.2.6 残留葡萄糖测定 采用3,5-二硝基水杨酸法[13]。
2 结果与分析
2.1 温度对GSH的影响
温度对微生物细胞生长代谢及产物形成的影响是多重的,温度既可以改变培养基的性质,还影响细胞代谢过程中各种关键酶的活性,因此在发酵过程中必须保证合适的温度环境。本文在不同温度下恒温发酵48h,期间每隔6h取样分别测定生物量及GSH总量,结果如图1所示。从图1中可见温度对DCW和GSH的总量影响明显,由图1(a)可知培养温度为30℃时细胞生长速率显著增加,发酵结束后DCW最大,达到5.74g/L;从图1(b)可见,培养温度为37℃时GSH生成速率最大,发酵结束后GSH总量达到126.15mg/L,与30℃相比GSH总量提高了2.96倍,但DCW却下降了52.4%,且温度低于或高于37℃,GSH的产量均下降明显。综合两者可以看出,细胞生长和GSH生产最适温度不同,因此,本实验运用变温控制以满足细胞生长和GSH生产两方面的要求,以实现提高细胞反应过程中目的产物的量。
2.2 初始pH对GSH产量影响
pH的变化将影响胞内各种酶活、底物的利用速度和细胞结构,从而影响细胞生长和产物形成。本研究运用不同初始pH(5.5、6.5、7.5、8.5、9.0)进行发酵,结果如图2所示,从图2中可以看出,初始pH6.5时酵母菌的生物量最高(8.5g/L);pH5.5发酵48h后,GSH总量及DCW分别为87.88mg/L及5.74g/L,即胞内GSH含量为15.31mg/g。该实验结果表明,初始pH6.5有利于细胞生长,而pH较低时促进GSH生产,由于酵母发酵过程中产酸,促使pH降低,因此本研究初始pH调节为6.5以利于细胞生长,其次改变温度同时将pH调至5.5。
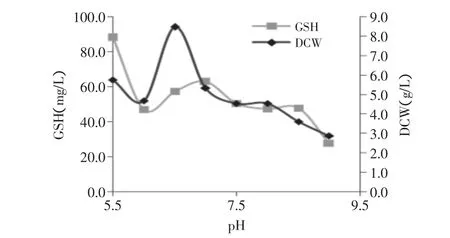
图2 初始pH对GSH及DCW总量的影响Fig.2 Effect of initial pH on productions of GSH and DCW
2.3 变温调控分批发酵
经上述实验确定了H.polymorpha DL-1发酵生产GSH过程中,菌体的最适生长温度与GSH的最适生产温度不同。同时,根据GSH在生物细胞抵御外界环境条件改变引起的刺激和胁迫中起非常重要的作用,并且影响细胞生长和GSH生产,因此在发酵过程采用两相温度控制策略,改变温度,刺激细胞,结合两阶段pH提高GSH的总量,结果如表1所示。由此可见,当发酵16h后将温度由45℃降低为37℃继续发酵32h,GSH胞内及胞外产量分别是30℃恒温发酵48h的10.51倍及4.56倍,即GSH含量由11.67mg/g提高到105.19mg/g,但相比于30℃恒温发酵DCW降低了29.8%;相比于45℃恒温发酵48h,DCW、GSH总量和GSH含量分别提高了1.07倍、12.91倍及5.66倍。结果表明,温度可以改变影响菌体代谢,促使菌体大量合成GSH满足自身需求,以应对细胞内部环境的变化,减少细胞损伤;同时,细胞表面的通透性发生改变,致使胞外GSH含量增加。
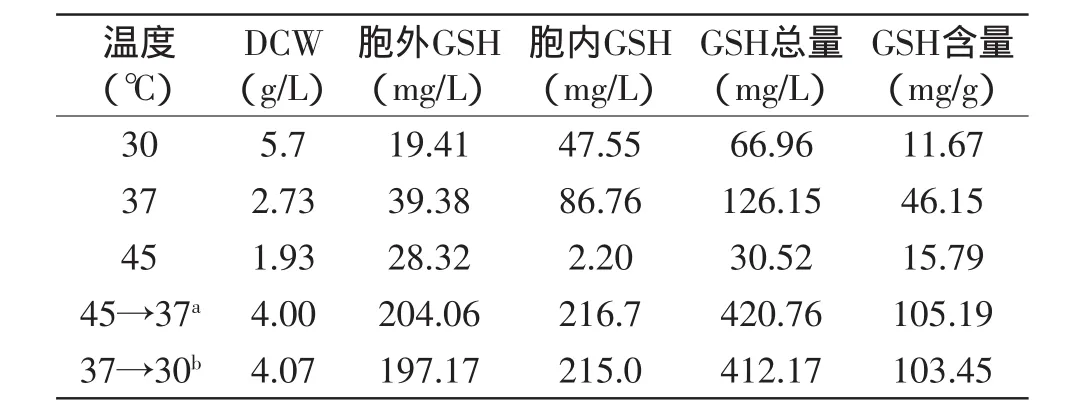
表1 变温调控对GSH产量及菌体生物量影响Table 1 Effect of the temperature-shift strategy on productions of GSH and DCW
比较发酵过程中温度由45℃降低为37℃及37℃降为30℃实验结果,由此可知,两种条件下DCW及GSH总量相差不大,但综合考虑高温发酵既可大幅增加胞外GSH含量,简化下游分离技术,又能降低发酵过程中冷却能耗,降低生产成本,因此应采用45℃培养16h,将温度降低为37℃继续培养32h的温度调控策略。
2.4 发酵罐分批发酵
采用5L全自动发酵罐BIOTECH-5BGZ进行高密度发酵生产GSH,45℃,200r/min发酵16h将温度降低到37℃,同时流加0.5%(w/v)的葡萄糖,流速为12.5mL/h,继续发酵42h,每隔一定时间取样测定发酵液DCW、GSH及残留葡萄糖浓度,结果如图3中所示。由此可知,菌体浓度随着培养时间的增加不断升高,培养60h后DCW增加到42.35g/L,GSH产量在12h迅速增长,12~48h内GSH增加缓慢,60h时GSH达927.68mg/L;而GSH含量在4h时达最大134.72mg/g,随着培养时间的延长逐渐降低;培养基中葡萄糖浓度在12h只有1.9g/L,即葡萄糖消耗达90.05%,此时开始流加葡萄糖,40h葡萄糖浓度降低到0.53g/L。随后培养基中残糖浓度有缓慢增加的趋势,但增加幅度较小,60h时增加为5.69g/L。实验结果表明,采用变温调控高密度发酵GSH总量只是摇瓶发酵(420.76mg/L)的2.3倍,且随着细胞密度的提高,GSH含量降低,因而提高GSH含量成为细胞高密度培养生产GSH的关键。

图3 发酵罐分批发酵过程中GSH、DCW总量(A)及残糖量(B)随时间变化曲线Fig.3 Time-courses of cell growth,glutathione production(A)and glucose consumption(B)within the batch fermentation
图4为发酵罐分批发酵过程中qs、μx和qp随发酵时间变化过程。由图4可见,发酵4h时qs、μx和qp均达最大值分别为0.92、0.72、0.03h-1,随后12h,qs、和qp迅速降低到0.001h-1,并趋于平稳。表明发酵过程中前4h内菌体生长代谢旺盛、产物合成较快,但随着培养时间延长,底物消耗及产物积累均影响GSH合成,导致GSH积累缓慢,因此,在扩大培养中应综合多个因素的影响改进发酵工艺。
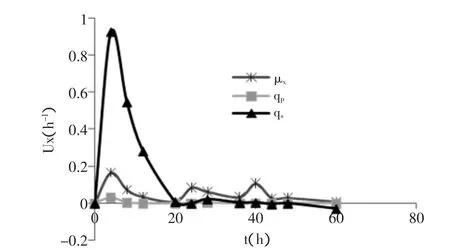
图4 分批发酵过程中qs、μx和qp随培养时间变化曲线Fig.4 Time-courses of specific glucose consumption rate,specific cell growth rate,specific glutathione production rate
表2为其他条件相同,恒温发酵及变温发酵结束后发酵液中DCW及GSH总量,由此可知,采用本文提供方法变温发酵60h,DCW及GSH比恒温发酵均有所提高,相比于37℃恒温发酵分别提高了13.38%、27.92%,综合以上结果可知,采用变温发酵方法提高H.polymorpha DL-1发酵生产GSH的产量可行。
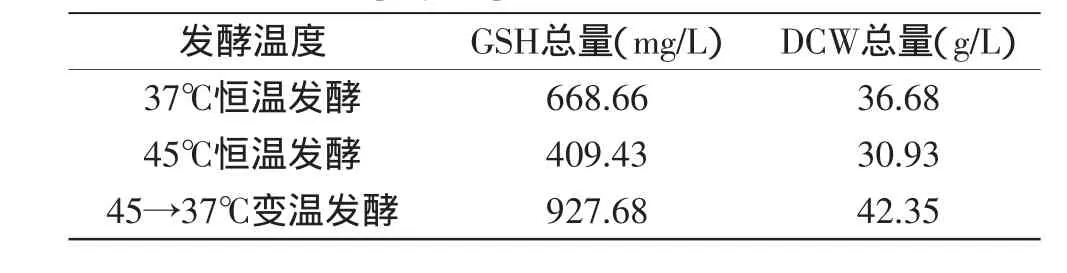
表2 发酵60h后DCW和GSH总量Table 2 The total productions of GSH and DCW after cultured H.polymorpha DL-1 for 60h
3 结论
通过对H.polymorpha DL-1发酵生产GSH的初步研究,提供了一种提高GSH产量的方法,主要依据温度变化影响微生物胞内代谢过程,以及细胞生长的最适生长温度和其产物生成温度不同的原理,通过最适反应温度的理性调控,提高GSH产量。首先,通过单因素实验确定了H.polymorpha DL-1的最适生长温度、培养基的初始pH和GSH合成的最佳温度分别为30℃、pH6.5和37℃;其次,通过变温调控分批发酵,确定最佳变温条件为:45℃培养16h后将温度降低为37℃继续培养32h,采用该方法摇瓶发酵后GSH可达420.76mg/L,比37℃恒温培养提高约2.34倍,且胞内GSH积累幅度显著增加,说明采用该方法提高GSH产量可行性高;最后,通过发酵罐扩大培养,GSH产量增加到927.68mg/L,相比摇瓶发酵提高2.3倍,但DCW却是摇瓶发酵(4.00g/L)的10.4倍。由此可见,微生物发酵过程是一个多因素综合影响的结果,本研究结果适于H.polymorpha DL-1摇瓶发酵生产GSH,实际生产中还需要对多因素如接种量、前体氨基酸及溶氧等条件进行优化。
4 讨论
梁国斌等[3]以产朊丝酵母WSH02-08为出发菌株,提出了三阶段(分批培养、指数速率流加和恒速流加)细胞高密度培养策略,并在该策略的基础上考察了底物添加对GSH产量的影响,随后将该策略应用于7L发酵罐,最终GSH产量达1952mg/L。此外,通过添加葡萄糖和硫酸铵再生ATP促进GSH合成,发酵条件优化后GSH产量达2136mg/L。Vira M Ubiyvovk等[14]以H.polymorpha DL-1为野生菌株,采用基因工程手段构建GSH的超表达基因,转化H.polymorpha DL-1菌株并筛选出GSH高产菌,在最佳条件下进行流加葡萄糖高密度发酵GSH产量高达2300mg/L,但未对其发酵策略进行深入研究。这些表明H.polymorpha DL-1是一种优良的GSH高产菌,结合基因工程方法对该菌进行诱变选育出高产GSH工程菌的同时,进一步整合多个发酵策略对其发酵条件进行优化,以期解决目前GSH产生菌发酵水平低、生产设备及产品的后续提取工艺落后、产品收率低等重要瓶颈问题。为此,本研究利用变温调控H.polymorpha DL-1发酵生产GSH,为进一步结合基因工程菌的发酵工艺提高GSH量提供了理论基础和实践依据。
[1]庞德钦.高产谷胱甘肽(GSH)酵母菌种的选育及发酵条件研究[D].武汉:华中科技大学,2007.
[2]陈俭梅.高产谷胱甘肽酵母菌株的选育及发酵条件研究[D].济南:山东师范大学,2009.
[3]梁国斌.产朊假丝酵母生产谷胱甘肽过程控制与优化[D].无锡:江南大学,2008.
[4]卫功元.发酵法生产谷胱甘肽及其高产策略研究[D].苏州:苏州大学,2010.
[5]张文燕,堵国城,陈坚.流加发酵及添加L-半胱氨酸对产软假丝酵母高密度培养合成谷胱甘肽的影响[J].应用与环境微生物学报,2007,13(2):261-264.
[6]陈珊.酿酒酵母发酵生产谷胱甘肽的研究[J].现代食品科技,2011,27(1):72-76.
[7]陈凤菊,卢善发,胡顿孝,等.多形汉逊酵母外源基因表达系统[J].生物工程学报,2001,17(3):247-249.
[8]Wen S W,Zhang T,Tan T W.Utilization of amino acids to enhance glutathione production in Saccharomyces Cerevisiae[J].Enzyme and Microbial Technology,2004,35(2):501-507.
[9]刘娟.高产谷胱甘肽优良酵母菌种的选育及发酵条件研究[D].北京:北京化工大学,2003.
[10]Tietze F.Enzymic method for quantitive determination of nanogram amounts of total and oxidized glutathione[J].Anal Biochem,1969,27(3):502-522.
[11]陈娜,乔长晟,胡玉霞,等.面包酵母中谷胱甘肽抽提方法的研究[J].现代食品科技,2008,24(2):157-160.
[12]卫功元,李寅,堵国城,等.温度对谷胱甘肽的影响及动力学模型[J].生物工程学报,2003,19(3):258-362.
[13]王丽娜,陈水钫,张兵,等.3,5-二硝基水杨酸比色法测定多糖含量的研究进展[J].吉林医药学院学报,2009,8(30):299-301.
[14]Vira M U,Viadimir M A,Alexander Y M,et al.Optimization of glutathione production in batch and fed-batch cultures by the wild-type and recombinant strains of the methylotrophic yeast Hansenula polymorpha DL-1[J].Biotechnology,2011,8(11):1472-6750.

