出芽短梗霉黑色素的抗氧化活性研究
赵 博,乔长晟,汪建明,盖丽丰
(1.食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457;2.天津北洋百川生物技术有限公司,天津300457;3.天津市工业微生物重点实验室,工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津300457)
黑色素是广泛存在于生物体中的一类天然色素,它是通过多羟基酚(极易结合蛋白)氧化而形成结构不规则的非均质的类多酚聚合体[1]。黑色素又可分为三类:真黑色素、棕黑色素、异黑色素,不同种类来源的黑色素在结构上有着细微的差异[2]。黑色素,尤其是真黑色素,表现出显著的氧化还原性,并且由于在正醌和多聚物邻苯二酚部分之间的电子离域,使其产生很多半醌自由基。黑色素可以参与一些单价或双价的氧化还原反应,并且光吸收的结果使这种色素产生光氧化。黑色素还具有很强的阳离子螯合特性,主要通过如羧基和去质子化羟基这些阴离子起作用[3]。有研究表明,人的疾病发病率与富含抗氧化剂的食品的摄入量呈负相关关系[4]。因此,寻找高效、低毒清除氧自由基的抗氧化剂已成为食品领域近年来研究的热点。本文通过还原力、DPPH自由基体系、羟自由基体系、超氧阴离子自由基体系、铁离子螯合力体系、抑制脂质过氧化等体系[5]对出芽短梗霉黑色素的抗氧化活性进行了评价,并与VC清除自由基能力进行比较,以期为出芽短梗霉黑色素的抗氧化活性研究提供理论依据。
1 材料与方法
1.1 材料与仪器
出芽短梗霉黑色素培养基 葡萄糖60g/L,(NH4)2SO410g/L,酪氨酸2.5g/L,KH2PO40.25g/L,牛肉膏15.08g/L,ZnSO47mg/L,MgSO4·7H2O 1.29mg/L;1,1-二苯代苦味酰基自由基、乙醇、过氧化氢、抗坏血酸、三氯化铁、盐酸、磷酸二氢钠、磷酸氢二钠、铁氢化钾、水杨酸、邻苯三酚、三氯乙酸、硫酸亚铁、碘化钾、邻二氮菲 均为分析纯。
RE3000旋转蒸发器 上海亚荣生化仪器厂;SC6010电子分析天平 梅特勒-托利多常州衡器有限公司;TDA-8002数显恒温水浴锅 天津中环科技开发公司;RT-6000酶标仪 上海舒康医疗器械公司。
1.2 实验方法
1.2.1 出芽短梗霉黑色素溶液的制备 培养条件:装液量18L,接种量5%(V/V),溶氧20%,初始搅拌转速400~500r/min,与溶氧联动,通风比1.2vvm,培养温度25℃,pH6.0,培养时间3~5d。
出芽短梗霉黑色素溶液参照Sava等[6]的方法配制。用少量0.2%NH4OH将黑色素在氮气的保护下超声辅助溶解,用旋转蒸发仪减压抽去氨气,直至pH达7.5。用去离子水配制成所需浓度的溶液。
1.2.2 出芽短梗霉黑色素的抗氧化活性的测定
1.2.2.1 还原力的测定 取色素样品溶液1mL加入2.5mL 0.2mol/L磷酸缓冲溶液(pH6.6)和2.5mL 1%铁氰化钾溶液,混匀50℃,水浴20min,然后加入2.5mL 10%的三氯乙酸,混匀3000r/min离心10min,取上清液2.5mL和0.5mL 0.1%三氯化铁溶液室温反应10min,于700nm处测吸光度,以VC做阳性对照。吸光值越大,说明色素样品的还原能力越强。
1.2.2.2 二苯代苦味酰基自由基(DPPH)清除能力的测定
a.黑色素对DPPH清除能力的测定:参照Sanchez Moreno[7]的方法。1mL各浓度的试样与1mL 1×10-4mol/L DPPH乙醇溶液混合,于室温下遮光放置30min,测定其在517nm下的吸光度值(A);以1mL蒸馏水代替样品为空白对照(A’);以1mL样品与1mL乙醇混合液为样品本底吸收校正(Aj);水和乙醇调仪器零点。清除二苯代苦味酰基自由基活性按式(1)计算:

b.不同浓度色素对DPPH清除能力的动力学曲线[8]:1mL各浓度的试样与1mL 1×10-4mol/L DPPH乙醇溶液快速混匀后,分别于0、10、20、30、40、50、60、70、80、90min测定其在517nm下的吸光度值,直至吸光度相对稳定。绘制色素清除DPPH的动力学曲线。1.2.2.3 羟自由基(·OH)清除能力的测定 在10mL试管中依次加入6mmol/L的FeSO4溶液2mL、发酵产物溶液2mL和6mmol的水杨酸溶液2mL,同时向各管加入2mL蒸馏水,摇匀,静置30min后以5000r/min离心5min,于510nm处测吸光度。对照组用2mL蒸馏水代替水杨酸,同时设立样品空白管。每个样品测三个平行,取均质。强自由基清除率计算公式为:

式中,A0为空白对照;Ai为有水杨酸时水解产物的吸光度;Aj为无水杨酸时水解产物的吸光度。
1.2.2.4 抑制超氧阴离子自由基(O2-·)能力的测定
a.邻苯三酚自氧化速率的测定:取4.5mL 0.05mol/L pH8.2的Tris-HCl缓冲液置于试管中,25℃下恒温水浴20min,然后加入3mL 25℃下预热的邻苯三酚溶液,迅速摇匀,在420nm处测定吸光度,每隔30s记录1次吸光值。反应4min后,加2滴8mol/L的盐酸终止反应,测得吸光值定为A0,可表示邻苯三酚自氧化速率。
b.样品抑制邻苯三酚自氧化的能力:取4.5mL 0.05mol/L pH8.2的Tris-HCl缓冲液置于试管中分别加入1mL不同浓度的色素样品,25℃下反应4min,再按上述方法,测定邻苯三酚的自氧化速率,得到吸光值A1;同时用蒸馏水代替样品,作一试剂空白A2,实验以VC为对照,根据式(3)计算样品对邻苯三酚自氧化的抑制能力:
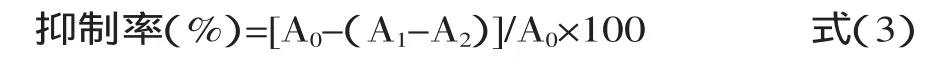
1.2.2.5 Fe2+螯合能力的测定 取不同浓度的色素液1mL置于试管中,分别加入2mL 0.2%FeSO4溶液,37℃恒温水浴30min,然后加入0.5mL 0.3%邻二氮菲,在37℃恒温水浴中反应10min。在510nm处测定吸光值,设空白对照为A0,色素溶液的吸光值为A1,不加邻二氮菲时色素溶液的吸光值为A2,平行测试3次,同时配制同浓度的EDTA作阳性对照溶液。根据式(4)计算待测物对Fe2+的螯合率。

1.2.2.6 抑制脂质过氧化能力的测定 脂质体PBS分散系(LLS):300mg卵磷脂溶于300mL 10mmol/L pH7.4的磷酸缓冲液中,水浴振荡。三氯乙酸(TCA)-硫代巴比妥酸(TBA)-盐酸(HCl)混合液:15g TCA,0.375g TBA,2.1mL浓盐酸依次加入100mL水中。
在10mL具塞试管中依次加入1.0mL脂质体磷酸盐缓冲分散系(LLS)、1.0mL 400μmol/L三氯化铁溶液(FeCl3)、1.0mL样品,混匀,避光,于37℃恒温60min,再加入2.0mL TCA-TBA-HCl混合液,沸水浴15min,迅速冷却,以2000r/min转速离心10min,取上清液在535nm下测吸光度。空白管以1.0mL蒸馏水代替1.0mL样品,操作方法同样品管,可测得空白管的吸光度。每个样品测三个平行,取均值。

式中,Ac为空白管吸光度;As为水解产物的吸光度。
2 结果与分析
2.1 还原力的测定
有研究认为生物活性物质的抗氧化活性与还原力直接相关。还原力强的样品应为良好的电子供应者,在酸性条件下,Fe3+还原Fe2+溶液变成浅绿色,在700nm处有较强的吸收。Fe3+还原为Fe2+通常被用来衡量活性物质给电子能力的大小,同时也是多酚类物质之所以具有抗氧化性的重要机理之一。其供应的电子除了可使Fe3+还原为Fe2+外,也可与自由基反应,使自由基成为更为稳定的物质。同时也是多酚类物质之所以具有抗氧化性的重要机理之一。一般情况下,样品的还原能力与其抗氧化活性之间有显著的相关性,还原能力的高低可以间接反映抗氧化能力的强弱。在波长700nm处测定的吸光值越大,则表明样品的还原能力越强。因此,本文对出芽短梗霉黑色素的还原能力进行了测定。结果见图1。由图1可知,在浓度为0.4g/L时,其还原力与VC相当,后随着浓度的增加而增强,在相同浓度下,黑色素还原能力低于VC,当浓度为1g/L,黑色的还原能力为VC的一半,表明黑米色素具有一定的还原能力。
图1 黑色素还原能力的测定Fig.1 The reducing force of the melanin
2.2 二苯代苦味酰基自由基(DPPH·)清除能力的测定
2.2.1 黑色素对DPPH自由基清除能力的测定 图2表示黑色素与VC对DPPH自由基的清除率。由图2可知,黑色素及VC对DPPH自由基均有不同程度的清除作用,随浓度的增大,清除能力增强。黑色素在浓度为0.2~0.8g/L范围时,随着浓度的增大,其对DPPH的清除率明显增大,增幅为57.63%。浓度进一步增大时,二者对DPPH自由基的清除率增幅不明显。当黑色素浓度达到0.8g/L时,黑色素对DPPH自由基的清除率达到66.52%。说明黑色素对DPPH自由基具有一定的清除作用。

图2 黑色素对DPPH自由基清除率的影响Fig.2 The effect of the melanin on the rate of scavenging free radical DPPH
2.2.2 不同浓度黑色素对DPPH自由基清除能力的动力学曲线 图3为不同质量浓度的黑色素清除DPPH的动力学曲线。体系中加入不同浓度的样品后,在反应之初,黑色素对DPPH自由基的清除速率较快,0~30min内清除率随时间呈线性递减趋势,随后清除速率逐渐减慢,黑色素对DPPH自由基的清除率随时间的延长不断下降;并且加样浓度越大,降幅越大,自由基的清除能力越强。对于具备捕获DPPH自由基能力的物质,其捕获DPPH自由基的能力与抗氧化剂用量均呈量效关系:随着抗氧化剂用量的增加,其捕获的DPPH自由基也越多。DPPH是一种较为稳定的自由基,它具有3个芳环结构,属于芳香类自由基,研究抗氧化剂样品直接捕获或与DPPH自由基相结合的行为,可以大致推测抗氧化剂对芳香自由基的清除能力,出芽短梗霉黑色素中的某些结构可能直接捕获或与DPPH相结合从而清除DPPH自由基[9]。
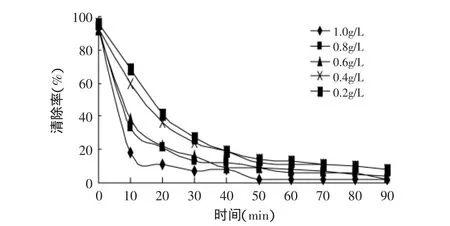
图3 黑色素对DPPH自由基清除率的动力学曲线Fig.3 The dynamics curve of the melanin on the rate of scavenging free radical DPPH
2.3 羟自由基(·OH)清除能力的测定
羟基自由基(·OH)是一种重要的活性氧,它的化学性质非常活泼,可引发不饱和脂肪酸发生脂质过氧化反应,具有损伤膜结构及功能和多种生物大分子的能力。它具有极强的氧化能力,从分子式上看是由氢氧根(OH-)失去一个电子形成。加入自由基清除剂时,其孤电子被配对、吸收消失或减弱。

图4 黑色素对羟自由基清除率的影响Fig.4 The effect of the melanin on the rate of scavenging hydroxyl radicals
图4表示不同质量浓度的样品溶液对羟基自由基的清除效果。由图4可知,出芽短梗霉黑色素表现出很强的清除羟自由基活性。在实验各浓度范围内,出芽短梗霉黑色素对羟基自由基的清除率均高于标准抗氧化剂VC,且对羟自由基的清除率随着浓度的增大而增加。当出芽短梗霉黑色素和VC的质量浓度均为0.2g/L时,二者对羟自由基的清除率分别为31.13%和14.12%,当质量浓度增至0.8g/L时,出芽短梗霉黑色素和VC的清除率提高到74.67%和70.15%,增幅分别为43.53%和56.02%。羟自由基是一种对人体损伤比较大的自由基,它的作用点比较多,出芽短梗霉黑色素清除羟自由基可能有以下3途径:a.黑色素是多酚聚合物,具有一定的供氢能力,其抗氧化机理和其他酚类抗氧化相同,即自身作为优良的氢供体,向羟自由基提供H+后,形成的自由基可通过共振杂化被稳定,也可与其他自由基结合成稳定的二聚体,从而切断自由基的链式反应,发挥抗氧化作用;b.可能是黑色素在形成过程中有大量的邻醌产生,而这些邻醌有络合金属离子性能,从而消除产生自由基反应中金属离子的催化作用,从而间接实现抗氧化作用[10];c.苯环捕获寿命极短的OH-,生成稳定的芳香族化合物的羟化衍生物[11]。另外这些不同抗氧化性能的官能团共存于黑色素系统中,抗氧化官能团之间可能相互还原产生协同作用,使色素整体的抗氧化性更强。
2.4 抑制超氧阴离子自由基(O2-·)能力的测定
本实验采用邻苯三酚自氧化法测试了黑色素对邻苯三酚自氧化过程中产生的超氧阴离子自由基的清除作用。

图5 黑色素对超氧阴离子清除率的影响Fig.5 The effect of the melanin on the rate of scavenging super oxide anion free radicals
图5表示黑色素与标准抗氧化剂VC对邻苯三酚自氧化产生的超氧阴离子自由基的抑制能力。由图5可知,黑色素及VC对超氧阴离子自由基均有不同程度的抑制作用,在实验浓度范围内,抑制率随浓度的增大而增加。黑色素对超氧阴离子自由基抑制率与浓度呈现一定的量效关系,峰值出现在0.8g/L时,清除率为82.44%,而VC清除率为79.79%,黑色素对超氧阴离子自由基的清除率略高于VC。
2.5 对Fe2+螯合能力的测定
一些具有多价态的金属离子可以参与某些特定的自由基生成反应,如Fe2+参与Fenton反应可产生氧自由基,而一旦金属离子被螯合,其参与的自由基生成反应就有可能被束缚[12]。
过渡态的金属离子常常是诱发不饱和脂肪酸过氧化的催化剂,而Fe2+影响最大,如果能螯合亚铁离子,就能阻断不饱和脂肪酸的过氧化,起到抗脂质氧化的效果。这种特性不仅加速自由基的产生,产生活性氧,缩短脂肪氧化的诱导期,同时加速氢过氧化物的分解,加剧脂质氧化反应。
图6表示黑色素对Fe2+的螯合能力进行了测定,并以EDTA为阳性对照。EDTA是螯合剂的代表性物质。EDTA能与金属离子形成相当稳定的配合物,EDTA与金属离子形成的配合物多数可溶于水,形成配合物的颜色主要决定于金属离子的颜色。
由图6可以看出,黑色素粗提物对Fe2+具有一定的螯合能力,随着浓度的升高,螯合能力逐渐增强。黑色素具有通过羧基和去质子化羟基与阳离子形成很强配位螯合物的能力,对金属离子的螯合能力越强,越能够提高元素的生物利用率,有利于机体对矿物质元素的吸收利用率。但黑色素的螯合能力不及同等质量浓度EDTA的螯合能力,在相同浓度条件下,黑色素对Fe2+的螯合率均低于EDTA螯合率。此外,黑色素和EDTA的Fe2+螯合率的上升与浓度的增加呈现一定的量效关系。

图6 黑色素铁离子螯合力Fig.6 The iron chelating ability of the melanin
2.6 抑制脂质过氧化能力的测定
出芽短梗霉黑色素抑制脂质过氧化能力的测定结果见图7。

图7 黑色素对脂质过氧化抑制率的影响Fig.7 The effect of the melanin on the rate of inhibition of the lipid peroxidation
由图7可以看出,黑色素的抑制率随着浓度的增大逐渐增强。黑色素的抑制率在浓度为0.6~0.8g/L范围内时,其抑制率较高为90.88%~91.54%,继续增大黑色素的浓度,其抑制率呈逐渐下降趋势。
3 结论
出芽短梗霉黑色素具有一定的还原能力,在浓度为0.4g/L时,其还原能力与VC相当。随着浓度的增加其还原能力低于VC,在浓度为1g/L时,其还原能力为VC的一半。黑色素还具有一定的清除DPPH自由基的能力,其清除能力随着浓度的增加逐渐增强,但其清除能力低于VC。其对羟基自由基和超氧阴离子自由基也均有一定的抗氧化性,并且其清除能力均高于VC,同时其具有一定的抑制脂质过氧化性,但铁离子螯合能力低于同等浓度的EDTA的螯合能力。
[1]Bell A A,Wheeler M H.Biosythesis and functions of melanins[J].Ann Rev PHytopatho,1986,24:411-451.
[2]Nicolaus R A.Melanins,Chemistry of Natural Products[M].Pairs:Harmann press,1992,14:49-56.
[3]Ewa Buszman a,Barbara Pilawa b,Magdalena Zdybel b,et al.EPR examination of Zn2+EPR examination of Zn2+and Cu2+effect on free radicals in DOPA-melanin-netilmicin complexes[J].Chemical Physics Letters,2005,403:22-28.
[4]Lu Y,Foo L Y.Antioxidant and radical scavenging activities of polyphenols from apple pomace[J].Food Chemistry,2000:81-85.
[5]Ksenija,Markovic.Lycopene content of tomato products and their contribution to the lycopene intake of Croatians[J].Nutrition Research,2006,26:556-560.
[6]Bridelli M G,Crippa P R,Ugozzoli F.X-ray diffraction studies on melanins in lyophilized melanosomes[J].Pigment Cell Research,1990,3:187-191.
[7]Sanchez,Moreno C.Methods used to evaluate the free radical scavenging activity in foods and biological systems[J].Food Science and Technology International,2002:121-137.
[8]朱艳华,谭军.玉米多肽抗氧化作用的研究[J].中国粮油学报,2008,23(1):36-43.
[9]郭亚力,李聪.3种分光光度法对天然抗氧化物质抗自由基性能的分析检测[J].分析实验室,2004,23(10):43-48.
[10]黄池宝,罗宗铭.食品抗氧化剂的种类及其抗氧化作用[J].广东工业大学学报,2001,18(13):77-80.
[11]文镜,张西.体内羟自由基的检测方法[J].食品科学,2004,25(10):351-357.
[12]Dinis T C P,Madeira V M C.Action of phenolic derivatives(acetaminophen,salicylate,and 5-aminosalicy-late)as inhibitors of membrane lipid peroxidation and as peroxyl radical scavengers[J].Arch Biochem Biophys,1994,315:161-169.

