绿茶茶渣半纤维素的提取及组成性质研究
宋珺玲,周惠明,朱科学
(江南大学食品学院,江苏无锡214122)
作为产茶大国,我国茶饮料产业生成的茶渣高达几十万吨,茶渣半纤维素多糖是茶渣中溶于碱性溶液中的那一部分非纤维素多糖,占茶渣干重的20%左右,与小麦等其他来源的半纤维素不同,绿茶茶渣半纤维素中半乳糖含量很高[1],是一种有待开发的特殊半纤维素种类。目前国内外对半纤维素的研究多集中在半纤维素提取方法、结构和性质上[2-6],来源涉及小麦、稻草秸秆以及一些树木半纤维素[7],少有研究茶渣半纤维素。本文以绿茶茶渣为原料,利用碱性过氧化氢法提取茶渣半纤维素,发现一种新的半纤维素种类,为茶渣的进一步研究和综合利用奠定了基础。
1 材料与方法
1.1 材料与设备
茶渣 浙江塔塔茶叶有限公司;NaOH、H2O2、无水乙醇、半乳糖、3,5-二硝基水杨酸 均为分析纯,国药集团化学试剂有限公司。
分析天平 奥豪斯仪器上海有限公司;THS-10精密型超级恒温水槽 宁波天恒仪器厂;84-1A磁力搅拌器 上海司乐仪器有限公司;CR21GⅢ冷冻离心机 日本HITACH KOKI公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;RJLDL-50G低速大容量多管离心机 无锡瑞江分析仪器有限公司;冷冻干燥机 美国LABCONCO公司;FORMA702超低温冰箱 THERMO LIFE SCIENCE。
1.2 实验方法
1.2.1 茶渣半纤维素的提取及分离流程 茶渣→烘干→粉碎过40目筛→碱性过氧化氢法提取→离心取上清液→调pH→真空浓缩→脱蛋白(Sevage法)反复多次→醇沉→离心,得沉淀→冷冻干燥,研磨得茶渣半纤维素粉末。
1.2.2 操作要点
1.2.2.1 原料预处理 将从茶饮料企业中取来的茶渣经45℃烘干16h后粉碎,过40目筛,得到茶渣粉末。
1.2.2.2 提取 准确称取10g茶渣粉末,添加含0.75%NaOH、3%H2O2的水溶液200mL,70℃,搅拌提取2h。
1.2.2.3 离心 将浸提液在4000r/min离心15min,得上清液。
1.2.2.4 调节pH 用1mol/L的HCl调节上清液的pH到5~7。
1.2.2.5 真空浓缩 将浸提液在55℃浓缩到原体积的1/5。
1.2.2.6 脱蛋白 采用Sevage法[8],即将氯仿和丁醇溶液按v∶v=5∶1的比例加到浓缩液中,混合物剧烈振摇5min后静置萃取,分去水层和溶液层交界处的变性蛋白质,得脱蛋白溶液,反复多次至水与溶液层交界处无明显蛋白沉淀为止。
1.2.2.7 醇沉、干燥 加入3倍上述脱蛋白糖液体积的无水乙醇溶液,室温下放置过夜,4000r/min离心15min得茶渣半纤维素沉淀,冷冻干燥,研磨,得黄褐色粉末状茶渣半纤维素。
1.2.3 茶渣半纤维素得率的计算

1.2.4 茶渣半纤维素中总糖含量的测定 利用DNS法(3,5-二硝基水杨酸法)测定半纤维素中总糖含量。DNS法利用抽提试剂在高温条件下水解半纤维素产生混合单糖(半乳糖、阿拉伯糖、葡萄糖),与DNS试剂显色后测定总糖含量:准确称取6.3g 3,5-二硝基水杨酸法,溶于262mL 2mol/L的氢氧化钠溶液,再加到500mL含有185g酒石酸钾钠的热水溶液中,继续添加5g结晶酚和5g亚硫酸钠,搅拌溶解,定容至1000mL,贮存于棕色瓶中。准确称取100mg半乳糖(105℃烘干至恒重)溶于100mL容量瓶中,分别取0、0.2、0.4、0.6、0.8、1.0、1.2、1.4mL半乳糖液加入比色管,分别定容到2mL,再分别加入1.5mL DNS显色液,沸水浴5min,冷却到室温定容至25mL,540nm下测吸光度值,得到半乳糖标准曲线回归方程:A=0.669c-0.025,R2=0.997,其中A为吸光度值,c为半乳糖含量,单位为mg。
半纤维素总糖含量的测定:称取50mg茶渣半纤维素,加少量蒸馏水溶胀后定容至25mL,利用DNS法显色后测定A540,总糖含量计算公式如下:

1.3 茶渣半纤维素的理化性质和表征
1.3.1 茶渣半纤维素的理化性质 碘-碘化钾反应实验、考马斯亮蓝反应实验、福林酚反应实验、咔唑硫酸反应;配制1mg/mL的半纤维素溶液,分别进行碘-碘化钾反应实验、考马斯亮蓝反应实验、福林酚反应实验、咔唑硫酸法实验,定性检测是否含有淀粉、蛋白质、多酚以及糖醛酸。I-KI反应实验以淀粉作为对照;考马斯亮蓝反应以牛血清蛋白作为对照,595nm条件下比色确定;福林酚实验以没食子酸作为对照,765nm条件下比色确定;咔唑硫酸反应中以葡萄糖醛酸作为对照,530nm条件下比色鉴定。
1.3.2 半纤维素的表征
1.3.2.1 红外光谱分析 将干燥的茶半纤维素3mg与KBr研磨压片,在4000~500cm-1区域内进行红外光谱扫描[9]。
1.3.2.2 茶渣半纤维素中单糖组成的离子色谱分析取5mg/mL多糖样品100μL,加入4mol/L的三氟乙酸(TFA)100μL,抽真空封管,110℃水解2h,冷却挥发TFA。0.45μm微孔滤膜过滤,用去离子水定容到5mL。样品进入离子色谱分析[10]。离子色谱分析条件:色谱柱:CarboPacPA20(3mmi.d.×150mm);流速:0.5mL/min;检测器:脉冲安培检测器;流动相为H2O、250mmol/L NaOH及1mol/L NaAc。不同浓度梯度洗脱,浓度如表1所示。

表1 离子色谱测单糖组成的流动相组成Table 1 The composition of mobile phase in sugar analysis by ion chromatography
进样浓度为3.33μg/mL,标准品为鼠李糖、阿拉伯糖、氨基半乳糖、半乳糖、葡萄糖、木糖和半乳糖醛酸。通过比较标准单糖和样品的保留时间,确定样品中的单糖和糖醛酸种类,再根据峰面积计算单糖和糖醛酸的百分比。
1.3.2.3 茶渣半纤维素的相对分子量分析 采用Waters 600高效凝胶过滤色谱(HPGPC)测定相对分子质量。具体操作条件为:色谱柱Ultrahydrogel TM Linear(300mm×7.8mm);流动相:0.1mol/L NaNO3;流速:0.9mL/min;柱温:45℃;检测器:2410示差折光检测器;样品制备:样品溶解于流动相中,用微孔过滤膜过滤后供进样[11]。
2 结果与讨论
2.1 茶渣半纤维素的提取
通过碱性过氧化氢法提取、乙醇沉淀、Sevage法脱蛋白的方法对茶渣中半纤维素进行提取,所得茶渣半纤维素经过冷冻干燥研磨粉碎后,得到黄褐色固体粉末,得率为34.6%,其中总糖含量为34.5%±0.5%。
2.2 茶渣半纤维素的理化性质分析
茶渣半纤维素为黄褐色的固体粉末;不溶于高浓度乙醇等有机溶剂;酸水解液与3,5-二硝基水杨酸反应呈阳性,说明样品中含糖[12];与KI-I2反应呈阴性,说明样品中不含淀粉;与考马斯亮蓝反应呈阳性,说明样品中含蛋白质[13];与福林酚-NaCO3反应呈阳性,说明样品中含酚类物质;与咔唑硫酸试剂反应呈阳性,说明茶渣半纤维素中含有糖醛酸[14]。由以上结果可知,茶叶在热处理提取水溶性成分之后,剩余茶渣中仍残留蛋白质和微量酚类物质,所以经碱性过氧化氢法分离的茶渣半纤维素粗多糖中还含有一部分蛋白质和多酚;而且通过糖醛酸实验,发现样品中含有很多糖醛酸类物质,说明茶渣半纤维素很可能是一种酸性多糖。
2.3 茶渣半纤维素的表征
2.3.1 红外光谱分析 茶渣半纤维素的红外光谱见图1。由图1可知,在3600~3200cm-1处出现的宽峰是半纤维素的O-H伸缩振动,2935cm-1吸收为多糖的C-H伸缩振动峰。1638.67cm-1处出现的峰为CHO的C=O的非对称伸缩振动峰,代表了半纤维素多糖的自由羧基官能团(-COO-),1413cm-1出现的峰属于C-H键的变角振动,它和C-H键的伸缩振动构成了糖类的特征吸收峰。在1200~1000cm-1之间的吸收峰是由两种C-O键伸缩振动所形成,其中一种1044.94cm-1为CO-C的伸缩振动峰,是糖环中醚键的特征吸收。在895cm-1附近处的吸收峰是β-型的C-H直立键,表明糖单元之间存在β-糖苷键连接[12]。D-葡萄吡喃环对称性伸缩振动出现在775cm-1,说明茶渣半纤维素中含有有吡喃环结构[10]。877.13cm-1处出现的吸收峰很可能是呋喃糖中次甲基横向振动所造成的尖峰,所以茶渣半纤维素很可能同时含有吡喃糖和呋喃糖。

图1 茶渣半纤维素红外光谱图Fig.1 Infrared spectrogram of hemicellulose isolated from green tea-leaf
2.3.2 茶渣半纤维素中单糖组成分析 标准单糖和糖醛酸以及茶渣半纤维素的液相色谱见图2和图3,根据液相色谱的保留时间,进行定性分析,即通过比较标准单糖和样品中单糖的保留时间得出样品中的单糖组成,再根据峰面积和标样的摩尔浓度计算出样品中个单糖的百分比。结果表明,茶渣半纤维素主要由半乳糖、阿拉伯糖和葡萄糖组成,还包括少量鼠李糖、木糖和氨基半乳糖,其百分比为:32.8∶24.6∶34.4∶3.9∶4∶0.3;不同于其他原料,茶渣中的半纤维素成分结构复杂,同时含有五碳糖和六碳糖,且并不同于其他以木糖为主链的半纤维素,但是仅仅通过红外无法预测茶渣半纤维素的整体结构,其结构特性还有待继续研究。此外,茶渣半纤维素还含有半乳糖醛酸,与总糖含量的百分比是38∶100,表明茶渣半纤维素是一种酸性多糖。
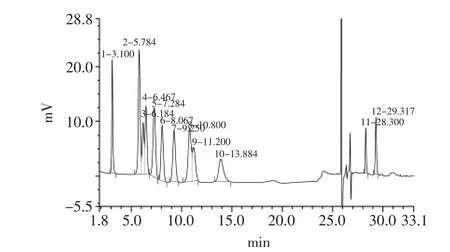
图2 标准单糖的离子色谱图Fig.2 Ion chromatograph chart of standard monosaccharide

图3 样品中单糖的离子色谱图Fig.3 Ion chromatograph chart of hemicelluloses

图4 HPGFC法测定60%乙醇沉淀组分分子量Fig.4 The MW of 60%ethanol concentration component determined by HPGFC

图5 HPGFC法测定80%乙醇沉淀组分分子量Fig.5 The MW of 80%ethanol concentration component determined by HPGFC
2.3.3 茶渣半纤维素的相对分子量 利用不同浓度乙醇将半纤维素初步分级,发现60%浓度和80%浓度乙醇沉淀的组分有很好的水溶解性,将该组分通过高效凝胶色谱分析,可以看出高浓度乙醇沉淀的组分较为均一,其凝胶色谱图分别见图4和图5。从图4可以看出,60%组分较为均一,重均分子量为2073;从图5看出,80%包括有两个峰,重均分子量分别为1858和425。结果表明在碱性过氧化氢条件下,提取的半纤维素分子量分布在2000和400左右,是一种小分子多糖。与碱法提取的半纤维素相比,分子量偏低[15],原因可能以下几个方面:a.现有报道中的半纤维素多来源于多年生草本、硬木等,其植物细胞壁结构致密,半纤维素分子量较大,而茶渣半纤维素来源于茶叶嫩叶,半纤维素分子量相对较小;b.因为过氧化氢的存在,降低了半纤维素的聚合度[16],增加半纤维素的溶解性所致;c.高浓度乙醇沉淀的组分侧链取代度高[17],易溶于水,与纤维素结合不紧密,相对分子量较低。
3 结论
3.1 采用碱性过氧化氢法分离,经过乙醇沉淀、Sevage法脱蛋白、冷冻干燥等方法从茶渣中提取得到黄褐色呈固体粉末状的半纤维素,得率为34.6%。
3.2 红外图谱显示,茶渣半纤维素具有吡喃糖的特征吸收,并且存在β-型糖苷键。
3.3 单糖分析结果显示,茶渣半纤维素含有多种单糖,主要是半乳糖、阿拉伯糖和葡萄糖,还含有少量鼠李糖、木糖和微量氨基半乳糖,其百分比为32.8∶24.6∶34.4∶3.9∶4∶0.3;茶渣半纤维中的糖醛酸为半乳糖醛酸,其含量与总糖含量百分比为38∶100,所以茶渣半纤维素为一种酸性多糖。
3.4 通过对高浓度乙醇沉淀的半纤维素做分子量分析,发现水溶性的半纤维素具有很高的均一性,且分子量较小。
[1]王黎明.具有降血糖活性的茶多糖组分分离纯化和结构鉴定[D].无锡:江南大学,2006.
[2]Revanappa S B,Salimath P V.Structure characterization of hemicelluloses A from wheat(Triticum aestivum)vatieties differing in their chapatti-making quality[J].Carbohydrate Polymers,2010,79:655-659.
[3]Pai P,Feng P,Jing B,et al.Isolation and structural characterization of hemicelluloses from bamboo species Phyllostachys incarnate Wen[J].Carbohydrate Polymers,2011,86:883-890.
[4]Feng P,Jun-Li R,Feng X,et al.Fractional study of alkalisoluble hemicelluloses obtained by graded ethanol precipitation from sugar cane bagasse[J].Journal of Agricultural and Food Chmeistry,2010,58:1768-1776.
[5]Yong-Chang S,Jia-Long W,Feng X,et al.Organosolv-and alkali-soluble hemincelluloses degraded from Tamarix austromongolica:Characterization of physicochemical,structural featuresand thermalstability[J].PolymerDegradation and Stability,2011,96:1478-1488.
[6]Egues I,Sanchez C,Mondragon I,et al.Effect of alkaline and autohydrolysis processes on purity of obtained hemicelluloses from corn stalks[J].Bioresource Technology,2012,103:239-248.
[7]Ebingerova A,Hromadkova Z,Heinze T.Hemicellulose[J].Advances in Polymer Science,2005,186:1-67.
[8]史德芳,杨洋,任红.仙人掌多糖提取过程中三种脱蛋白方法的比较研究[J].山东食品发酵,2006(2):42-44.
[9]Zhou X L,Sun P N,Bucheli P,et al.FT-IR methodology for quality control of arabinogalactan protein(AGP) extracted from green tea(Camellia sinensis)[J].Journal of Agricultural and Food Chemisty,2009,57:5121-5128.
[10]戴军,朱松,汤坚.PMP柱前衍生高效液相色谱法分析杜氏盐藻多糖组成[J].分析测试学报,2007(2):206-210.
[11]徐燕,朱科学,钱海峰,等.桃胶多糖的提取分离机组成性质研究[J].食品工业科技,2008(1):66-71.
[12]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:10-11.
[13]张云贵,刘祥云,李天俊,等.生物化学实验指导[M].北京:中国农业出版社,2007-12.
[14]中华人民共和国农牧渔业部.NY 82.11-1988果胶的测定[S].北京:中国标准出版社,1988.
[15]彭锋.农林生物质半纤维素分离纯化、结构表征及化学改性的研究[D].广州:华南理工大学,2010.
[16]Fang J M,Sun R C,Salisbury D,et al.Comparative study of hemicelluloses from wheat straw by alkali and hydrogen peroxide extractions[J].Polymer Degradation and Stability,1999,66:423-432.
[17]蔚慰奇,武书彬,彭云云.麦草水溶性和碱溶性半纤维素的分离和表征[J].林产化学与工业,2010(6):66-70.

