耐盐乳酸菌和酵母菌对高盐稀态发酵酱油品质的影响
崔瑞迎,郑 佳,梁 如,何翠容,陈 勇,黄 钧,吴重德,周荣清,2,3,*
(1.四川大学轻纺与食品学院,四川成都610065;2.国家固态酿造工程技术研究中心,四川泸州646000;3.四川大学制革清洁技术国家工程实验室,四川成都610065)
中国传统酱油“日晒夜露”的工艺符合“物竞天择、适者生存”的自然规律,风味独特,深受人们喜爱。然而“春曲、夏酱、秋油”的生产工艺因生产周期过长,不适应日趋严格的生产规范,阻碍了工艺特点与产品风格的传承与弘扬[1]。酱油的独特风味源于多种微生物间的协同作用,科学地认识、总结和应用传统工艺中微生物群落变迁规律是改善酱油质量,提升其核心竞争力的重要措施。如日本的酱油生产技术则在我国酱油“日晒夜露”基础上开发了温酿和冷温酿造工艺,解决了酿造周期过长的关键技术难题,使其产品的感官指标和挥发性组分均与我国传统高盐稀态发酵酱油存在显著差异[2-3]。高盐稀态酿造过程经历了从乳酸菌生长代谢演变为酵母菌的生长代谢的变化[4],其中,对酱醪最终质量有较大影响的主要是酵母菌种属的差异[5]。在酱醪中添加耐盐酵母菌(Z.rouxii,C.versatilis)及耐盐乳酸菌(T.halophilus),尤其是酵母菌与乳酸菌的共培养,有益香味组分的形成和酿造周期的缩短[6-7],但迄今未见不同种属微生物相互作用对酱醪主要理化指标及挥发性组分形成规律的影响的报道。本论文叙述了添加耐盐乳酸菌T.halophilus和酵母菌Z.rouxii和C.versatilis对酱醪主要理化指标及挥发性组分变化规律影响的研究,其研究结果对指导不同种属微生物共培养技术在传统酱油酿造中的应用具有重要意义。
1 材料与方法
1.1 材料与仪器
米曲霉(Aspergillus oryzae)、沪酿3.042 上海迪发酿造生物制品有限公司;酵母菌Zygosaccharomyces rouxiiCGMCC 3791、Candida versatilisCGMCC 3790 本实验室从百年老字号酿造企业的酱油醪中分离,经26S rDNA和ITS区域序列测序、鉴定并命名后保藏于CGMCC;乳酸菌Tetragenococcus halophilus CGMCC 3792 本实验室从百年老字号酿造企业的酱油醪中分离,经形态、生理生化特性实验后,16S rDNA测序鉴定,保藏于CGMCC;大豆、小麦 本地农贸市场购买。
酱醪发酵罐 不锈钢罐,自制,容积10L;DHP-9162电热恒温培养箱 上海一恒科学仪器有限公司;酸度计、PHS-3C精密pH计 上海精密科学仪器有限公司;气-质联用仪Trace GC Ultra DSQ II(Thermo,美国),配备HP-5MS(30.0m×0.25mm×0.25μm,Agilent,美国)毛细管色谱柱;CAR/PDMS固相微萃取针头 75μm,美国Supelco公司。
1.2 实验方法
1.2.1 酱醪制备 参考文献[8]所述方法与步骤,将沪酿3.042培养成麸曲种子,参考文献[8]所述方法与工艺条件,以大豆、碎炒小麦为原料制成酱油曲。
a.酱油曲与55℃,25%盐水以1∶1.8(kg∶kg)混合均匀,置于30℃保温,其酱醪简称AC;
b.添加乳酸菌:与a相同的曲水比例混合后,添加Tetragenococcus halophilus CGMCC 3792的菌悬液,酱醪中菌体浓度为5×107cfu/mL,置于30℃保温发酵,其酱醪简称为AL;
c.添加混合酵母菌:与a相同的曲水比例混合后,置于30℃发酵3d,酱醪的pH降为5.8时,加入Zygosaccharomyces rouxii CGMCC 3791菌悬液,其菌体浓度达4.5×106cfu/mL,同温度发酵4d后,加入Candida versatilis CGMCC 3790菌悬液,酱醪中总菌体浓度为9.5×106cfu/mL,其酱醪简称为AY。
d.酵母菌与乳酸菌共培养:与a相同的曲水比例混合后,添加TetragenococcushalophilusCGMCC 3792的菌悬液,酱醪中菌体浓度为5×107cfu/mL,置于30℃保温发酵,当酱醪的pH降为5.8时,加入Zygosaccharomyces rouxii CGMCC 3791菌悬液,其菌总体浓度达5.5×107cfu/mL,同温度发酵4d后,加入Candida versatilis CGMCC 3790菌悬液,酱醪中总菌体浓度为6×107cfu/mL,其酱醪简称ALY。
1.2.2 理化指标测定
1.2.2.1 样品前处理 酱醪取样后于-20℃冷冻保存,检测前迅速用乳钵磨研至均匀酱状,加80mL沸水溶解,冷却后定容至100mL,过滤待测。
1.2.2.2 酱醪中总酸(TA)、氨态氮(FN)和还原糖(RS)的测定 参考文献[9]的方法并以酱醪干重计。
1.2.3 挥发性组分的测定
1.2.3.1 样品前处理 在检测前,冷冻的酱醪样品迅速用乳钵研磨至均匀酱状。
1.2.3.2 测定方法及GC-MS条件 采用顶空-固相微萃取法(HS-SPME)[14]。称取酱醪0.50g于5mL顶空瓶中。在45℃超级恒温水浴锅中预平衡15min,插入固相微萃取针头萃取40min后将其针头取出于GCMS进样口解吸3min,进行挥发性组分分析。GC-MS条件:色谱柱为HP-5MS(30.0m×0.25mm,0.25μm膜厚)石英毛细管柱;程序升温,初始温度40℃,保持5min后,以4℃/min升至100℃,然后以6℃/min升至220℃,保持8min;进样口温度250℃;载气流速为1.0mL/min;载气为高纯氦;离子源温度、连接口温度分别为230℃和250℃;EI电子能量为70eV;质量扫描范围为35~400amu。
1.2.4 挥发性组分的鉴定及数据处理 待测样品的质谱图通过与标准谱库(NIST05)比对鉴定,匹配度大于800(最大值为1000)的结果才予以报道。使用X-caliber软件系统对结果数据进行处理,采用峰面积归一化法确定各组分相对含量。挥发性组分相对含量以平均值±标准偏差(RSD)(n=3)。
2 结果与讨论
2.1 酱油主要理化指标分析
添加不同耐盐微生物对酱醪FN、TA、RS的影响如图1所示。添加不同的微生物菌株,酱醪的主要理化指标呈相同的变化趋势。随着培养时间的延长,酱醪中FN的含量逐渐增加,到75d后逐渐趋于稳定(见图1(a))。酱醪中FN的含量主要与酶活性高低、微生物代谢能力以及Maillard反应速率有关[10]。发酵初期,水解酶活力较高,酶促作用较强[11],同时,微生物数量较少,对FN的利用缓慢,所以FN含量显著增加。随着发酵的进行,酶活逐渐降低,酶促水解作用逐渐减缓,微生物代谢作用加强,Maillard反应速率加快,因此,FN含量增幅变缓,发酵75d时即接近最大值。在发酵中后期,FN生成速率与消耗速率相等时,FN含量趋于稳定。图1(a)中,发酵第125d时添加微生物的各酱醪中FN的含量均略高于对照组。
图1(b)为发酵过程中酱醪TA的变化趋势,可以看出,酱醪TA含量随着培养时间的延长逐渐升高,主要是酶促降解形成及微生物代谢生成的有机酸所致[12]。发酵125d后,添加T.halophilus的酱醪,由于乳酸菌的生长,产生大量乳酸和有机酸使酱醪TA增加,而添加Z.rouxii和C.versatilis的酱醪TA含量最低,主要是由于乙醇的产生抑制了产酸菌的生长,而采用T.halophilus、Z.rouxii和C.versatilis共培的酱醪,TA含量和对照样品没有明显的区别,表明采用共培养的方式发酵生产酱醪对TA含量没有显著的影响。
图1(c)为酱醪发酵过程中RS的变化趋势。在发酵初始阶段,淀粉酶酶解作用较强,微生物的代谢缓慢,RS含量逐渐增加,随着发酵的进行,水解酶活力逐渐降低,加之微生物代谢增强,RS的消耗量逐渐增加,因此RS含量逐渐降低。添加微生物的各酱醪样品,由于微生物的代谢作用,使RS浓度迅速降低,发酵125d后,RS含量显著低于未加微生物的样品。乳酸菌由于代谢相对缓慢,因此RS的消耗速率低于添加酵母菌和添加混合菌的样品。

图1 酱醪理化指标变化Fig.1 Changes in physicochemical properties during soy sauce mash fermentation
2.2 添加耐盐微生物对酱醪挥发性组分的影响
图2为酱醪发酵初始和125d的挥发性组分总离子流图。由图2可知,经长时间发酵的酱醪挥发性组分组成发生了明显变化,且添加不同微生物的样品挥发性组分含量相差较大。
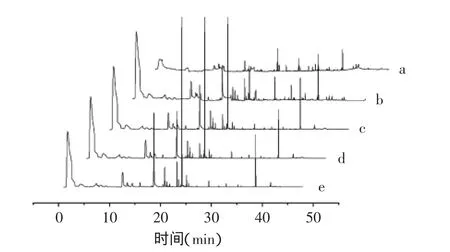
图2 酱醪挥发性组分总离子流图Fig.2 Total ion chromatogram of volatile compounds in soy sauce mash
HS-SPME/GC-MS跟踪分析检测发酵125d时各酱醪样品,共检出47种挥发性组分,其中醇类组分5种,酯类组分17种,酮类组分3种,醛类组分5种,酸类组分2种,酚类组分3种,呋喃类组分2种,吡嗪类组分3种,其他组分7种。在检出的组分中,酸类、醛类、酚类组分是先增加然后降低而趋于稳定,酯类组分则下降后又升高而趋于稳定,其他组分则是逐渐降低最后趋于稳定(见图3)。添加Z.rouxii和C.versatilis强化了发酵前期产醇类、酯类和醛类组分能力,添加T.halophilus使醇、酯、醛和酚组分的形成能力均减弱。经过125d发酵后,与对照样品相比,醇类和醛类组分均有所增加,酚类组分有所降低,酸类、酯类和其他组分因添加的微生物不同而呈或增或减的变化趋势。
表1列出了发酵第125d酱醪之间差距较大的挥发性组分的相对含量。添加T.halophilus的酱醪2-甲基丁酸含量显著高于其他样品(较对照组提高53.4%),而添加Z.rouxii和C.versatilis以及T.halophilus、Z.rouxii和C.versatilis共培养的酱醪2-甲基丁酸含量与对照样品没有明显区别。实验共检测出4种含量存在差异的醇类(乙醇、2-甲基丁醇、1-辛烯-3-醇和苯乙醇),除苯乙醇外其他组分含量都明显高于对照样品。醇类组分,除EMP途径产生乙醇外,许多高级醇由糖类、氨基酸转化及酵母菌利用醛类转化而来,乙醇、1-辛烯-3-醇等含量因工艺、原料配比等不同而异[7,13-14]。醇类物质可产生使人愉快的气味,如1-辛烯-3-醇具有浓郁的蘑菇香气,2-甲基丁醇具有水果香气,对酱油风味贡献较大[13,15]。添加T.halophilus的酱醪2-甲基丁醇含量最高,较对照组高337.3%,添加Z.rouxii和C.versatilis的酱醪乙醇含量最高,较对照组高64.2%。采用T.halophilus、Z.rouxii和C.versatilis共培养的酱醪1-辛烯-3-醇含量最高,较对照组高56.7%。苯乙醇赋予酱醪玫瑰和蜂蜜的味道,但是由于其风味阈值较高(200mg/L)[16],因此,其对酱醪的主体风味可能不会构成明显的影响。
酯类组分主要来源于酸-醇酯化反应,其独特的香甜味对酱油风味的形成具有重要作用[17]。本研究共检测出酯类组分17种,酱醪中主要的酯类组分是苯甲酸乙酯和苯乙酸乙酯和棕榈酸乙酯,苯甲酸乙酯在添加T.halophilus的酱醪中含量降低,棕榈酸乙酯含量没有明显变化。添加耐盐微生物的酱醪乙酸异戊酯含量均显著高于对照样品(AL提高388.2%,AY提高376.5%,ALY提高358.8%),乙酸异戊酯主要赋予香蕉和水果香味,而且其风味阈值较低(1.6μg/L),因此对食品风味有较大影响[18]。另AY中乙酸乙酯较对照组提高56.3%。
醛类组分赋予酱油清香、果香、坚果香的特质,本研究中检测出酱醪中的主要醛类组分是苯甲醛,而且添加耐盐微生物后,尤其是T.halophilus、Z.rouxii和C.versatilis共培养的酱醪,其含量明显高于对照样品(提高26.3%),苯甲醛主要呈现焦香味[19],因此,添加酵母菌和乳酸菌能显著改善酱油的风味。此外,本研究还检出了3种酮类物质和3种吡嗪类物质,除四甲基吡嗪外,其余组分均没有显著的变化;吡嗪类组分主要赋予酱油焙烤味对改善酱油风味有明显影响[15,20]。

图3 酱醪特征挥发性组分变化Fig.3 Changes of typical volatile compounds in soy sauce mash

表1 酱醪特征挥发性组分相对含量Table 1 Relative content of typical volatile compounds in soy sauce mash
3 结论
本论文研究了添加耐盐微生物(T.halophilus、Z.rouxii和C.versatilis)对酱油品质的影响。添加耐盐微生物的酱醪FN高于对照样品,添加T.halophilus的酱醪TA高于其他各组样品,而采用3种微生物共培养的酱醪对FN和TA没有显著变化。同时通过GC-MS分析了酱醪挥发性组分变化,发酵第125d后,与对照组相比,添加耐盐微生物后酱醪2-甲基丁醇、1-辛烯-3-醇、乙酸异戊酯、苯甲醛和四甲基吡嗪含量显著增加。研究结果表明,添加耐盐微生物有利于多种风味物质的生成,可显著改善酱油风味。关于耐盐乳酸菌和酵母菌在酱醪发酵中的作用机制及风味形成机理还有待进一步研究。
[1]张海珍,蒋予箭,陈敏.多菌种制曲与发酵在酿造酱油中的应用现状[J].中国酿造,2008(17):1-4.
[2]冯云子,崔春,高献礼,等.中式酱油与日式酱油非挥发性成分的比较[J].食品与发酵工业,2010,36(7):62-66.
[3]罗龙娟,高献礼,冯云子,等.中式酱油和日式酱油香气物质的对比研究[J].中国酿造,2011(5):150-155.
[4]Yong F M,Wood B J B.Microbial succession in experimental soy sauce fermentations[J].International Journal of Food Science& Technology,1976,11(5):525-536.
[5]谢小保,欧阳友生,曾海燕,等.高盐稀醪酱油发酵原油中微生物区系研究[J].微生物学通报,2007,34(3):504-507.
[6]曹小红,刘卓,鲁梅芳,等.耐盐乳酸菌与酵母菌在酱醪汁中协同作用的研究[J].中国酿造,2009(3):12-15.
[7]van der Sluis C,Tramper J,Wijffels R H.Enhancing and accelerating flavor formation by salt-tolerant yeasts in Japanese soy-sauce processes[J].Trends in Food Science& Technology,2001,12(9):322-327.
[8]包启安.酱油科学与酿造技术[M].北京:中国轻工业出版社,2011:299-306.
[9]GB/T 5009.1-5009.100-2003.食品卫生检验方法 理化部分(一)(二)[S].北京:中国标准出版社,2004.
[10]Martinus S I F S,Van Boekel M A J S.Kinetics of the glucose/glycine Maillard reaction pathways:influences of pH and reactant initial concentrations[J].Food Chemistry,2005,92(3):437-448.
[11]李丹,崔春,王娅琴,等.高盐稀态酱油酿造中蛋白质降解规律研究[J].食品发酵与工业,2010,36(9):24-28.
[12]刘振民,王荫榆.乳酸菌产酸特性研究[J].乳业科学与技术,2010(4):169-172.
[13]Lee S M,Seo B C,Kim Y S.Volatile compounds in fermented and acid-hydrolyzed soy sauces[J].Journal of Food Science,2006,71(3):146-156.
[14]Gao X L,Cui C,Zhao H F,et al.Changes in volatile aroma compoundsoftraditionalChinese-type soy sauce during moromi fermentation and heat treatment[J].Food Science and Biotechnology,2010,19(4):889-898.
[15]张艳芳,陶文沂.两种发酵酱油风味物质的分析研究[J].精细化工,2008,25(5):486-490.
[16]Munoz D,Peinado R A,Medina M,et al.Biological aging of sherry wines under periodic and controlled microaerations with Saccharomyces cerevisae var.capensis:Effect on odorant series[J].Food Chemistry,2007,100(3):1188-1195.
[17]Sun S Y,Jiang W G,Zhao Y P.Profile of volatile compounds in 12 Chinese soy sauces produced by a high-salt-diluted state fermentation[J].Journal of the Institute of Brewing,2010,116(3):316-328.
[18]Gin A,Osako K,Okanoto A,et al.Effect of meat washing on the development of impact odorants in fish miso prepared from spotted mackerel[J].Journal of the Science of Food Agric,2011,91(5):850-859.
[19]Petra S,Peter S.Characterization of the key aroma compounds in soy sauce using approaches of molecular sensory science[J].Journal of Agricultural and Food Chemistry,2007,55(15):6262-6269.
[20]赵建新,顾小红,刘杨岷,等.传统豆酱挥发性风味化合物的研究[J].食品科学,2006,27(12):684-687.

