马铃薯糖苷生物碱抗真菌活性构效关系研究
赵雪淞,李盛钰,何大俊,王 娟
(1.辽宁工程技术大学矿业学院,辽宁阜新123000;2.东北师范大学生命科学学院,吉林长春130024)
马铃薯为茄科植物,在世界范围内广泛种植,是人类的重要食品之一。糖苷生物碱是马铃薯产生的一类次生代谢物,属于皂苷类物质,主要包括α-茄碱(α-solanine)和α-查茄碱(α-chaconine)。茄碱和查茄碱具有相同的苷元茄啶(solanidine),但是它们的糖链不同。茄碱的糖链由一个半乳糖、一个葡萄糖和一个鼠李糖组成,而查茄碱的糖链由一个葡萄糖和二个鼠李糖组成。从马铃薯糖苷生物碱糖链末端水解下一个或二个单糖,得到β-或γ-产物(见图1)。马铃薯糖苷生物碱具有广泛的生物活性,一方面,马铃薯糖苷生物碱对昆虫、真菌、细菌、病毒、肿瘤等都具有抑制作用,具有植物保护作用及重要的药用价值;另一方面,马铃薯糖苷生物碱对人和哺乳动物具有毒性作用,直接威胁人类的食品安全,口服1~5mg/kg体重能引起人严重中毒反应,而口服3~6mg/kg体重就能致人死亡[1-2]。因此,研究糖苷生物碱的构效关系具有重要意义。本文研究了马铃薯糖苷生物碱茄碱和查茄碱及其水解产物和硫酸化物的抗真菌活性,并分析了化合物结构与其活性的关系,以期为人类的食品安全和有效利用糖苷生物碱资源奠定基础。
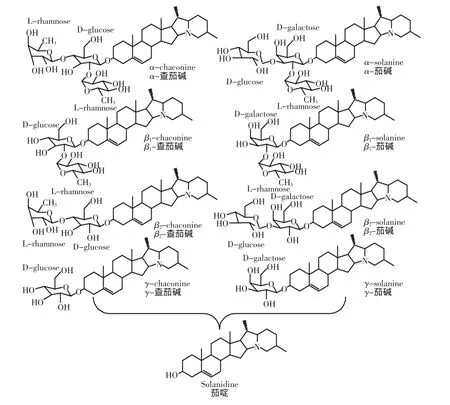
图1 马铃薯糖苷生物碱及其水解产物的化学结构Fig.1 The chemical structure of potato glycoalkaloids and their hydrolysates
1 材料与方法
1.1 材料与仪器
芸薹小尾孢(Cercosporella brassicae)、葱链格孢(Alternaria porri)、茄链格孢(Alternaria solani)和腐皮链孢霉(Fusarium solani) 由吉林省农科院赠送,PDA培养基,25℃暗保存。
旋转蒸发仪 上海亚荣化学仪器厂;FD-1型冷冻干燥机 北京博医康有限公司;Bruker AV-600型核磁共振仪 以DMSO-D6为溶剂;BCN-1360B型超净工作台 北京东联哈尔仪器制造有限公司;全自动立式压力蒸汽灭菌器 上海博讯实业有限公司;DHG-9075A型电热鼓风干燥箱 上海一恒仪器有限公司;DNP-5162型电热恒温培养箱 上海精宏实验仪器有限公司;PHS-3C型酸度计 雷式分析仪器厂。
1.2 实验化合物的制备
马铃薯糖苷生物碱α-茄碱和α-查茄碱采用马铃薯皮0.5%硫酸室温浸提、硅胶柱层析分离纯化、NMR鉴定的方法获得,具体参见文献[3];酸水解产物β1-查茄碱、β2-查茄碱、γ-查茄碱和β2-茄碱采用HCl-CH3OH溶液制备,NMR鉴定,具体方法参见文献[4];硫酸化衍生物6-O-硫酸查茄碱和6-O-二硫酸茄碱的制备包括5个步骤:4,4’-双甲氧基三苯甲基氯对C-6位羟基进行选择性保护,然后将剩余羟基进行全乙酰化保护,使用三氟乙酸的二氯甲烷液将C-6位伯醇羟基的保护基脱去,然后对C-6位羟基进行定位硫酸化修饰,最后脱去乙酰化保护获得产物,具体方法参见文献[5]。
1.3 抗菌活性测定

2 结果与讨论
2.1 α-茄碱、α-查茄碱及其水解产物的抗真菌活性
为了解糖苷生物碱糖链对其抗真菌活性的影响,α-茄碱(α-solanine)和α-查茄碱(α-chaconine)被水解为β1-查茄碱(β1-chaconine)、β2-查茄碱(β2-chaconine)、γ-查茄碱(γ-chaconine)和β2-茄碱(β2-solanine)(见图2)。β1-茄碱(β1-solanine)和γ-茄碱(γ-solanine)没有制备成功。α-茄碱、α-查茄碱和它们的水解产物的抗真菌活性测定结果见图2~图4。
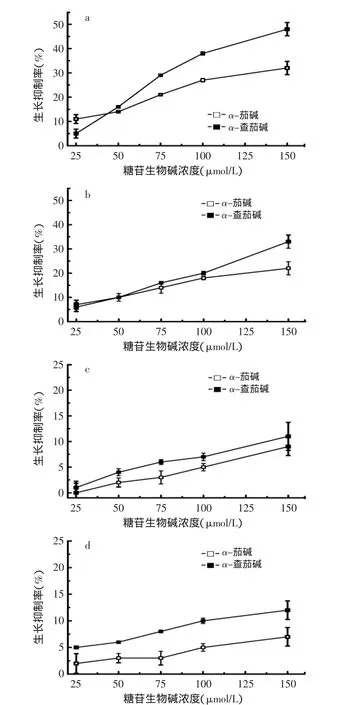
图2 α-茄碱和α-查茄碱对真菌生长的抑制作用Fig.2 The effect of α-solanine and α-chaconine on fungal growth
结果显示,马铃薯糖苷生物碱对真菌生长有抑制作用,对芸薹小尾孢(C.brassicae)和葱链格孢(A.porri)的抑制作用较强,对茄链格孢(A.solani)和腐皮链孢霉(F.solani)的抑制作用较弱。α-查茄碱的抗真菌活性高于α-茄碱。α-查茄碱对芸薹小尾孢菌丝生长的半数抑制浓度(IC50)为148μmol/L,对葱链格孢菌丝生长的半数抑制浓度为333μmol/L。α-茄碱对芸薹小尾孢的半数抑制浓度为418μmol/L,对葱链格孢的半数抑制浓度为978μmol/L。α-查茄碱和α-茄碱对茄链格孢和腐皮链孢霉菌丝生长的半数抑制浓度均大于1000μmol/L。
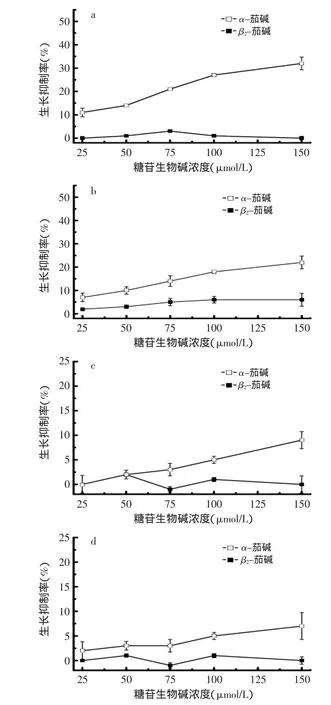
图3 α-茄碱和β2-茄碱对真菌生长的抑制作用Fig.3 The effect of α-solanine and β2-solanine on fungal growth
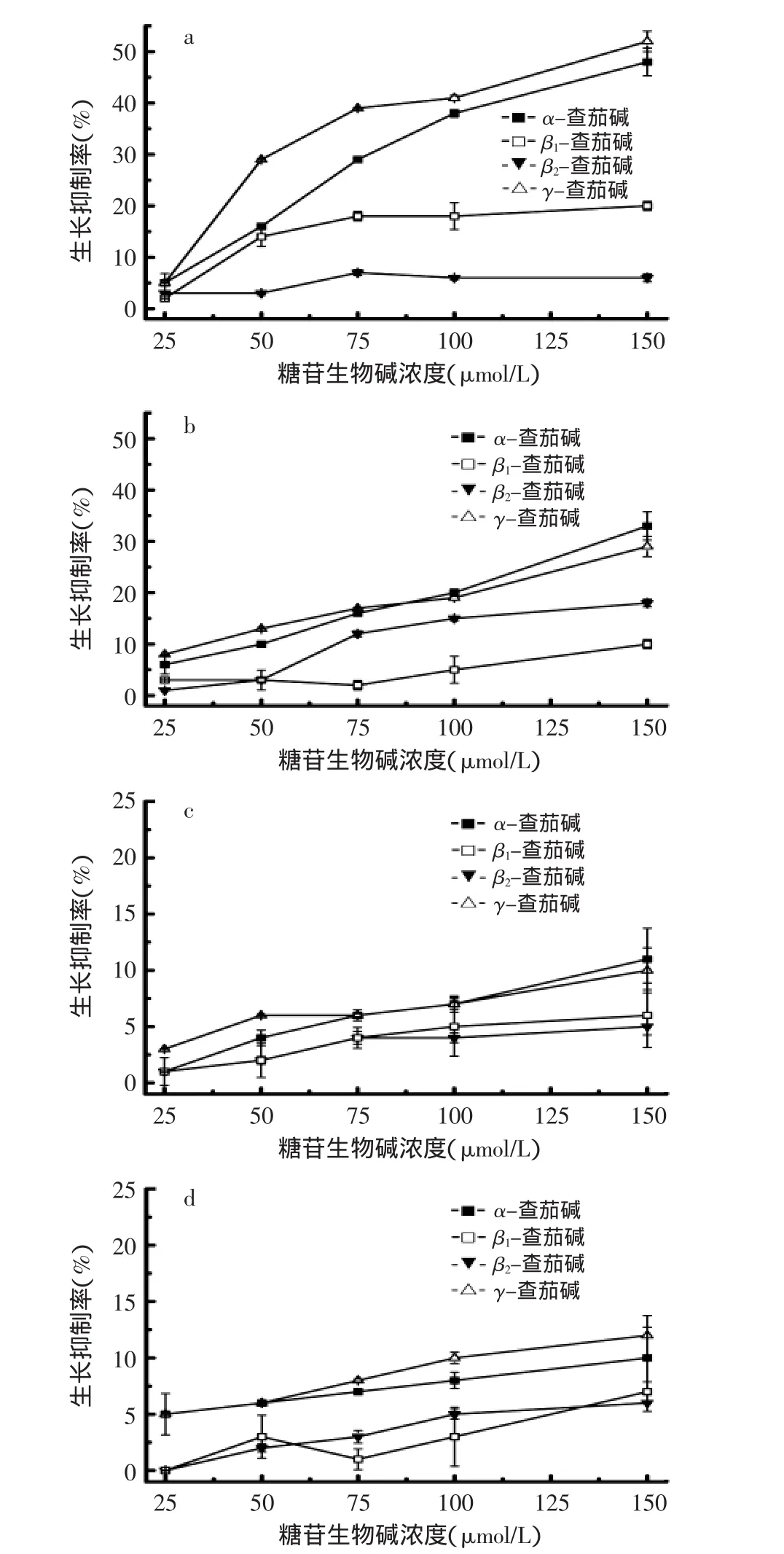
图4 α-查茄碱、β1-查茄碱、β2-查茄碱和γ-查茄碱对真菌生长的抑制作用Fig.4 The effect of α-chaconine,β1-chaconine,β2-chaconine and γ-chaconine on fungal growth
马铃薯糖苷生物碱对真菌生长的抑制强度呈计量依赖性,α-查茄碱抗真菌活性高于α-茄碱,这个结果与我们以前的研究结果一致[3]。α-查茄碱与α-茄碱具有相同的苷元,而α-查茄碱的糖链为由一个葡萄糖和二个鼠李糖组成的查茄三糖,α-茄碱的糖链为由一个半乳糖、一个葡萄糖和一个鼠李糖组成的茄三糖。因此,α-查茄碱与α-茄碱的抗真菌活性差异是其糖链组成不同所致,受试真菌对糖苷生物碱不同的敏感性可能由于真菌生物膜上的甾醇数量不同所致。因为糖苷生物碱抗真菌活性的机理被认为是糖苷生物碱能与生物膜上的甾醇类物质专一性结合,形成复合物,当这种复合物在双层膜的外层达到一定密度时,形成稳定的、不可逆的复合物,这样在膜外层的甾醇类物质变得不可移动,内层的甾醇类成分就会翻转过来并结合到膜的外层,接着也与糖苷生物碱形成复合物,这样大量的复合物形成大量的极性头部群,而不能维持原来的膜的结构,最后造成膜的破裂;糖苷生物碱分子糖基之间的相互作用可能介导了糖苷生物碱-甾醇复合体在膜上的聚集,糖苷生物碱导致生物膜破裂的程度与膜上甾醇浓度成正比[6-7]。
β2-茄碱是α-茄碱水解掉一个鼠李糖得到的水解产物,它的抗真菌活性与α-茄碱相比显著降低。
β1-查茄碱和β2-查茄碱是α-查茄碱水解掉一个鼠李糖之后得到的水解产物,它们的抗真菌活性与α-查茄碱相比显著降低,α-查茄碱水解掉二个鼠李糖后生成的γ-查茄碱的抗真菌活性与母本化合物相比没有显著变化。
上述这些结果说明,α-查茄碱和α-茄碱失去一个糖分子后,抗真菌活性显著降低,而α-查茄碱失去二个糖分子后,抗真菌活性变化不大。前人研究发现:与α-查茄碱相比,β1-查茄碱和β2-查茄碱对蛙卵的致畸活性和对生物膜的破裂活性显著降低;但是β1-查茄碱和β2-查茄碱的抗肿瘤活性与α-查茄碱相比没有显著变化[7-9]。γ-查茄碱以前被检测过对蛙卵的致畸作用,结果表明,与α-查茄碱相比,γ-查茄碱毒性降低,致畸活性下降[8]。综合文献和本文的研究结果,可以说明:生物检测系统对马铃薯糖苷生物碱水解产物的生物活性有很大影响,采用不同的生物系统,得到的结果有很大不同。但是,上述结果都说明马铃薯糖苷生物碱糖链上的单糖数目对其生物活性影响很大。糖链上的单糖数目减少,会使糖苷生物碱的水溶性下降,同时改变其空间结构,因此导致生物活性改变。
2.2 α-茄碱、α-查茄碱及其硫酸化衍生物的抗真菌活性
为了进一步评估马铃薯糖苷生物碱抗真菌活性构效关系,我们进行了α-茄碱和α-查茄碱糖链6位羟基硫酸化,制备了6-O-双硫酸茄碱和6-O-硫酸查茄碱(见图5),并检测了抗真菌活性(见图6)。
结果显示,100μmol/L α-茄碱和α-查茄碱有显著的抑菌活性,α-查茄碱的活性较强;6-O-硫酸查茄碱和6-O-双硫酸茄碱完全失去了抗真菌活性,6-O-双硫酸茄碱甚至轻微促进了真菌生长。我们以前的研究发现,茄科植物龙葵中的糖苷生物碱α-边缘茄碱(α-solamargine)的硫酸化产物6-O-硫酸边缘茄碱(6-O-sulfated solamargine)的抗癌活性也显著低于α-边缘茄碱[10]。上述研究结果说明,糖苷生物碱糖链上的6位羟基(6-OH)是糖苷生物碱的活性关键部位,6位羟基的硫酸化修饰可能导致了糖苷生物碱脂溶性下降,从而降低或失去了与膜甾醇结合的能力,导致生物活性减弱甚至消失。
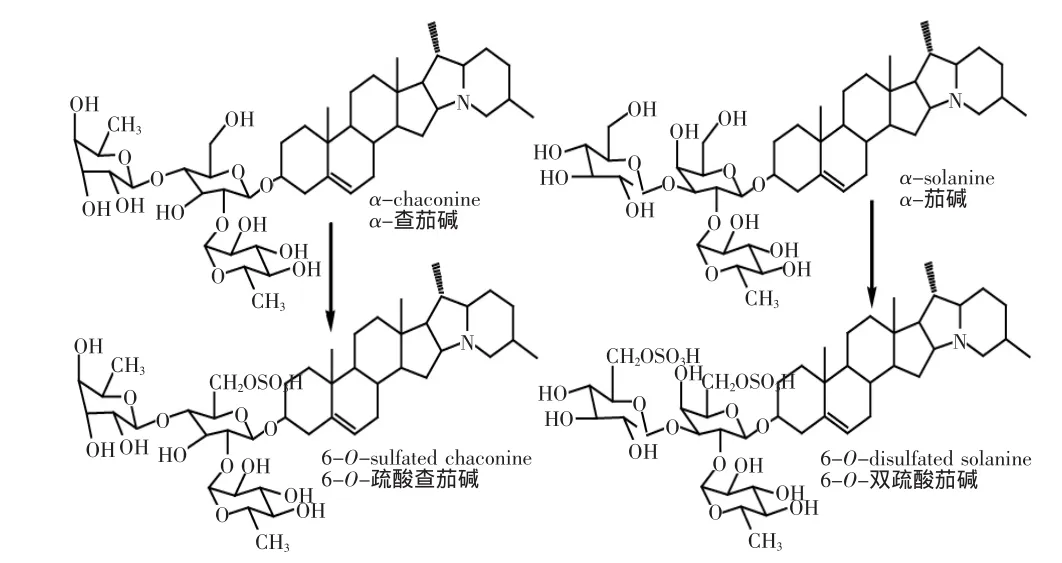
图5 6-O-硫酸查茄碱和6-O-双硫酸茄碱的化学结构Fig.5 The chemical structure of 6-O-sulfated chaconine and 6-O-disulfated solanine
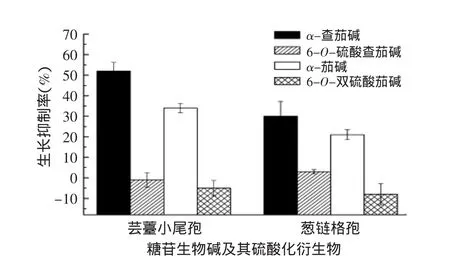
图6 100μmol/L的α-查茄碱、α-茄碱、6-O-硫酸查茄碱和6-O-双硫酸茄碱对真菌生长的抑制作用Fig.6 Growth inhibition(relative to the control)of fungi by α-chaconine,α-solanine,6-O-sulfated chaconine and 6-O-disulfated solanine at 100μmol/L
3 结论
通过测定马铃薯糖苷生物碱类化合物的抗真菌活性,分析并比较了化合物抗菌活性的相对强弱并从其结构上进行了讨论。糖链的单糖组成、连接方式、连接顺序和单糖数目等都会影响其生物活性,糖链影响其生物活性的机理可能是糖苷生物碱糖链参与了糖苷生物碱与膜甾醇的结合并发挥了关键作用。
[1]Milner S E,Brunton N P,Jones P W,et al.Bioactivities of glycoalkaloids and their aglycones from solanum species[J].J Agric Food Chem,2011,59:3454-3484.
[2]Barceloux D G.Potatoes,Tomatoes,and Solanine Toxicity(Solanum tuberosum L.,Solanum lycopersicum L.)[J].Diseasea-Month,2009,55(6):391-402.
[3]赵雪淞,高聆,王娟,等.五种茄科糖苷生物碱及其混合物的抗真菌活性研究[J].天然产物研究与开发,2009,21(1):36-43.
[4]何大俊.糖苷生物碱的结构和抗肿瘤活性研究[D].长春:东北师范大学,2006:22-38.
[5]Zhao J M,Li S Y,Zhou Y F,et al.6-O-Sulfated modification of natural glycoalkaloids chaconine and solanine[J].Chem Res Chinese Univ,2006,22:189-192.
[6]Roddick J G,Rijnenberg A L.Effect of steroidal glycoalkaloids of the potato on the permeability of liposome membranes[J].Physiol Plantarum,1986,68:436-440.
[7]Keukens E A J,Vrije T,Boom C,et al.Molecular basis of glycoalkaloid induced membrane disruption[J].Biochim Biophys Acta,1995,1240:216-228.
[8]Rayburn J R,Bantle J A,Friedman M.Role of carbohydrate side-chains of potato glycoalkaloids in developmental toxicity[J].J Agric Food Chem,1994,42:1511-1515.
[9]Lee K R,Kozukue N,Han J S,et al.Glycoalkaloids and metabolites inhibit the growth of human colon(HT29) and liver(HepG2)cancer cells[J].J Agric Food Chem,2004,52:2832-2839.
[10]Li S Y,He D J,Zhang X,et al.Modification of sugar chains in glycoalkaloids and variation of anticancer activity[J].Chem Res Chinese Univ,2007,23:303-309.

