杀虫防菌Bt工程菌的构建
张星炜,房宝玲
(1.邯郸市环境保护局,河北 邯郸 056000;2.邯郸学院,河北 邯郸 056000)
在世界范围内,病虫害一直是制约农作物高产、稳产、优质的重要因素。随着研究的深入,利用微生物制剂杀虫防病也已经成为研究最热之点[1]。苏云金芽孢杆菌(Bacillusthuringiensis简称Bt)是目前全球应用最广泛、最有效的微生物杀虫剂,具有杀虫特异性高、毒力高及无公害污染等特点。它的主要作用机理是靠Bt芽孢形成期的细胞能够合成由一种或多种杀虫蛋白质起作用[2],但对农作物病原细菌并不起作用。目前一些细菌病害对植物造成毁灭性侵染,如侵染马铃薯的软腐病;水稻、棉花、菜豆的白叶枯病;蕃茄、大豆、小麦、水稻的青枯病等[3]。植物病原细菌侵染寄主组织后,不是立即使农作物致病,而是每个细菌细胞分泌一种可溶性的小分子信号分子——酰基高丝氨酸内酯(Acyl-homoserine lactone,简称AHL),随着细菌的生长,细菌群体密度提高,AHL的浓度逐渐增大,当环境中的AHL积累到临界浓度时,AHL诱导启动细菌一系列致病基因的表达产生致病力,使寄主农作物感病[4]。因此可以设想,如果将AHL作为靶分子,人为地阻断或消除AHL的积累,使其难以达到诱导致病因子表达的临界浓度,病原菌将丧失致病力。本研究旨在利用转基因技术将我们已经成功地克隆到的AHL水解酶基因导入苏云金芽孢杆菌中,构建成具有抗植物细菌病害的Bt工程菌。从而利用Bt毒蛋白的杀虫作用和AHL水解酶水解AHL的特性,达到既能杀虫又能使植物病原细菌失去致病力的双重效果。这为生物防治农作物病虫害开辟了一条新途径。
1 材料与方法
1.1 材料
1.1.1 菌种
E.coliDH5α本实验室保存,宿主杀虫菌Bt由生物所微生物研究室提供,采用从原始菌接入LB平板培养基中长出的菌作为测试菌。
1.1.2 质粒
pUC18-ss10,抗Ap,由本实验室构建并保存;pHT304,抗Ap+Em,由武汉病毒研究所提供并保存;pKS+质粒本试验室保存;pKSJ-ss10质粒这次实验中构建;pHTss10304这次实验中构建。
1.2 方法
1.2.1 重组质粒的构建
质粒DNA的提取、酶切、连接等操作方法见文献[5]。
用EcoRI和BamHI双酶切质粒,回收ss10基因片段,插入到质粒pKS+的EcoRI和BamHI双酶切位点,构建质粒pKSJ-ss10。然后用SacI和SalI双酶切pKSJ-ss10,回收携带ss10基因片段,插入到Bt-E.coli的穿梭载体pHT304的SacI和SalI双酶切位点,构建了pHTss10304穿梭质粒。
1.2.2 重组质粒的转化
1.2.2.1 大肠杆菌感受态细胞的制备及CaCl2法转化大肠杆菌,见文献[6]。
1.2.2.2 电转化法转化Bt
将Bt单菌落接种于5ml LB培养液中,在30℃下振荡培养至OD600为0.5-0.6;培养物在冰水中放置5-10min,4℃,5000g离心20min,弃上清,用100ml 0-4℃甘油双蒸水溶液悬浮洗涤细胞2次;加入等体积10%甘油小溶液合装成5ml管;加1ul质粒,混匀,吸150ul到1ml转化杯中,冰水放置5min;调基因导入仪的参数1.25kV,5uF,800-1000Ω;按放电开关后,快速加入1ml SOC培养基,并用吸管将菌液转至无菌的小管中,37℃下,100rpm振荡培养60min;将上述转化的细胞涂于含抗性培养基上,过夜培养,挑单菌落、提取质粒酶切鉴定。
1.2.3 携带ss10基因的穿梭载体的鉴定
(1)PCR鉴定:以质粒为模板,以5′GTC GAA TTC CTC AAC AAG ATA CTC CTA ATG ATG T 3′和5′ATC GGA TCC ATG ACA GTA AAG AAG CTT TAT TTC G 3′为引物,反应条件为94℃5min,(94℃30sec,59℃45sec,72℃2min)25个循环,72℃10min,4℃pause,琼脂糖凝胶电泳检测。
(2)酶切鉴定:利用Sac I和Sal I双酶切质粒,条件为37℃水预1h,琼脂糖凝胶电泳检测。
1.2.4 质粒稳定性的检测
重组菌株在没有抗性的LB液体培养基中传代20次后,稀释涂布在LB固体培养基上,培养至单菌落,分别挑取100个单菌落于双抗培养基上进行培养,来观察有多少个单菌落带有双抗性,以确定该质粒是否有稳定性。
2 实验结果与分析
2.1 携带水解酶基因ss10穿梭载体的构建及转化
借助中间载体pKS+将纯化的水解酶ss10基因两端EcoRI和BamHI两酶切位点转化为sacI和salI双酶切位点最后将该片段插入到pHT304质粒的sacI和salI酶切位点之间,构建成携带水解酶基因ss10穿梭载体pHT304ss10。将该质粒CaCl2法转入到大肠杆菌DH5α中,提取质粒,酶切,进行琼脂糖凝胶电泳鉴定,最后利用电转化法将构建好的双元载体转化到对白菜青虫具有良好杀死作用效果的Bt中。挑取单菌落,提取质粒进行酶切和PCR基因扩增,琼脂糖凝胶电泳鉴定,获得4个具有双抗性的Bt工程菌,分别标记24、33、34、36。图1和图2是以33号为例进行的PCR扩增和质粒酶切鉴定。

图1 质粒PCR扩增验证
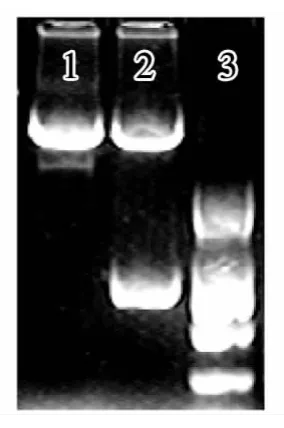
图2 质粒酶切电泳图

图3 所构建质粒的模式图
从上图可知水解酶基因ss10已经完全转化到穿梭载体上了,并且可以说明该穿梭载体已经成功地转化到宿主Bt菌中。为此可以说明已经成功地构建了具有能够抑菌和抗虫双重效果的工程菌,为后续的实验奠定了基础。
2.2 重组质粒稳定性的鉴定
将在成功构建的Bt33号工程菌在没有抗性的LB液体培养基中传代20次后,稀释涂布在LB固体培养基上,培养至单菌落,由于该工程菌具有Ap和Em双抗性,所以挑取100个单菌落分别于Ap和Em双抗LB液体培养基中,30℃,200rpm培养48h,最终99个单菌落具有双抗性。这个结果也说明构建的该重组质粒具有很强的稳定性。
3 结论与讨论
本研究借助一个中间质粒pKS+,从携带水解酶ss10的载体pUC18-ss10上成功地将水解酶基因ss10转移到E.coli-Bt的穿梭载体pHT304上,成功构建了穿梭载体pHTss10304。由于基因ss10在表达时是有方向的,它是在两个酶切位点BamH I和EcoR I之间,方向是从BamH I到EcoR I进行表达,而将该基因直接克隆到穿梭载体pHT304上方向正好相反,该基因不会表达,所以不能将该基因直接克隆到穿梭载体上。
通过电转化方法,成功地将穿梭载体pHTss10304转入到宿主菌Bt中,获得工程菌Bt24、工程菌Bt33、工程菌Bt34和工程菌Bt36。经过分子鉴定证明,已经成功地构建了具有能够抑菌和抗虫双重效果的工程菌,为后续的实验奠定了基础。
[1] Rojas-Avelizapa LI,Cruz-Camarillo R,Guerrero MI.Selection and characterization of a proteo-chitinolytic strain of Bacillus thuringiensis,able to grow in shrimp waste media[J].World J Microbiol Biotechnol,1999,15:299-308.
[2] 田颖川 王瑛.苏云金杆菌δ-内毒素基因在大肠杆菌中的克隆及表达[J].生物工程学报,1989,5(1):11-18.
[3] Chen H,Teplitski M,Gao M,Robinson JB,Rolfe BG.Bauer WD Proteomic analysis of wild typeSinorhizobiummelilotiresponses toN-acyl homoserine lactone quorum sensing signals[J].J Bacteriol,2001,185:5029-5036.
[4] Fuqua C,Parsek MR.Greenberg EP Regulation of gene expression by cell-to-cell communication:acyl-homoserine lactone quorum sensing[J].Annu Rev Genet,2003,35:439-468.
[5] Birnboim,H.C.A rapid alkaline extraction method for the isolation of plasmid DNA[J].Methods Enzymol,1983,100,243-255.
[6] 《分子克隆试验指南》(第三版)[M].科学出版社,2003.

