液相色谱—串联质谱法同时检测食品中的4种黄曲霉毒素
康绍英 周兴旺 张继红 杨代明
KANG Shao-ying ZHOU Xing-wang ZHANG Ji-hong YANG Dai-ming
(湖南省食品质量监督检验研究院,湖南 长沙 410007)
(Hunan Institute of Food Quality Supervision Inspection and Research,Changsha,Hunan 410007,China)
黄曲霉毒素是由黄曲霉、寄生曲霉等真菌代谢产生的一类有毒的真菌毒素[1,2],是一种毒性极强的剧毒物质,对人及动物肝脏组织有破坏作用,严重时,可导致肝癌甚至死亡。黄曲霉毒素存在于土壤、动植物、各种坚果,特别是花生和核桃中。在大豆、稻谷、玉米、通心粉、调味品、牛奶、奶制品、食用油等制品中也经常发现黄曲霉毒素。目前发现黄曲霉毒素有20 多个种类,其中以黄曲霉毒素 B1(AFB1)、B2(AFB2)、G1(AFG1)、G2(AFG2)4种最为常见,而黄曲霉毒素B1又最为多见,其毒性和致癌性也最强,毒性大于氰化钾[3]。1993年黄曲霉素B1被世界卫生组织(WHO)的癌症研究机构划定为1类致癌物[4],受到世界各国的广泛关注。欧盟在98/53/EC指令中规定了人类直接食用的花生中黄曲霉毒素的限量为黄曲霉B1小于 2 μg/kg,黄曲霉 B1、B2、G1、G2总量小于 4 μg/kg[5]。中国对食品中黄曲霉毒素也制定了严格的限量规定[6]。
目前黄曲霉毒素的检测方法主要有薄层色谱法(TLC)[7-9]、酶联免疫吸附法(ELISA)[7,10]、微柱法[8]、免疫亲和柱—荧光分光光度法[11]、液相色谱法(HPLC)[1,8,11-12]等。TLC虽然分析成本较低,但操作繁琐、耗时长、污染大、定量差、灵敏度差[13];ELISA虽操作简单、灵敏度高,但特异性差、重复性差,易出现假阳性[14]。HPLC因其高效、快速、灵敏度高、重现性好、准确可靠等优点而得到越来越广泛的应用,HPLC通常使用荧光检测器,样品经226多功能净化柱或免疫亲和柱净化后,还需要在柱前或柱后进行衍生,样品处理烦琐、操作复杂;本方法拟采用免疫亲和柱净化、高效液相色谱串联质谱法测定食品中的黄曲霉毒素 B1、B2、G1、G2,因为该方法目标分析物无需衍生可直接测定,能够显著的提高结果准确性,且大大缩减了样品前处理时间,此方法快速、灵敏、准确、可靠,本研究旨在寻求食品中的黄曲霉毒素B1、B2、G1、G2测定的理想方法。
1 材料与方法
1.1 仪器
TSQ Quantum三重四级杆串联质谱仪:Thermo TSQ Ultra AM,赛默飞世尔科技 Thermo Fisher Scientific公司,配有电喷雾电离源(ESI);
负压固相萃取装置:天津博纳艾杰尔科技有限公司;
恒温振荡培养箱:KYC-1102C型,上海福玛实验设备有限公司;
循环水式真空泵:SHZ-D(Ш)型,巩义市予华仪器有限责任公司;
电子分析天平:BS224S型,赛多利斯(北京)仪器系统有限公司。
1.2 试剂
黄曲霉毒素 B1、B2、G1、G2混合标准溶液(苯—乙腈(98+2)溶液):1 mL,黄曲霉毒素 B1、B2、G1、G2浓度分别为 1.055,0.327,1.082,0.309 μg/mL,SUPELCO Analytical USA。
甲醇:HPLC,Productof Tedia,United States of America;
氯化钠、氢氧化钠:分析纯,国药集团化学试剂有限公司;
基准值[34-42]指未受人类活动影响,反映土壤原始沉积环境(第Ⅰ环境)的地球化学元素含量,也就是自然条件下的地球化学背景情况,又称土壤元素本底值,用深层土壤地球化学元素含量表征。其控制因素主要是地质背景、沉积物来源等。它是研究表生元素地球化学行为的重要参比值,也是评判表层土壤“污染程度”的重要依据,是评价土壤元素丰缺、成土母质环境质量、农产品品质与安全性及防治对策等研究的参考值。
磷酸二氢钾:分析纯,天津森润生物技术有限公司;
甲酸:分析纯,重庆川东化工(集团)有限公司化学试剂厂;
乙酸铵:分析纯,西陇化工股份有限公司;
甲醇—水(7+3):取70mL甲醇加30mL水;
甲醇—水(8+2):取80mL甲醇加20mL水;
pH 7.0磷酸盐缓冲溶液:取25.0mL 0.2 mol/L的磷酸二氢钾溶液与29.1mL 0.1 mol/L的氢氧化钠溶液混匀后,稀释到100mL。
1.3 方法
1.3.1 提取
(1)大米、玉米、小麦、花生及其制品:准确称取经过磨细(粒度小于2mm)的试样10 g于150mL具塞锥形瓶中,加入2 g氯化钠及50 mL甲醇—水(7+3),于恒温振荡培养箱中振荡提取30min,定量滤纸过滤,准确移取2 mL滤液并加入4mL水稀释,备用。
(2)植物油脂:准确称取试样10 g于150mL具塞锥形瓶中,加入2 g氯化钠及50 mL甲醇—水(7+3),于恒温振荡培养箱中振荡提取30min,定量滤纸过滤,准确移取2mL滤液并加入4mL水稀释,备用。
(3)酱油:准确称取试样10 g于100mL具塞比色管中,加入2 g氯化钠及甲醇—水(8+2)至100 mL,混匀,定量滤纸过滤,准确移取2mL滤液并加入4mL水稀释,备用。
(4)食醋:准确称取5 g样品,加入1 g氯化钠,以pH 7.0磷酸盐缓冲溶液稀释至25mL,混匀,定量滤纸过滤,准确移取2mL滤液并加入4mL水稀释,备用。
1.3.2 净化 将免疫亲和柱连接于10 mL塑料注射器下并将其连接在固相萃取装置上。将样品提取液的稀释液注入注射器中,将真空泵与固相萃取装置连接,调节压力使溶液以约6mL/min流速缓慢通过免疫亲和柱,直至2~3mL空气通过柱体。以10 mL水淋洗柱子2次,弃去全部流出液,并使2~3 mL空气通过柱体。准确加入1mL色谱级甲醇洗脱,流速为1~2 mL/min,收集全部洗脱液于尖底刻度试管中,供检测用。
1.4 色谱和质谱条件
1.4.1 色谱条件 色谱柱:Hypersil GOLD C18柱 (150 mm×2.1mm,3 μm);流速:200 μL/min;进样量:5 μL;流动相:A为甲醇,B为含0.1%甲酸和5mM乙酸铵的水溶液。梯度洗脱条件:0~0.5 min,20%A;0.5~3min,20%~90%A;3~7min,90%A;7~7.1min,90%~20%A;7.1~10min,20%A。
1.4.2 质谱条件 离子源:电喷雾离子源(ESI);扫描方式:正离子扫描;喷雾电压:3 kV;离子源温度:300℃;毛细管温度:350 ℃;鞘气压力:300 kPa;扫气流速:0 L/min;辅助气流速:5 L/min;氮气作为鞘气和辅助气,氩气作为碰撞气,碰撞压力:0.2 Pa,黄曲霉毒素的质谱参数(定性离子对、定量离子对、碰撞能量、去簇电压和Tube lens)见表1。
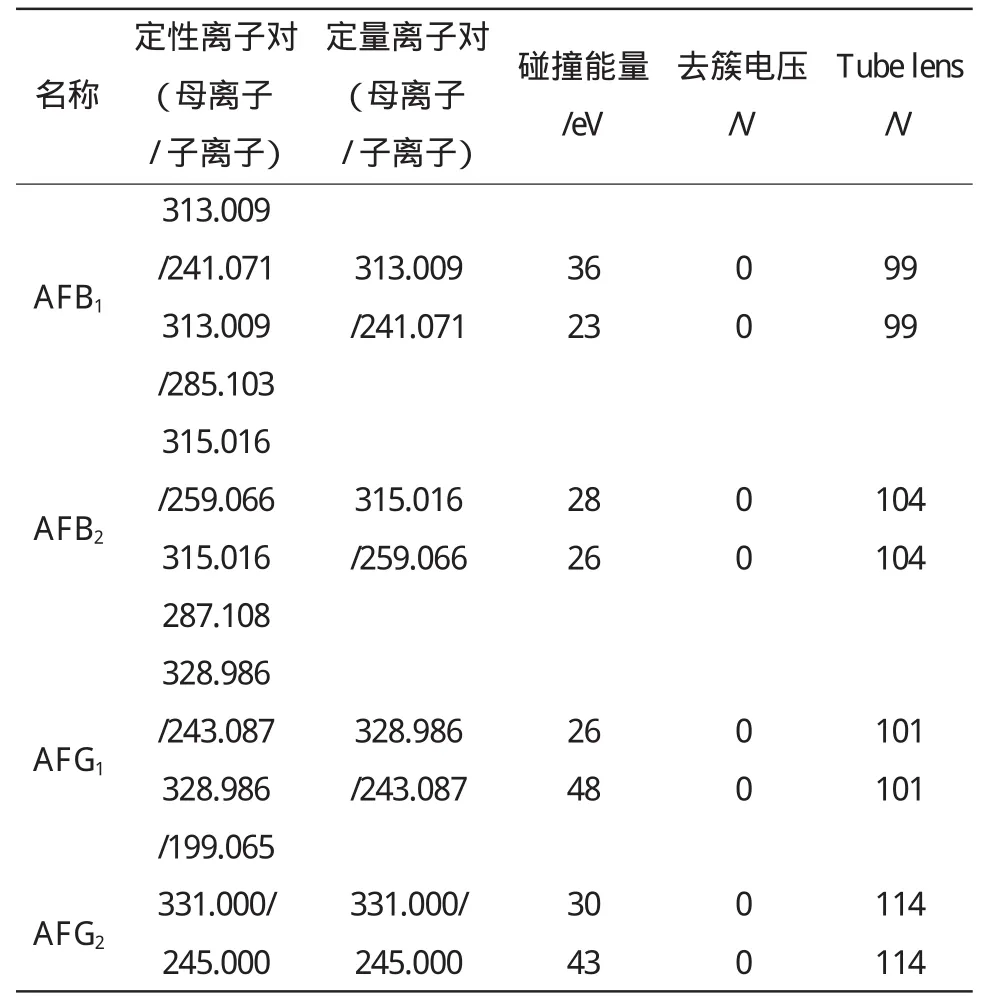
表1 黄曲霉毒素的质谱参数Table1 Mass spectrometric parametersofaflatoxin
2 结果与分析
2.1 质谱条件的优化
黄曲霉毒素是中等极性的物质,所以适合用电喷雾离子源进行离子化。试验中尝试了分别采用正、负两种离子模式,发现正离子模式下的离子化效率明显高于负离子模式。在全扫描模式下,确定了M+H作为4种黄曲霉毒素的母离子,通过直接注射进样方式调谐,对黄曲霉毒素质谱检测的喷雾电压、离子源温度、鞘气压力、辅助气压力、毛细管温度等参数进行优化,最终选定喷雾电压为3 kV、离子源温度为300℃、鞘气压力为300 kPa、辅助气压力为5 L/min、毛细管温度为350℃。在此基础上分别对每种黄曲霉毒素进行子离子扫描并优化各子离子的碰撞能量、去簇电压、Tube lens,优化结果见表1。子离子扫描时,每种黄曲霉毒素选择两个响应较强的子离子作为检测的碎片离子,其中丰度高而且稳定的离子做定量离子,最终确定了质荷比(m/z)为241.071,259.066,243.087,245.000 的子离子分别做黄曲霉毒素 B1、B2、G1、G2的定量离子。
2.2 色谱条件的优化
对于液质联用系统,流动相的选择不仅要考虑色谱系统的洗脱能力,而且还需考虑各组分在质谱中的离子化效率。由于黄曲霉毒素易溶于甲醇和乙腈,本试验分别采用甲醇、乙腈与水混合做流动相。预试验证明,虽然乙腈在液相中的洗脱效果比甲醇好,但是其离子化程度明显受到抑制,离子丰度明显降低,导致灵敏度下降,说明乙腈的离子化效率低,所以采用了甲醇作为流动相。为了促进样品的离子化达到最优灵敏度,本试验考察了水相中分别加入了0.1%甲酸、0.1%乙酸、5mM乙酸铵—0.1%甲酸混合溶液,同一浓度的各种黄曲霉毒素的峰面积数据见表2,结果表明:加入5mM乙酸铵—0.1%甲酸时得到最优的灵敏度,因此最终确定流动相条件为甲醇—0.1%甲酸和5 mM乙酸铵的水溶液的梯度洗脱,4种黄曲霉毒素在6min内得到了最佳的分离效果,黄曲霉毒 素 B1、B2、G1、G2的 保 留 时 间 分 别 为 5.90,5.80,5.67,5.53min,黄曲霉毒素 B1、B2、G1、G2标准品选择性离子色谱图见图1。
2.3 净化小柱的选择
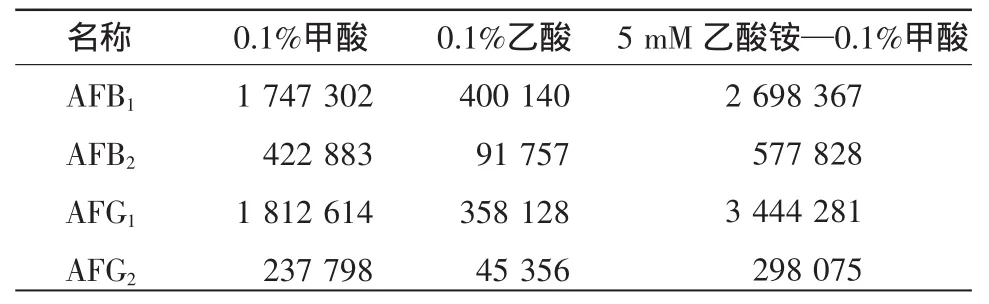
表2 流动相组成对黄曲霉毒素峰面积的影响Table2 Effectson aflatoxin peak areaof mobilephase composition

图1 黄曲霉毒素B1、B2、G1、G2标准品选择性离子色谱图Figure1 Selective ion chromatograms foraflatoxin B1,B2,G1,G2 standard
目前黄曲霉毒素的净化小柱主要有多功能净化柱和免疫亲和柱。多功能净化柱的净化原理是采取多重复合填料吸附脂肪、蛋白质、色素及碳水化合物等干扰物质,而黄曲霉毒素不被吸附,从而使样液得到净化。虽然其净化速度快,但由于其特异性不强,不能完全排除杂质干扰,尤其影响低含量黄曲霉毒素的测定。本方法选择含有黄曲霉毒素特异抗体的免疫亲和柱净化,此抗体对黄曲霉毒素B1、B2、G1、G2具有专一性,黄曲霉毒素交联在层析介质中的抗体上,使其与其他杂质(如蛋白质、多糖、脂肪等)分离,然后用水将免疫亲和柱上杂质除去,最后用甲醇将黄曲霉毒素洗脱下来。由于抗原—抗体反应只能特异性地、高选择性地吸附黄曲霉毒素,而让其他杂质通过柱子,可将净化、浓缩一步完成,大大简化了前处理过程,提高了检测灵敏度,因此是一种高效、灵敏、准确、易于推广的目前最为先进的一种净化方法。本方法比较了美国Romer公司Mycosep 226多功能净化柱和美国VICAM公司免疫亲和柱两种商品化小柱的净化效果(图2和图3)。比较两个色谱图可以看出,图3在浓缩一倍的情况下比图2的基线噪音还要低,且有效的去除了干扰目标分析物检测的杂质。
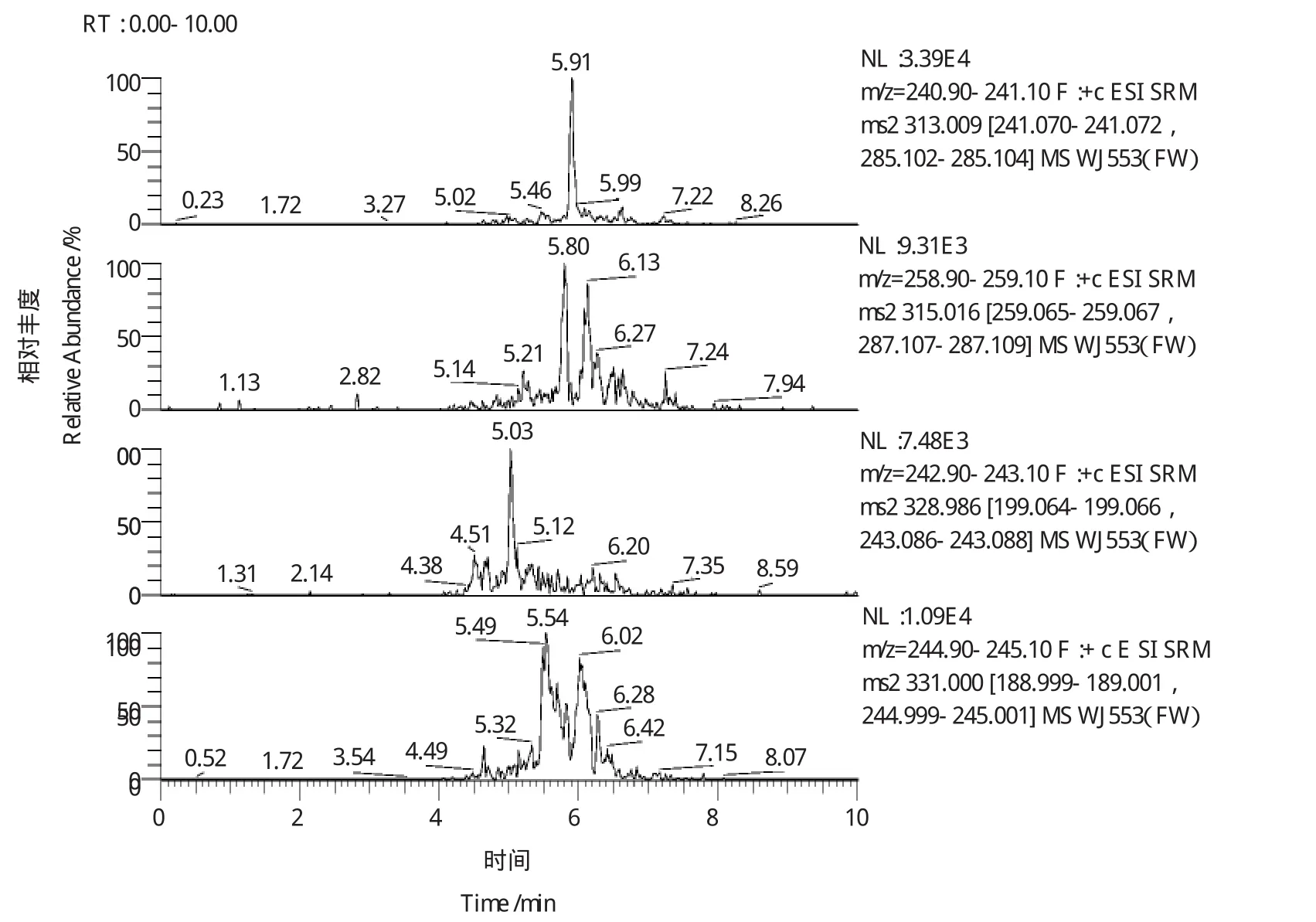
图2 多功能净化柱净化样品的选择性离子色谱图Figure 2 Selective ion chromatograms for sample purified bymultifunctional cleanup column
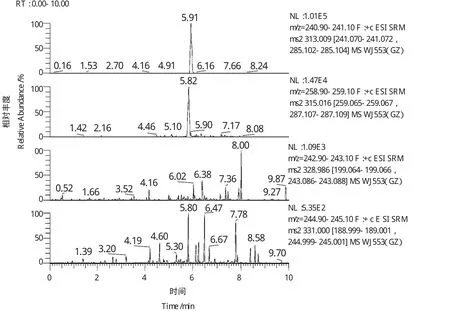
图3 免疫亲和柱净化样品的选择性离子色谱图Figure 3 Selective ion chromatograms for sample purified by immunoaffinity chromatography
2.4 线性范围与检测限
将黄曲霉毒素混合标准溶液用甲醇逐级稀释成混合标准工作溶液系列,分别进样5μL,以色谱峰面积y为纵坐标,标准工作液浓度x为横坐标对测定结果进行线性回归,线性范围、回归方程、相关系数和检测限见表3。
2.5 回收率和精密度
选取花生酱、食用油和酱油三类典型样品,在空白样中添加表4中所列的3组浓度水平的黄曲霉毒素,按上述试验条件进行加标回收试验,每个水平进行6次平行测定,测得的回收率和精密度结果见表4。从表4中的回收率及精密度可以看出,平均加标回收率在80.6%~100.6%,相对标准偏差在1.1%~7.5%,满足试验要求。

表3 黄曲霉毒素的线性范围、回归方程、相关系数和检测限Table3 Linear range,regression equation,correlation coefficientand LOD ofAflatoxin
2.6 方法验证
运用本试验建立的方法,对在风险监控中检测出的部分阳性样品分别采用液相色谱—荧光法和质谱法两种方法检测,两种方法比对数据见表5。比较两种方法检测结果表明,该方法检测结果完全符合要求。
3 结论
目前,现行有效的测定食品中黄曲霉毒素的的国标检测方法有5个,涉及薄层色谱法、酶联免疫法、微柱法、荧光分光光度法、液相色谱法,而至今中国尚未出台黄曲霉毒素的质谱检测法国家标准。与上述方法相比较,本法采用免疫亲和柱净化样品,用高效液相色谱—三重四极杆串联质谱分析样品,主要优势在于目标分析物无需衍生可直接测定,缩减了样品前处理时间,显著提高了结果的准确性和检测的灵敏度,又减少了检测的假阳性现象,此方法快速、灵敏、准确、可靠,有较强的实用性,是食品中的黄曲霉毒素 B1、B2、G1、G2测定的理想选择方法,有望在将来作为黄曲霉毒素检测的国标检测方法推行。
1 鲍蕾,刘心同,张艺兵,等.多功能净化柱高效液相色谱法检测花生中的黄曲霉毒素[J].检验检疫科学,2005,15(5):23~25.
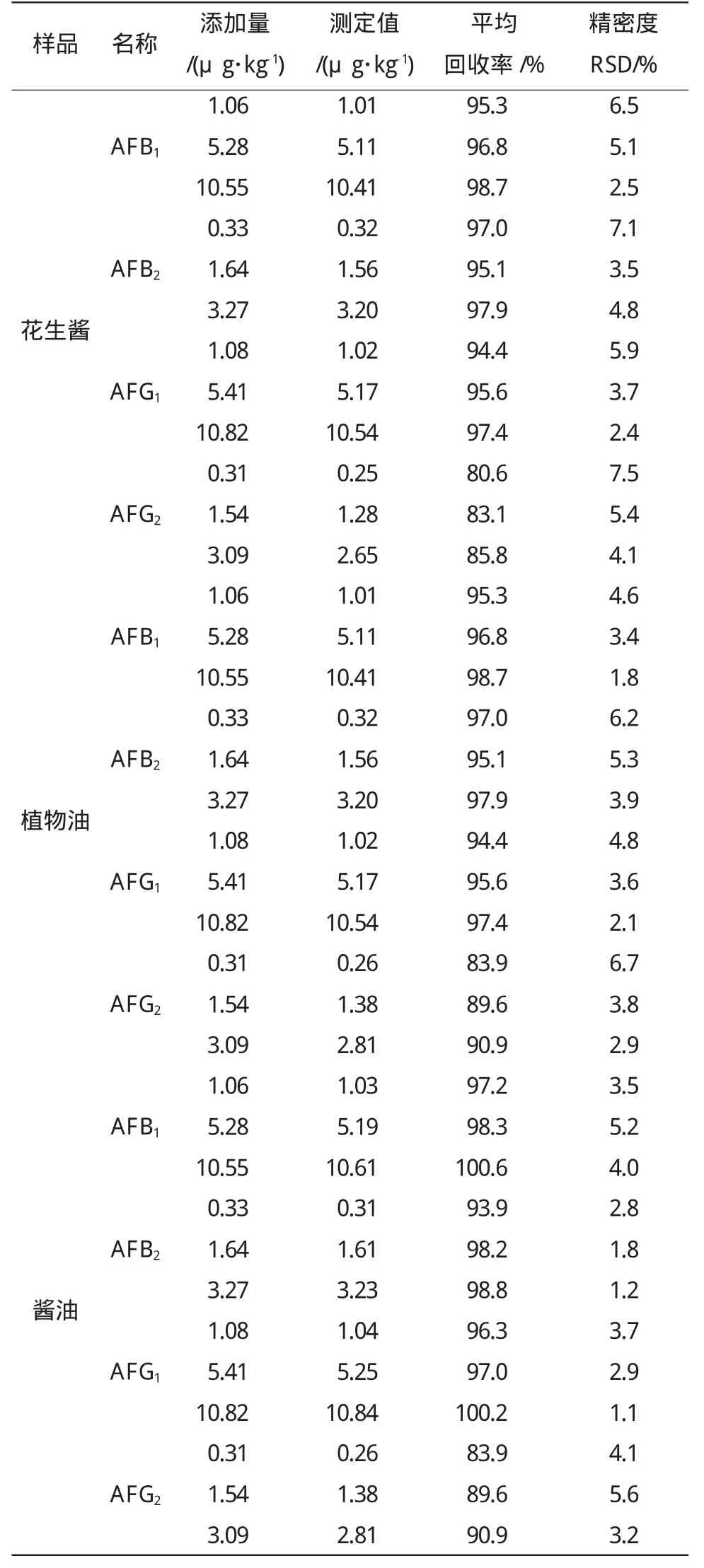
表4 回收率和精密度试验Table4 Recovery and the precision test(n=6)
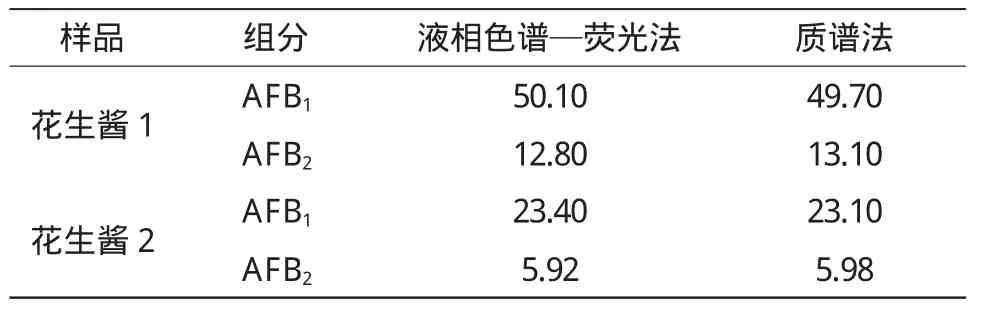
表5 两种方法比对结果Table5 Comparison resultsof twomethods/(μg·kg-1)
2 魏丽莉.黄曲霉毒素对食品的污染及防治措施[J].粮油加工,2008(9):86~89.
3 IARCWorking Group on the Evaluation of Carcinogenic Risks to Humans.Some naturally occurring substances:Food items and constituents,heterocyclic aromatic amines,and mycotoxins[M].Lyon:World Health Organization,International Agency for Research on Cancer,1993.
4 张艺兵,鲍蕾,褚庆华.农产品中真菌毒素的检测分析[M].北京:化学工业出版社,2006.
5 王晶,王林.食品安全快速检测技术[M].北京:化学工业出版社,2002:90~110.
6 中华人民共和国卫生部.GB 2761——2011食品安全国家标准食品中真菌毒素限量[S].北京:中国标准出版社,2011.
7 中华人民共和国卫生部.GB/T 5009.22——2003食品中黄曲霉毒素B1的测定[S].北京:中国标准出版社,2003.
8 中华人民共和国卫生部.GB/T 5009.23——2006食品中黄曲霉毒素 B1、B2、G1、G2的测定[S].北京:中国标准出版社,2006.
9 中华人民共和国卫生部.GB 5009.24——2010食品安全国家标准食品中黄曲霉毒素M1和B1的测定[S].北京:中国标准出版社,2010.
10 余以刚,邱杨,吴晖,李晓凤,刘冬梅.几种传统食品中黄曲霉毒素B1的检测与安全评价[J].食品与机械,2007,23(4):110~111.
11 北京市质量技术监督局.GB/T 18979——2003食品中黄曲霉毒素的测定免疫亲和层析净化高效液相色谱法和荧光光度法[S].北京:中国标准出版社,2003.
12 中华人民共和国国家质量监督检验检疫总局.GB/T 23212——2008 牛奶和奶粉中黄曲霉毒素 B1、B2、G1、G2、M1、M2的测定液相色谱—荧光检测法[S].北京:中国标准出版社,2008.
13 尚瑛达,曹素芳.薄层色谱法测定黄曲霉素B1探讨[J].粮食与油脂,1993(4):50~51.
14 田素梅.粮食中酶联免疫法和高效液相色谱法检测黄曲霉毒素探讨[J].粮油仓储科技通讯,2012(1):53~56.

