免疫荧光法检测APPSWE转基因小鼠海马内NF—κB的表达
何宁 张莉蓉
【摘 要】目的:了解阿尔茨海默病转基因小鼠海马内NF-κB的激活情况。方法:选用12月龄的阿尔茨海默病转基因阳性小鼠为模型,同窝生野生型小鼠为对照,免疫荧光法检测其海马内NF-κB的表达。结果:与对照鼠相比,AD转基因模型小鼠海马细胞内NF-κB的表达增多。结论: NF-κB在阿尔茨海默病的发病中可能起重要作用。
【关键词】阿尔茨海默病;转基因小鼠;海马;免疫荧光
阿尔茨海默病(Alzheimers Disease,AD)是一种进行性中枢神经系统退行性疾病,其主要临床表现为记忆减退、认知障碍等,发病机制尚不完全明确[1]。
核因子κB(NF-κB)是一种具有多向转录调节作用的蛋白质,与神经细胞的生长、发育、塑型有关,在多种急、慢性神经退行性变中发挥作用,本文拟通过研究阿尔茨海默病小鼠模型海马中NF-κB水平的变化,了解其在阿尔茨海默病发生发展中的作用。
1 材料、仪器
1.1实验材料
1.1.1主要试剂
兔抗鼠NF-κB多克隆抗体(Santa Cruza公司),Tap酶(Promega公司),蛋白酶K、dNTP(大连宝生物工程有限公司),Tris(上海化学试剂总厂有机化工厂),PCR引物 (北京百泰克生物技术有限公司合成)。
1.2主要仪器
荧光显微镜(BX61, Olympus),扩增仪Gene AMP 2400,TA-2R台式冷冻离心机(上海市离心机械研究所),DYY-Ⅲ-5型稳压稳流电泳仪(北京市六一仪器厂),WD-9403F紫外仪(北京市六一仪器厂)。
1.3实验动物
动物、动物鉴定及分组:APPSWE转基因模型鼠(Tg2576,美国Taconic Company),购于南京大学模式动物研究所,随机选取同窝生的APPSWE阳性小鼠和阴性鼠进行实验。
2 实验方法
2.1 DNA提取
小鼠出生后10d,剪尾巴0.5cm,置1.5ml EP管,加缓冲液(500?l 消化液+5?l 蛋白酶K)500?l,55℃的水浴中消化过夜;消化好的组织摇匀,每管加入500?l酚/氯仿(体积比1:1),混匀、离心(12000rpm,10min);转移上清液400?l至新的1.5ml EP管内,加800?l無水乙醇混匀,离心(12000rpm,5min)后弃去上清,加入800?l70%乙醇,离心(12000rpm,5min),弃去上清后晾干;加入200?lTE,放入37℃水浴1小时助溶后低温保存。
2.2 PCR反应
提取的DNA置PCR仪扩增。上游引物为5 CTG ACC ACT CGACCA GGTTCT GGG T 3,下游引物为5 GTG GAT AAC CCC TCC CCC AGG CTA GAC CA 3。PCR产物为466bp,反应条件:94℃变性45s,55℃退火1min,72℃延伸1min,共25个循环。
2.3琼脂糖电泳 1.0%琼脂糖凝胶电泳观察PCR结果。
3 免疫荧光染色
取固定好的小脑组织,切50?m冠状片,放入24孔板内,PB液冲洗3次,滴加兔抗鼠NF-κBp50多克隆一抗孵育过夜;取出24孔板放置30分钟,回收一抗,PB液冲洗3次,滴加Alexa568二抗,避光室温孵育3小时,回收二抗,PB液冲洗四次;将切片捞到玻片上,65%甘油封片,荧光显微镜下观察NF-κB表达。
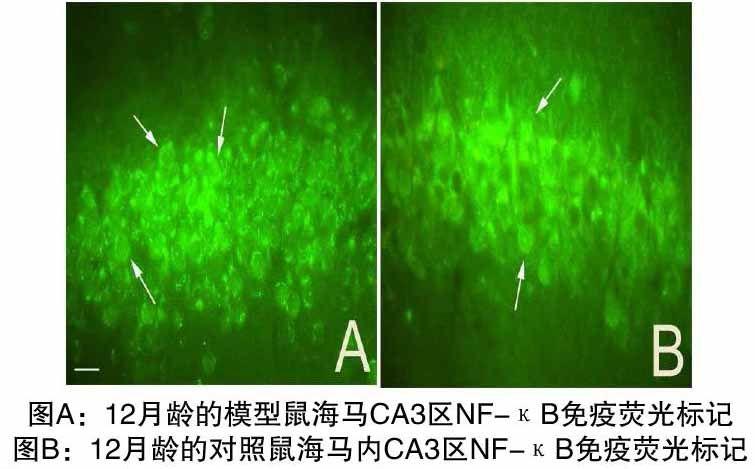
4 实验结果
通过NF-κB的激活图片可知,转基因模型小鼠的海马内NF-κB的表达多于对照小鼠。
5 讨论
NF-κB是一个多功能核转录因子,最先在B淋巴细胞中发现,其能与免疫球蛋白k轻链基因κB特异结合,故称之为核因子-κB。NF-κB激活后参与许多基因的转录调控,在感染、炎症反应、氧化应激、细胞增生、细胞凋亡等过程中发挥作用。
实验结果提示阿尔茨海默病转基因小鼠海马内的表达增高,提示NF-κB的异常表达在阿尔茨海默病的发生发展中发挥重要作用。应该注意到,NF-κB的激活可能诱导抗凋亡基因,也可能诱导促凋亡基因,结果依赖于刺激信号的类型和细胞差异[2]。已知的研究[3-6]表明可能存在以下两种途径的细胞凋亡:(1)NF-κB诱导抗凋亡因子;(2)通过蛋白间相互作用而干预凋亡信号通路。
本实验无法了解NF-κB是促进凋亡还是抑制凋亡,因此仍需进一步实验分析不同日龄的阿尔茨海默病转基因小鼠与同窝野生型小鼠脑组织NF-κB激活情况,结合不同日龄转基因小鼠与同窝生野生型小鼠脑组织细胞凋亡情况,才可以了解NF-κB是促进凋亡还是抑制凋亡,为阿尔茨海默病的发病机制和临床治疗提供更充分的理论依据。
参考文献:
[1] 王德生, 张守信主编. 老年性痴呆. 人民卫生出版社, 第一版, 2001:60-62.
[2] Grilli M, Memo M. Nuclear factor-kappa B/Rel proteins: a 74 apoptosis and downstream pathways incardiomyocytes. J Mol Cell Cardiol, 2001, 33:1223-1232.
[3] Shinichi K, Masashi S, Futoshi T, et al. Evidence that denovoprotein synthesis is dispensable for anti-apoptotic effects of NF-kB. Oncogene , 2000, 19:2233-2239.
[4] Zong WX, Edelstein L C, Chen C, et al. Theprosurvival Bcl -2 homolog Bfl-1/A1 is a direct transcrip-tional target of NF-kappa B that blocks TNFa-inducedapoptosis. Genes Dev, 2003, 13:382-387.
[5] Lee HH, Dadgostar H, Cheng Q, et al. NF-kappa B mediated up-reg?lation of Bcl-x and Bfl-1/A1 is required for CD40 survival signaling in B lymphocytes. Proc Natl Acad Sci, 2003, 96:9136-9141.
[6] Li HL, Chen DD, Li XH, et al. Changes of NF-kB, p53, Bcl-2 and caspase in apoptosis induced by JTE-522 in human gastric adenocarcinoma cell line AGS cells: role of reactive oxygen species. World J Gastro enterol, 2002, 8:431-435.

