Au-Pt合金枝状纳米线无酶过氧化氢传感器
余 刚,周怡波,常方方,张改秀,胡波年
(1.湖南大学 化学生物传感国家重点实验室,湖南 长沙 410082;2.湖南工学院 材料与化工系,湖南 衡阳 421002)
H2O2作为一种重要的化工产品,可作为氧化剂、漂白剂、脱氧剂、消毒剂,在食品、医药及日常的生活领域里都有着广泛的作用.H2O2及其中间体O·自由基作为生物体内生化反应的重要产物之一,与许多生物新陈代谢过程有关,是生化分析检测中重要的化学试剂.目前检测H2O2的方法有很多,如滴定分析法、光谱分析法、荧光检测法和电化学检测法等.在这些检测方法中,除去电化学分析法,其他方法各有其缺点,如操作复杂、检测灵敏度低等.电化学法以其高灵敏度、高选择性、检测迅速等优点,已逐渐成为H2O2检测中最流行的方法.
近些年,纳米材料因其特有的表面效应、小尺寸效应等性质,使得它们在光、电化学、催化反应等方面显示出传统材料所没有的特性,同时由于这些特性,纳米材料被应用到各个领域.贵金属因为在化学反应中高效的催化性能逐渐引起人们注意,其中 Au、Pt已应用于甲醇燃料电池[1]、促性腺激 素 检 测[2]、胆 固 醇 检 测[3]等 方 面,Naoki Toshima[4]等通过对合金结构的研究证明合金要比单金属有更好的催化性能,已有文献报道Au-Pt合金纳米颗粒已制备并用于葡萄糖检测[5]、催化氧气还原[6]等.在对H2O2传感检测方面,因为传统酶电极存在存储及实验环境苛刻、易失活、价格昂贵等缺点,人们逐渐更多去研究无酶传感器材料,Song[7]等通过化学氧化法制得CuO纳米花结构,并用于H2O2传感,灵敏度达到88.4μA·dm3·mmol-1·cm-2,传感性能良好.Cao[8]等制得MnOOH纳米线应用于H2O2检测,线性范围为1.5×10-7~1.6×10-3mol·dm-3,对于贵金属Au-Pt合金纳米线在H2O2传感方面的应用,尚未见报道,与众多纳米颗粒类传感器相比,纳米线类传感器更具优势,Yang[9]等证明了Pt纳米线修饰传感器,比Pt纳米颗粒有着更高的灵敏度、更低的检测限和更好的选择性[10],因此本文将研究Au-Pt合金纳米线在H2O2传感检测方面的应用.
对于传统生物传感器,纳米线、纳米颗粒通过模板法[11]、化学还原法[12]等制备好后,用粘合剂附着在已抛光玻碳电极表面[13],进一步做稳定处理后晾干备用.除去纳米线、颗粒制备的繁琐,修饰电极在制备过程中耗时、耗力,且不经济实惠.本文提出一种全新的纳米线修饰电极制备方法,在自制的平行Au电极表面通过交流电沉积自组装制备Au-Pt合金枝状纳米线,纳米线生长的开始有一个电化学反应过程,且在纳米线结构中形成了金属键,因此纳米线比一般化学还原法制备纳米线有着更强的力学性能,而后Au电极直接作为工作电极即可用于传感实验,简单易行,且制备出传感器有较好的灵敏度、检测限和线性范围.整个传感实验方法简便、快捷,具有很好的实际应用前景.
1 实 验
1.1 仪器与试剂
30%H2O2购于长沙立博生物有限公司,HAuCl4·4H2O和 H2PtCl6·6H2O购于上海Sinopharm化学试剂有限公司,1/15mol·dm-3的磷酸缓冲溶液(PBS,pH=6.98)由 Na2HPO4和KH2PO4溶液配制而成.保持HAuCl4·4H2O浓度 为 0.2mmol.dm-3不 变 的 条 件 下,调 整H2PtCl6·6H2O 浓度分别为 0.2,1,4,8,13 mmol·dm-3配制成不同离子浓度比的电沉积液.实验中所用试剂均为分析纯,所用水均为二次蒸馏水.
CHI 660B电化学工作站(上海辰华仪器公司),扫 描 电 子 显 微 镜 SEM (FEI QUANTA TA200),EE1412型合成(DDS)函数信号发生器,DF-101S集热式恒温加热磁力搅拌器,KQ218超声波清洗器;(10~100)×10-6dm3移液器等,用于合成与表征纳米线和传感器.
1.2 纳米线的制备及表征方法
采用交流电沉积法制备合金纳米线.Au微电极依次用0.05μm铝粉打磨后,用绒布人工抛光,用去离子水超声清洗后晾干.将Au微电极与信号发生器(SP1641D)连接后,表面滴上电沉积液,交流电压信号控制在16Vp-p(交流电峰对峰值电压),用1Hz频率成核1s,1MHz频率生长40min,沉积合成枝状纳米线,完成后沉积物用二次蒸馏水清洗,晾干备用.合金纳米线的表征在扫描电子显微镜(SEM)和X衍射仪(XRD)下进行.
1.3 H2O2传感测定方法
对H2O2的传感实验采用三电极体系:饱和甘汞电极(SCE)作为参比电极,铂电极作为辅助电极,沉积了Au-Pt合金纳米线的Au微电极作为工作电极.室温下,在搅拌速度为600r/min条件下,在 20cm31/15mol·dm-3磷酸缓冲溶液(pH=6.98)中,用移液器依次加入一定量的不同浓度的H2O2稀释溶液,以得到在保持对缓冲液体积影响不大的情况下,传感器对体系中H2O2浓度变化的电流响应.电化学工作站用电流计时法记录电流随时间变化情况,应用循环伏安法在静态溶液中进行.
2 结果与讨论
2.1 金铂合金枝状纳米线的制备与表征
采用1.1节所述的电沉积液,研究Au、Pt不同离子浓度比对合金纳米线成分的影响,合金纳米线中的Pt的含量与Pt、Au离子浓度比关系图如图1所示.
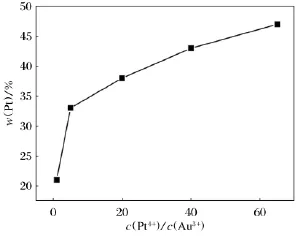
图1 合金纳米线中Pt质量分数与电沉积液中c(Pt 4+ )/c(Au3+ )关系曲线图Fig.1 Dependence of mass fraction of Pt in the bimetallic Au-Pt nanowires on c(Pt 4+ )/c(Au3+ )molar ratio in the electrolyte
从图1可看出,调整c(Pt4+)/c(Au3+)可有效控制合金纳米线的成分,当该比值在1~65之间变化时,可得到Pt质量分数大致在20%~50%的合金纳米线,且随着c(Pt4+)/c(Au3+)增大,合 金 中 Pt质 量 分 数 增 大.当c(Pt4+)/c(Au3+)小于5时,Pt质量分数随离子浓度比增加急剧变大,当离子浓度比大于5时,Pt质量分数与离子浓度比变化接近线性变化.不同离子浓度比电沉积液在相同电沉积条件下得到的合金纳米线如图2所示,其中图2e为c(Pt4+)/c(Au3+)为65∶1合成得到的合金纳米线,从图2e中可看出纳米线呈现有序枝状结构,直径约200nm.
图3为c(Pt4+)/c(Au3+)为65∶1的电沉积液,在1Hz频率成核1s,1MHz频率生长40min合成得到的合金纳米线EDX能谱图,从图中可看出合金纳米线的Au质量分数为53%;Pt质量分数为47%,即是Au53Pt47纳米线的合金成分.
单金属Au、Pt及合金Au53Pt47纳米线晶型结构用 XRD表征如图4所示,在42.4°,54.3°显示出C峰是来自于微电极的环氧树脂.在图4a、图4c可知纯Pt衍射峰是2θ=39.8°和46.1°,纯Au衍射峰是2θ=38.2°和44.4°,而图4中,b线在38.5°,44.8°,65.2°,77.4°处衍射峰是金铂合金纳峰.38.5°和44.8°合金峰衍射角位于 Au、Pt两单金属峰衍射角之间,这表明合成的合金纳米 线不是单金属的堆积,而是合金结构[14].

图2 不同离子浓度比电沉积液制备的合金纳米线电镜图Fig.2 SEM images of alloy nanowires which obtained by electrolyte with different ion molar ratios
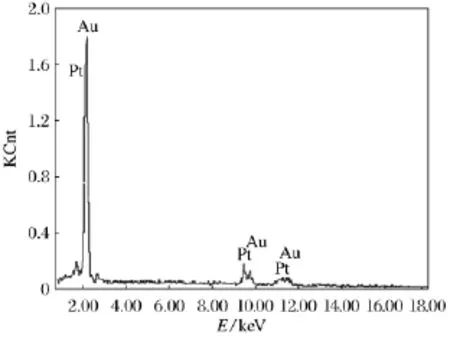
图3 Au53Pt47的枝状纳米线的EDX能谱图Fig.3 EDX pattern of the Au53Pt47alloy nanowires

图4 单金属Au、Pt及合金Au53Pt47纳米线XRD谱图Fig.4 XRD patterns of the nanowires of Pt,Au53Pt47,Au
2.2 金铂枝状纳米线的循环伏安特性及电催化性能
Au-Pt合金纳米线修饰电极在H2O2浓度为(a)0mmol·dm-3,(b)1mmol·dm-3,(c)2 mmol·dm-3,(d)3mmol·dm-3的磷酸缓冲溶液(pH=6.98)中的循环伏安曲线如图5所示(扫速:0.05VSCE/s).在图 5 中,当溶液中加入 1 mmol·dm-3H2O2后的b线,可以看到还原电流明显比a线负向增大,并在较宽的电势(0.25~-0.6VSCE)范围内均展现出显著电化学还原效应,且随着H2O2浓度进一步增大,c和d线的还原峰电流继续增大.H2O2的电化学还原是极其复杂的反应过程,根据文献[15-16],[17]4657,其反应过程可由以下方程表示:


图5 合金纳米线修饰电极在H2O2浓度为0,1,2,3mmol·dm-3缓冲溶液中循环伏安图Fig.5 Cyclic voltammogram curves of Au53Pt47alloy nanowires in PBS solutions containing 0,1,2,3mmol·dm-3H2O2
H2O2得到电子,生成的中间产物OHad,而后OHad吸附于纳米线表面得到电子形成OH-,加速了H2O2还原反应的进行.因此H2O2的还原是自动催化的反应机理,当缓冲溶液中加入H2O2,与空白溶液对比,在0.05~0.25VSCE范围内还原电流明显变大,这说明OHad在0.25VSCE处大量吸附在纳米线表面并反应生成OH-,与已知报道[18]中提到 OH-在0.25VSCE处吸附达到最大值在相符,同时证明了上述反应机理.
为了研究H2O2发生还原反应时电子的转移过程,将Au-Pt合金纳米线修饰电极在H2O2浓度为1mmol·dm-3的磷酸缓冲溶液(pH=6.98)中进行不同扫速下循环伏安实验,曲线如图6所示.
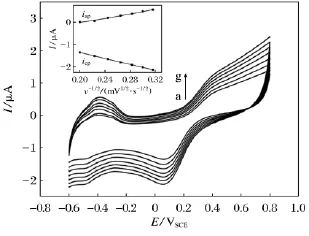
图6 合金纳米线修饰电极在不同扫速下的循环伏安图(a~g:0.04,0.05,0.06,0.07,0.08,0.09,0.1VSCE·s-1)Fig.6 Cyclic voltammogram curves for a micro-electrode modified with alloy nanowires in a PBS solution containing 1mmol·dm-3 H2O2at different scan rates(a to g:0.04,0.05,0.06,0.07,0.08,0.09,and 0.1VSCE·s-1)
由图6可看出随着扫描速率的增大,氧化峰与还原峰电流均增大且位置基本不变,由内置图可看出,峰电流与扫描速率平方根成线性关系,从而可知,电子在纳米线表面转移过程是控制扩散过程.
2.3 不同成分金铂合金纳米线修饰电极对H2O2的响应
不同成分Au-Pt合金纳米线修饰电极,应用0.1VSCE电势下,于1/15mol·dm-3磷酸缓冲溶液(pH=6.98)中对连续滴加 H2O2(逐次增加0.1mmol·dm-3)时间电流曲线如图7所示.
从图7中可看出随着合金纳米线Pt元素成分的逐渐增加,修饰电极对H2O2响应也逐渐增大.Pt成分增加,对 H2O2的还原能力越强.另外,Pt相比于Au对 H2O2还原的催化能力强[19]64,那么Pt含量越多响应越大.当c(Pt4+)/c(Au3+)为65∶1时成分为 Au53Pt47,此时 Au-Pt合金展示出Au与Pt最好的协同作用,对H2O2的电催化效应最大.

图7 不同成分合金纳米线修饰电极在0.1VSCE电势下向PBS溶液中连续加入的H2O2(0.1mmol·dm-3)的计时电流响应曲线Fig.7 Current-time curves of the microelectrodes modified with alloy nanowires of different compositions in a PBS the solution through successive addition of 0.1mmol·dm-3 H2O2at the potential of 0.1VSCE
2.4 不同类型的修饰电极对H2O2的响应

图8 不同电极在0.1VSCE电势下对连续加入的H2O2计时电流响应曲线Fig.8 Current-time response of the various modified electrodes upon successive addition of H2O2at 0.1VSCE
将空白Au微电极上沉积上单金属Au、Pt纳米线及合金纳米线后在相同实验条件下,研究对H2O2的响应,其对比如图8所示.图8为不同工作电极在相同电势下,在1/15mol·dm-3磷酸缓冲溶液(pH=6.98)中对连续滴加 H2O2(逐次增加0.1mmol·dm-3)时间电流曲线图,从图8中可看出,裸Au电极对H2O2的响应极其微小,见图8的a线,当电极上电化学沉积Au纳米线后,电极表面活化面积增大,响应电流明显增大(图8,b线),同样,当电极上沉积Pt纳米线后,响应电流进一步增大.然而,Au-Pt合金纳米线修饰电极对H2O2响应最大,见图8,d线所示Au-Pt合金纳米线比纯铂和纯金纳米线表现出更强的催化作用.
金铂合金纳米线显示更强催化性能的原因是Au原子与Pt原子相互接触紧靠在一起,而Au原子电离电势(9.225eV)大于Pt原子电离电势(8.26eV),Pt更容易失去电子,当 H2O2在纳米线表面发生反应时,电子从Pt原子转移到Au原子,并引发连续电子效应,此效应促使合金展现出比单金属更好的催化活性,因此更适合修饰工作电极.
2.5 不同电势下金铂合金纳米线修饰电极对H2O2的响应
Au53Pt47修饰电极在较宽的电势范围内(0.25~-0.6VSCE)对 H2O2有明显的电化学还原效应,为了能够得到对H2O2的响应的最佳电势,对工作电极施加以不同电势,得到电流响应曲线如图9所示.图9为成分Au53Pt47的合金纳米线修饰电极在不同电势下,于1/15mol·dm-3磷酸缓冲溶液(pH=6.98)中对连续滴加 H2O2(逐次增加0.1mmol·dm-3)时间电流曲线图,由图9看出,当电势从0.4VSCE增加到0.6VSCE,响应电流随电势正向增加逐渐增加,在0.25~-0.6 VSCE电势范围内,H2O2是被还原而得到电流信号.其中当电势为0VSCE时,电流响应最大,且在较低的测定电势下,背景电流较小,测定中干扰物的影响能被降到最低,0VSCE是H2O2还原的最合适的还原电势.

图9 Au53Pt47纳米线修饰电极在不同电势下对连续加入的H2O2计时电流响应曲线Fig.9 Amperometric responses of Au53Pt47alloy nanowires modified microelectrode in response to a successive addition of H2O2in PBS at different applied potentials
2.6 Au53Pt47修饰电极的传感灵敏度
为了测试Au53Pt47修饰电极对H2O2响应的灵敏度,实验在恒定0VSCE的电势条件下,向不断搅拌的1/15mol·dm-3磷酸缓冲溶液(pH=6.98)中每隔50s滴加不同浓度H2O2,其计时电流响应曲线如图10.由图10可看出,随着H2O2的加入,Au53Pt47纳米线修饰电极达到最大稳定响应电流,所需时间小于7s,说明所制备传感器对H2O2有快速的响应,其中线性范围20×10-6~8.38×10-3mol·dm-3(图11),相关系数为0.999(n=45),灵敏度达到129.2μA ·mmol·dm-3·cm-2,信噪比为3时,检出限可达到1.5×10-6mol·dm-3.

图10 Au53Pt47纳米线修饰电极在0VSCE电势下对连续加入的H2O2计时电流响应曲线Fig.10 Amperometric response of Au53Pt47alloy nanowires modified microelectrode with successive addition of H2O2at 0VSCE

图11 响应电流与H2O2浓度线性关系曲线图Fig.11 Dependence of response current on H2O2concentration
Au53Pt47纳米线修饰电极与已报道H2O2传感器性能对比如表1所示.从表1中可以看出,Au53Pt47纳米线修饰电极有更好的线性范围和更低的检测限将同一支电极,连续对0.1mmol·dm-3H2O2测 定 10 次,其 相 对 标 准 偏 差 为3.6%.将电极至于4℃冰箱中保存,一周后其电流响应仍能达到94%,三周后能达到89%,这说明了Au-Pt合金纳米线修饰电极具有长期稳定性.
2.7 干扰实验
抗干扰能力是电化学传感器的一个重要性能.实验在恒定0VSCE的电势条件下,向不断搅拌的磷酸缓冲溶液加入浓度均为0.1mmol·dm-3的葡萄糖、乙醇、半胱氨酸、甘氨酸、柠檬酸及乙酸得到计时电流响应曲线如图12所示.从图中可看出干扰物对电极响应干扰较小,说明了合金纳米线修饰电极对H2O2具有较强的选择性.

表1 不同材料的H2O2传感器性能对比Table 1 Comparison of sensing performance for H2O2with various materials

图12 Au53Pt47纳米线修饰电极在0VSCE电势下对浓度均为0.1mmol·dm-3的葡萄糖、乙醇、半胱氨酸、甘氨酸、柠檬酸及乙酸计时电流响应曲线Fig.12 Current response curve of Au53Pt47alloy nanowires modified microelectrode upon the concentration of 0.1mmol·dm-3glucose,ethanol,cysteine,glycine,citric acid,and acetic acid at 0VSCE
3 结 论
(1)通过交流电,低频成核,高频自组装纳米线,调整c(Pt4+)/c(Au3+)控制合金纳米线的成分,制得直径约200nm Au53Pt47枝状纳米线.
(2)在室温条件下,传感器在测定电势为0 VSCE时对H2O2的响应最大,其中H2O2浓度线性范围可达20×10-6~8.38×10-3mol·dm-3,信噪比为3时检出限可达1.5×10-6mol·dm-3,灵敏度达到129.2μA·dm3·mmol-1·cm-2.
(3)研制的传感器制备方法简单,纳米线与电极粘合牢固,力学性能强.传感器性能稳定,重现性及选择性较好.
[1] Park E K,Lee J K.Electrosynthesis of Mesoporous Pt-Au Alloy Electrode for Direct Methanol Fuel Cell[J].Journal of Physics and Chemistry of Solids,2008,69(5/6):1284-1287.
[2] Tao M, Li X. The Preparation of Label-free Electrochemical Immunosensor based on the Pt-Au Alloy Nanotube Array for Detection of Human Chorionic Gonadotrophin[J].Clinica Chimica Acta,2011,412(7/8):550-555.
[3] Aravamudhan S N,Ramgir.Electrochemical Biosensor for Targeted Detection in Blood Using Aligned Au Nanowires[J].Sensors and Actuators B:Chemical,2007,127(1):29-35.
[4] Toshima N R,Ito.Trimetallic Nanoparticles Having a Au-core Structure[J].Catalysis Today,2007,122(3/4):239-244.
[5] Kang X H,Mai.A Novel Glucose Biosensor based on Immobilization of Glucose Oxidase in Chitosan on a Glassy Carbon Electrode Modified with Gold-platinum Alloy Nanoparticles/Multiwall Carbon Nanotubes [J ].Analytical Biochemistry,2007,369(1):71-79.
[6] Guo S J,Dong S J,Wang E K,et al.Gold/Platinum Hybrid Nanoparticles Supported on Multiwalled Carbon Nanotube/Silica Soaxial Nanocables: Preparation and Application as Electrocatalysts for Oxygen Reduction[J].Journal of Physical Chemistry C,2008,112 (9):2389-2393.
[7] Song M J,Wang S W,Hang D,et al.Non-enzymatic Electrochemical CuO Nano-flowers Sensor for Hydrogen Peroxide Detection [J]. Talanta,2010,80 (11):1648-1652.
[8] Cao X,Wang N,Wang L,et al.A Novel non-enzymatic Hydrogen Peroxide Biosensor based on Ultralong Manganite MnOOH Nanowires[J].Sensors and Actuators B:Chemical,2010,147(5):730-734.
[9] Yang M H,Qu F l,Shen G l,et al.Platinum Nanowire Nanoelectrode Array for the Fabrication of Biosensors[J].Biomaterials,2006,27(35):5944-5950.
[10] Yang M H,Yang Y H,Shen G l,et al.Platinum Nanoparticles-doped Sol-gel/carbon Nanotubes Composite Electrochemical Sensors and Biosensors[J].Biosensors and Bioelectronics,2006,21(7):1125-1131.
[11] Liu S,Li L.A Novel Non-enzymatic Hydrogen Peroxide Sensor based on Mn-nitrilotriacetate Acid (Mn-NTA)Nanowires[J].Talanta,2010,81(1/2):727-731.
[12] Mott D,Luo J,Zhong C J,et al.Synergistic Activity of Gold-platinum Alloy Nanoparticle Catalysts[J].Catalysis Today,2007,122(3/4):378-385.
[13] Cherevko S,Chung C H.Gold Nanowire Array Electrode for Non-enzymatic Voltammetric and Amperometric Glucose Detection [J].Sensors and Actuators B:Chemical,2009,142(1):216-223.
[14] Qian L,Yang X R.Polyamidoamine Dendrimers-assisted Electrodeposition of Gold Platinum Bimetallic Nanoflowers[J].Journal of Physical Chemistry B,2006,110(3):16672-16678.
[15] Tim G J,Venrooij,Marc T M.Bursting and Mixed-mode Oscillations During the Hydrogen Peroxide Reduction on a Platinum Electrode[J].Electrochimica Acta,1995,40(11):1689-1696.
[16] Flatgen G,Wasle S,Lubke M,et al.Autocatalytic Mechanism of H2O2Reduction on Ag Electrodes in Acidic Electrolyte: Experiments and Simulations [J].Electrochimica Acta,1999,44(9):4499-4506.
[17] Meng F,Yan X.Nanoporous Gold as Non-enzymatic Sensor for Hydrogen Peroxide[J].Electrochimica Acta,2011,56(12):4657-4662.
[18] Zhang J T,Liu P P,Ma H Y.et al.Nanostructured Porous Gold for Methanol Electro-oxidation [J].Journal of Physical Chemistry C,2007,111(11):10382-10388.
[19] Kang Q, Yang L X. Anelectro-catalytic Biosensor Fabricated with Pt-Au Nanoparticle-decorated Titania Nanotube Array[J].Bioelectrochemistry,2008,74(1):62-65.
[20] Cui X Z,Li.Low-potential Sensitive Hydrogen Peroxide Detection based on Nanotubular TiO2and Platinum Composite Electrode[J].Electroanalysis,2008,20(9):970-975.
[21] Jamal M J, Xu. Disposable Biosensor based on Immobilisation of Glutamate Oxidase on Pt Nanoparticles Modified Au Nanowire Array Electrode[J].Biosensors and Bioelectronics,2010,26(4):1420-1424.
[22] Lee Y J,Park J Y.Amperometric Sensing of Hydrogen Peroxide Via Highly Roughened Macroporous Gold-/Platinum Nanoparticles Electrode[J].Current Applied Physics,2011,11(2):211-216.
[23] Bo X J,Damanisha C N.Nonenzymatic Amperometric Sensor of Hydrogen Peroxide and Glucose based on Pt Nanoparticles/ordered Mesoporous Carbon Nanocomposite[J].Talanta,2010,82(1):85-91.

