紫苏籽油中亚麻酸的纯化工艺研究
邓小莉,李翠霞,李畅,吴羽晨,常景玲
(1.新乡学院生命科学与技术系,河南新乡 453003;2.辉县市北云门乡政府,河南辉县 453000;3.河南科技学院,河南新乡 453003)
紫苏Perilla frutescens又名白苏、苏麻红、红苏麻,为唇形科一年生草本植物,在我国各地均有分布.紫苏籽经压榨可得紫苏油.其主要成分有α-亚麻酸、棕榈酸、亚油酸、油酸、硬脂酸、维生素E、18种氨基酸及多种微量元素.其中人体必需脂肪酸尤为丰富,是目前所知α-亚麻酸(α-LNA,化学名为全顺式-9,12,15-十八碳三烯酸)含量最高(达70%左右)、品质最好的食用植物油[1].α-亚麻酸是人体必需的营养素之一,人体若缺乏会导致各种功能性障碍和代谢紊乱[2].尤其是胎儿、婴幼儿及儿童,会对大脑发育造成不利影响.医学证实大脑的60%由特定脂肪酸构成,只有α-亚麻酸能在体内合成DHA以完成大脑发育需要[1].并对人体有显著的保健功能如降低胆固醇、提高记忆力、保护视力、增强免疫力、延缓机体衰老、预防老年痴呆和心脑血管疾病、抗癌、抗衰老、促进大脑发育等[3-6],有“植物脑黄金”的美誉.纯化紫苏籽油中的亚麻酸更有利于紫苏籽油吸收利用,特别是对紫苏籽油的深加工,提高其附加值有很大意义[7-8].本试验在低温冷冻结晶的基础上对尿素包合法的工艺流程进行优化,以期找到紫苏籽油在低温下进行尿素包合的合适溶剂和用量,提高晶体析出量,缩短晶体析出时间,为紫苏油的开发利用提供理论和技术支持.
1 材料与方法
1.1 试验材料
紫苏籽油(由河南新乡卫辉安都乡提供).
1.2 试验方法
取5只刻度试管分别加5mL紫苏籽油并编号:12h、18h、24h、36h、48h.从48 h开始每隔12 h依次将编号为36h、24h、18h、12h的离心管放入-11~-18℃冰箱的冷藏室内,12 h后立即将其在冷冻离心机5 000 r/min离心,得到浓缩α-亚麻酸的紫苏油.
1.2.2 浓缩α-亚麻酸的紫苏油最佳溶剂的选择 根据溶液的极性取无水乙醇和丙酮作溶剂,其配比V(无水乙醇)∶V(丙酮)分别为 3∶1,2∶1,1∶1,1∶2 和 1∶3.向每支离心管中加入 1mL浓缩 α- 亚麻酸的紫苏油混匀,静置1 h后加盖放入-18℃冰箱冷藏48 h后观察溶剂对α-亚麻酸粗品的溶解效果.以对浓缩α-亚麻酸紫苏油的溶解度随时间的延长而明显降低的溶剂为最佳.
1.2.3 最优溶剂与浓缩α-亚麻酸的紫苏油配比的选择 取5支离心管,各加入浓缩α-亚麻酸的紫苏油1mL,溶剂与浓缩 α- 亚麻酸紫苏油比例 V(无水乙醇)∶V(丙酮)设置 1∶4,1∶6,1∶8,1∶10 和 1∶12 共 5 个配比,考察浓缩α-亚麻酸的紫苏油与溶剂的比例对析出晶体的影响.
1.2.4 尿素包合浓缩α-亚麻酸的紫苏油最佳溶剂的选择 根据溶剂的极性分别选取无水乙醇、丙酮和乙醇∶丙酮=1∶1三组溶剂,每组溶剂在50℃条件下对浓缩α-亚麻酸的紫苏油在尿素溶剂中的溶解性进行试验,以确定最佳溶剂.
1.2.5 尿素包合浓缩α-亚麻酸的紫苏油时间的选择 最优溶解试剂与浓缩α-亚麻酸的紫苏油以10∶1的比例分别加入锥形瓶中,混匀放入50℃恒温水浴锅中,加入尿素混匀至饱和,尿素加入量均为4.5 g,常温下放置到室温后,再入冰箱分别冷藏2、12、24、36、48 h后取出,迅速滤去尿素结晶得到滤液,观察5个时间段晶体的形态,测量每个时间段晶体的平均长度.
1.2.6 浓缩α-亚麻酸的紫苏油与尿素配比的选择 将尿素包合最优溶剂和浓缩α-亚麻酸的紫苏油以10∶1 的比例加入锥形瓶混匀,加入浓缩 α- 亚麻酸的紫苏油和尿素的比例依次是 3∶1,5∶2,2∶1,3∶2,1∶1,50 ℃恒温水浴锅中水浴20min,常温放置至室温.-20℃冰箱内冷藏36 h后取出迅速滤去尿素结晶得到滤液(滤液在旋转蒸发仪中蒸发掉溶剂,加水分液即得成品),观察5个比例下尿素晶体的形态,对其长度进行测量并计算平均长度.
1.2.7 低温尿素包合纯化紫苏籽油中亚麻酸稳定性试验 在上述粗提、低温结晶、尿素包合各最优条件下做稳定性提取,考察其方法的可靠性.提取液稀释105倍,在200 nm处测定吸光度.
本次仅计算水库分水口处成本水价,据规划,设计水平年水库新增灌溉供水115.40万m3。经计算,水库农业灌溉供水新增成本水价0.4752元/m3,新增经营成本水价0.2117元/m3。工程实施后,新增农业生产成本及交纳税费暂按40%考虑,灌区内农民人均增收超过1220元/a,由此可知,该灌溉水价当地农民可以承受。
2 结果与分析
2.1 冷藏紫苏籽油时间的确定
不同冷藏时间处理对紫苏籽油析出量的影响见图1.

图1 冷藏时间对析出物质量百分比的影响Fig.1 Influence of freezing timeonweightpercentage of precipitate
由图1可知,随着冷藏时间的延长,析出物的质量百分比也逐渐增加.其中,经12、18、24 h低温处理的离心管里只有少量的析出物,处理时间为36、48 h的离心管里则出现大量的析出物,但冷藏到36 h后析出物的增加量不再明显.因此,冷藏时间在36~48 h较好.
2.2 浓缩α-亚麻酸的紫苏油最佳溶剂的确定
不同溶剂对浓缩α-亚麻酸的紫苏油在室温(20℃)和低温(-20℃)下的互溶性见表1.

表1 溶剂与浓缩α-亚麻酸的紫苏油在室温和低温下的互溶性Tab.1 Miscibility of solventand concentratedα-linolenic perillaoilat room temperature and low temperature
由表1可知,无水乙醇与浓缩α-亚麻酸的紫苏油在室温和低温下互溶性均较差;丙酮与浓缩α-亚麻酸的紫苏油在室温下有较好的互溶性,在低温下能够互溶;无水乙醇与丙酮以体积比1∶1混合时,在室温和低温下均具有较好的互溶性.
室温及低温条件下无水乙醇与丙酮的配比对溶解度的影响见表2.

表2 室温和低温条件下溶剂配比对溶解度的影响Tab.2 Effects of solubility on solventsat room temperatureand low temperature
由表2可知,随着混合溶剂中无水乙醇比例的降低,室温条件下混合溶剂对浓缩α-亚麻酸的紫苏油的溶解度逐渐增加,而在低温下,只有按体积比1∶1混合时才得到了大量的结晶,因此确定V(无水乙醇)∶V(丙酮)=1∶1的混合溶剂较好.
2.3 最优溶剂与浓缩α-亚麻酸的紫苏油配比的确定
以最优溶剂与浓缩α-亚麻酸的紫苏油的比例为横坐标,析出晶体量为纵坐标,考察最优溶剂与浓缩α-亚麻酸的紫苏油配比对析出晶体的影响,结果见图2.
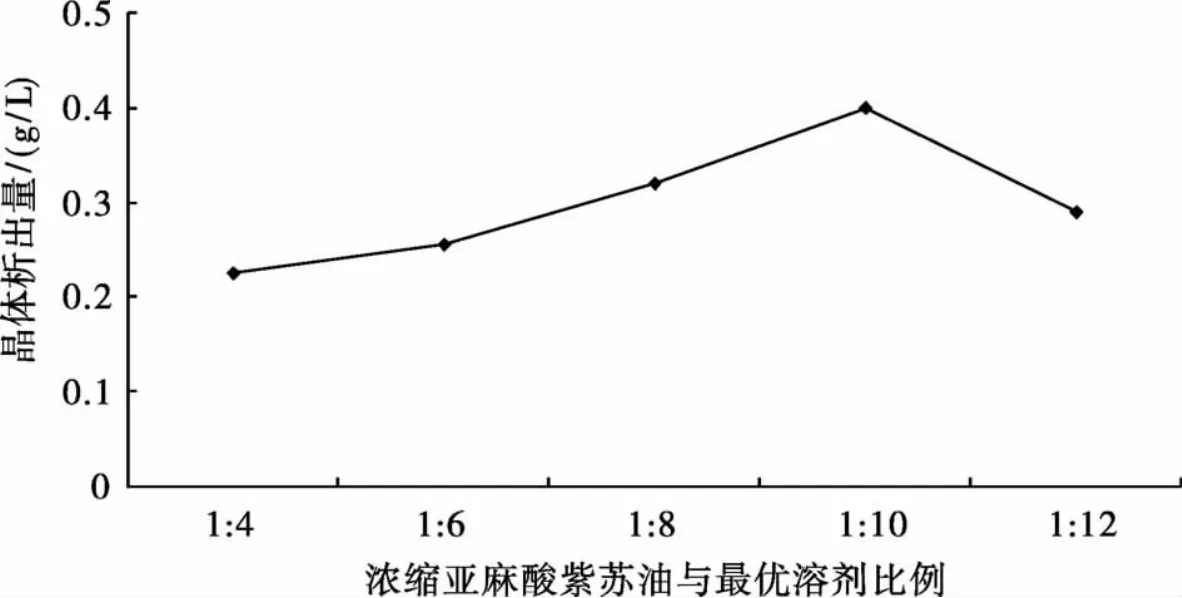
图2 最优溶剂与浓缩α-亚麻酸的紫苏油比例对晶体析出量的影响Fig.2 Effect of perillaoil ratiooptimalsolventand concentration of α-linolenic acid on the crystalprecipitation
由图2可知,随着浓缩α-亚麻酸的紫苏油与溶剂比例的逐渐增加,晶体析出量呈现先增加后下降的趋势,当浓缩α-亚麻酸的紫苏油与溶剂比例为1∶10时晶体析出量最多,因此浓缩α-亚麻酸的紫苏油与溶剂比例以1∶10较好.
2.4 尿素包合浓缩α-亚麻酸的紫苏油最佳溶剂的确定
尿素包合所选3组溶剂对尿素和浓缩α-亚麻酸的紫苏油的溶解性结果见表3.

表3 尿素包合溶剂的溶解性测试结果(50℃)Tab.3 Solubility tests of solvent of urea inclusion(50℃)
由表3可知,无水乙醇虽可以溶解较多的尿素,但与浓缩α-亚麻酸的紫苏油的互溶性很差;丙酮可以与浓缩α-亚麻酸的紫苏油任意比例互溶,但溶解尿素量太少;乙醇和丙酮按体积比1∶1混合的溶剂对浓缩α-亚麻酸的紫苏油和尿素的溶解性都较好,因此确定V(无水乙醇)∶V(丙酮)=1∶1较好.
2.5 尿素包合浓缩α-亚麻酸的紫苏油时间的确定
将分别冷藏2、12、24、36、48 h的锥形瓶取出后,迅速抽滤滤去尿素结晶得到滤液,观察5个时间段晶体的形态,测量每个时间段晶体的平均长度.结果见表4.

表4 冷藏时间对尿素结晶质量的影响Tab.4 Effects of cold storage time forurea crystalquality
由表4可知,随着冷藏时间的增加,晶体的长度也逐渐增加,在冷藏时间超过36 h后,继续增加冷藏时间晶体的增长不再明显.因此,确定冷藏时间为36 h较好.
2.6 浓缩α-亚麻酸的紫苏油与尿素配比的确定
浓缩α-亚麻酸的紫苏油和尿素的配比对尿素结晶的影响结果如表5.

表5 浓缩α-亚麻酸的紫苏油和尿素的比例对晶体长度的影响Tab.5 Influence of the proportion of concentratedα-linolenic perillaoilon urea crystal length
由表5可知,随着浓缩α-亚麻酸的紫苏油和尿素比例的增加,包合晶体长度先逐渐增长又逐渐变短,在浓缩α-亚麻酸的紫苏油和尿素之比为2∶1时,晶体长度最大为0.78 cm.因此,浓缩α-亚麻酸的紫苏油和尿素之比为2∶1时包合效果最好.
2.7 低温尿素包合纯化紫苏籽油中亚麻酸稳定性试验结果
2.7.1 α-亚麻酸标准曲线和回归方程 取α-亚麻酸标准品分别稀释为1、2、3、4、5、6和7μg/mL,测定各吸光度值,以质量浓度ρ/(μg/mL)为横坐标,吸光度A为纵坐标绘制标准曲线,得回归方程为A=0.123 3ρ+0.000 031(R2=0.999).在所选定的浓度范围内,工作曲线具有良好的线性关系.
2.7.2 稳定性试验结果及低温尿素包合纯化紫苏籽油中亚麻酸含量 稳定性试验结果见表6,低温尿素包合纯化紫苏籽油中亚麻酸与原料中亚麻酸含量的对比见表7.

表6 低温尿素包合纯化紫苏籽油中亚麻酸稳定性试验结果Tab.6 Stability test of linolenic perilla seed oilin cryogenic purification of urea inclusion

表7 低温尿素包合纯化紫苏籽油中亚麻酸与原料中亚麻酸含量的对比Tab.7 Contrast of linolenic acid in Low urea inclusion between purified of perilla seed oiland rawmaterials
由表6可知低温尿素包合纯化紫苏籽油中亚麻酸的方法稳定性良好.由表7可知低温尿素包合纯化紫苏籽油中亚麻酸含量远远高于原料中亚麻酸含量.
3 结论
本试验对低温尿素包合法纯化紫苏籽油中亚麻酸的条件进行了优化.对原紫苏油先进行低温冷藏除去榈酸凝、硬脂酸等大部分饱和脂肪酸后得到浓缩α-亚麻酸的紫苏油,在低温下再运用尿素包合对α-亚麻酸等不饱和脂肪酸作进一步提纯.对低温和尿素包合溶剂、时间、配比等工艺进行优化,最后采用粗提、冷藏与尿素包合的最优工艺条件进行了稳定性试验,证明该工艺方法可行,稳定性可靠.该工艺方法提取纯化紫苏油中的α-亚麻酸,可使紫苏油中的α-亚麻酸含量从304mg/mL提高到644mg/mL,为紫苏油的进一步深加工奠定的基础.
[1]王映强,赖炳森,颜晓林,等.气相色谱法测定紫苏子油中α-亚麻酸的含量[J].中国生化药物杂志,1998,19(2):91-92.
[2]吴旭锦,朱小甫,郭泾利.紫苏子油的应用研究进展[J].养殖技术顾问,2011(8):84
[3]徐甲,施敏,唐云,等.紫苏子油中 α- 亚麻酸的含量测定[J].科技信息,2013(1):87-88.
[4]王静珍.紫苏与白苏药理作用的研究[J].中国中药杂志,1997,22(1):48-51.
[5]陈文麟.紫苏油的特点及其利用[J].中国油料,1992(3):26-28.
[6]MichioW,Shiro A,Nobukazu T,et al.Pharmaceuticals containing xanthine oxidase inhibitor for treatment of gout[P].Eur.Pat.Appl.EP 429,038,29.
[7]王岚,夏继成.紫苏油的研究现状及应用[J].黑龙江科技信息,2011(35):1.
[8]Kazunori I,TsuyoshiY,SoyaoM,etal.Isolation and purification of α-linolenic acid[P].Jap.KokaiTok Koho JP,1988,63,295,698,02.

