1株硫苷降解菌的分离鉴定
刘建利,陈 琛
(北方民族大学生物科学与工程学院,宁夏 银川 750021)
菜籽粕是一种营养价值高的优良饲料蛋白资源。但菜籽饼中的硫甙在动物胃肠道内发生分解后,会生成异硫氰酸酯(ITC)、恶唑烷硫酮(OZT)、腈等有毒物质,限制了它在饲料工业中的应用[1]。为了降低菜籽粕的毒性,常用物理、化学和生物脱毒方法对其进行脱毒,物理、化学脱毒方法脱毒率低,脱毒范围较小,且会影响菜籽粕的适口性,另对植酸、单宁及芥子碱的脱除率较低,所以脱毒效果并不理想。生物脱毒法中微生物脱毒相对于其它方法具有成本低、条件温和、干物质损失小、硫甙降解彻底、脱毒效果好且能提高菜籽粕中蛋白质的含量和品质的优点[2]。国内已有学者对菜籽粕的微生物脱毒工艺、菌种等进行了研究,但脱毒能力仍有待进一步提高[3-8]。为此,本试验以菜籽粕为原料,分离筛选具有较高脱毒能力的菌株,为后续研究奠定基础。
1 材料与方法
1.1材料与试剂 土壤取自宁夏西马银三村小白菜菜地;镇羧甲基纤维素钠,氯化钯(上海试剂一厂生产);真菌DNA提取试剂盒购自Omega公司,引物、Taq酶、dNTP、T载体、DNA琼脂糖凝胶回收试剂盒均购自TaKaRa公司,琼脂糖、EB购自北京经科公司。
粗硫苷培养基:取油菜籽粕200 g,粉碎成细末,加蒸馏水800 mL,煮沸30 min,用3层纱布过滤去渣,10 000 r·min-1离心10 min去沉淀,定容到1 L,121 ℃灭菌30 min。
1.2主要仪器 紫外可见光分光光度计(755型,上海精科分析仪器有限公司生产),高速冷冻离心机(3K30型, 美国Sigma公司生产),摇床(HZ-9210K型,太仓市实验设备厂生产),电子天平(FA2104B,上海精密科学仪器有限公司生产),电泳仪(DYY-21型,北京六一仪器厂生产),凝胶成像系统(Gel Doc XR型号,美国Bio-rad公司生产)。
1.3试验方法
1.3.1富集培养 取15 cm表层土壤样品,装入无菌塑料取样袋带回实验室,电子天平称取0.5 g,置于无菌研钵研碎,转移至25 mL 粗硫苷液体培养基中,150 r·min-1,30 ℃振荡培养24 h。
1.3.2分离 将富集后的菌液用无菌水进行不同梯度稀释,取0.1 mL稀释菌液涂布在粗硫苷固体培养基平板上,置于28 ℃培养48 h;挑单菌落,划线转接至新的粗硫苷固体培养基平板上,置于28 ℃培养48 h至菌落长出,重复划线纯化3次,根据菌落形态和颜色不同,将已纯化的不同菌株最后接种至RSM固体培养基上于4 ℃冰箱保存。
1.3.3筛选 氯化钯-硫苷降解率法,参考王宁惠[9]的方法并略作修改。
样品准备:将分离的菌株接种于10 mL 粗硫苷液体培养基中,150 r·min-1,28 ℃摇瓶培养96 h,将培养液于10 000 r·min-1离心10 min,取上清。
显色:取0.5 mL上清液置于加入10 mL试管中,加入0.1%羧甲基纤维素钠溶液2 mL,摇匀,再加入1 mL氯化钯溶液显色。以相同体积粗硫苷培养基替代上清液为对照。
比色:在24 ℃下放置1~2 h后,以0.5 mL蒸馏水、2 mL 0.1%羧甲基纤维素钠溶液以及1 mL氯化钯溶液混合液调零,于波长540 nm测OD值。

1.3.4真菌的形态鉴定 真菌载片培养[10],根据培养菌落形态和载片培养观察菌丝和孢子形态,根据《真菌鉴定手册》初步鉴定[11]。
1.3.5DNA提取 将8号菌接种于粗硫苷固体平板上,培养5 d,刮取菌丝2 g,置于研钵中加液氮研磨后,提取步骤按照真菌DNA提取试剂盒进行,1%琼脂糖,1×TAE电泳,EB染色检测。
1.3.6ITS rDNA测序 引物:ITS1,5′-TCCGTAGGTGAACCTGCGG-3′和ITS4,5′-TCCTCCGCTTATTGATATGC-3′由上海生工合成。PCR反应体系组成:10×PCR buffer(Mg2+plus)2.5 μL,dNTP(各为10 mmol·L-1)0.5 μL,引物(10 μmol·L-1)各0.5 μL,Ex Taq酶(5 U·μL-1)0.5 μL,DNA模板1 μL,水补足使总体积为25 μL。PCR条件参考文献[12],扩增产物于加入EB的1.0%琼脂糖凝胶上电泳,凝胶成像系统照相,连接T载体,蓝白斑筛选和菌液PCR检测阳性克隆,序列测定委托生工生物工程(上海)股份有限公司完成。
1.3.7系统发育分析 将序列提交到NCBI数据库,通过BLAST程序进行比对。将所测序列及其近缘种序列Mega 5.0中NJ方法构建系统进化树,去掉支持率小于70%的分支。
2 结果与分析
2.1硫苷降解菌的分离筛选 获得10株具有降解硫苷能力的菌株(表 1 ),粗硫苷降解率在44.69%~58.11%,平均为46.75%,其中8号菌株最高,可达58.11%。
2.28号菌株形态鉴定 在PDA培养基上8号菌株菌丝疏松,表面黄绿色,背面无色或略呈褐色(图1)。在PDA培养基载玻片培养中可观察到菌丝多分枝,具隔,产生大量长而粗糙的分生孢子梗,梗端顶端膨大成烧瓶形或球形的泡囊,在泡囊表面又生出呈放射状排列的小梗(一般为双层),每个小梗顶端产生成串的表面粗糙的球形分生孢子,呈黄绿色(图2),初步判断8号菌株属于半知菌门(Deuteromycota)丝孢菌纲(Hyphomycetes)丛梗孢目(Moniliales)丛梗孢科(Moniliaceae)曲霉属(Aspergillus)黄曲霉(Aspergillusflavus)。

表1 部分菌株筛选结果Table 1 Part results of screening
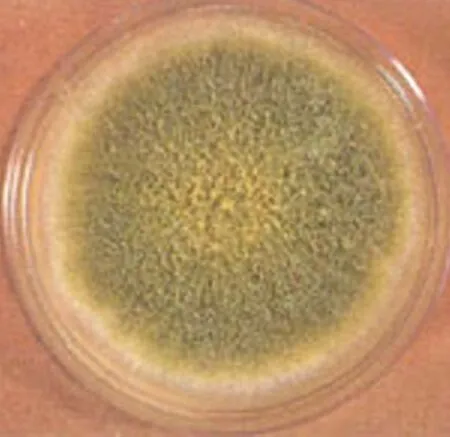
图1 8号菌株菌落Fig.1 Colony of strain No.8

图2 8号菌株分生孢子梗及分生孢子Fig.2 Conidiophores and conidia of strain No.8
2.38号菌株的基因组DNA提取和 PCR扩增ITS序列 8号菌株基因组DNA电泳结果(图3),大小约15 kb,呈带状。根据亮度判断,浓度为300~400 ng·μL-1,可满足PCR要求。采用基因组DNA 1 μL作为模板,用ITS1/ITS4引物扩增(图4),得到扩增条带,大小600~700 bp,与理论长度一致。

图3 8号菌株的基因组DNA电泳结果Fig.3 Result of agarose gel-ectrophoresis of strain No.8 genomic DNA
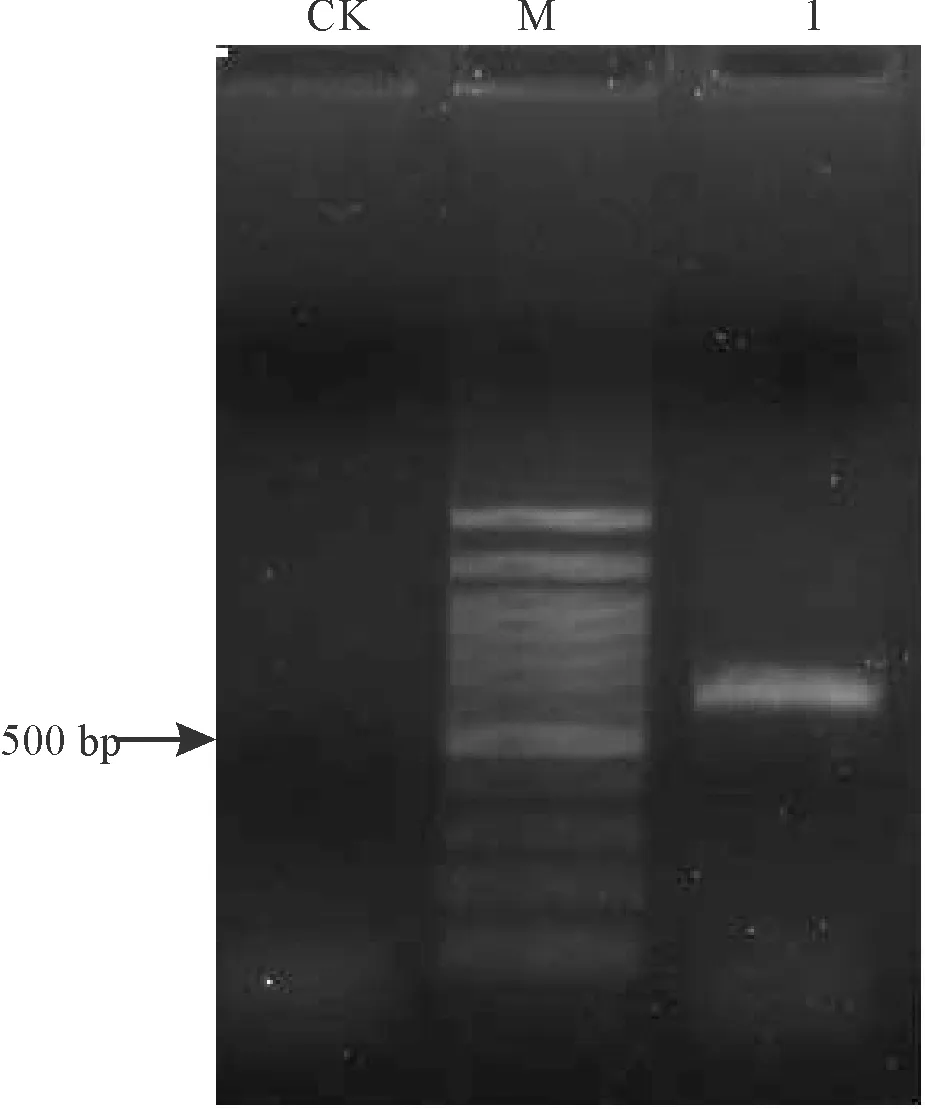
图4 PCR扩增8号菌株ITS结果电泳图Fig.4 Result of agarose gel-ectrophoresis of ITS PCR amplification of strain No.8
2.48号菌株的ITS序列分析 把所得到序列提交到GenBank数据库,进行BLAST比较,ITS序列与A.flavus同源性为99%。用MEGA5.0构建进化树(图5),8号菌株和A.flavus菌株ATCC16883(AF138287)聚为一类,分子生物学证据也显示8号菌株为黄曲霉(A.flavus)。
3 讨论
菜籽粕脱毒是一个繁杂的过程,如果单纯依靠物理或化学法脱毒往往效果不佳。而微生物种类多、生长迅速、培养成本低、代谢产酶系丰富,理论上几乎能够分解所有物质。利用微生物对菜籽粕脱毒有以下几个特点:第一,酶系丰富,产生分解硫甙的芥子酶多,能够水解结构复杂多变的硫甙;第二,微生物能将硫苷彻底分解并转化合成自身利用的物质;第三,菜籽粕中难利用的营养因子如植酸、单宁、纤维素等,也能被同时分解,提高菜籽粕的综合利用率;第四,微生物还可以产生香味物质,可大大改善菜籽粕的适口性。因此,利用微生物脱毒,是当前菜籽粕脱毒方法中较理想的方法[2]。
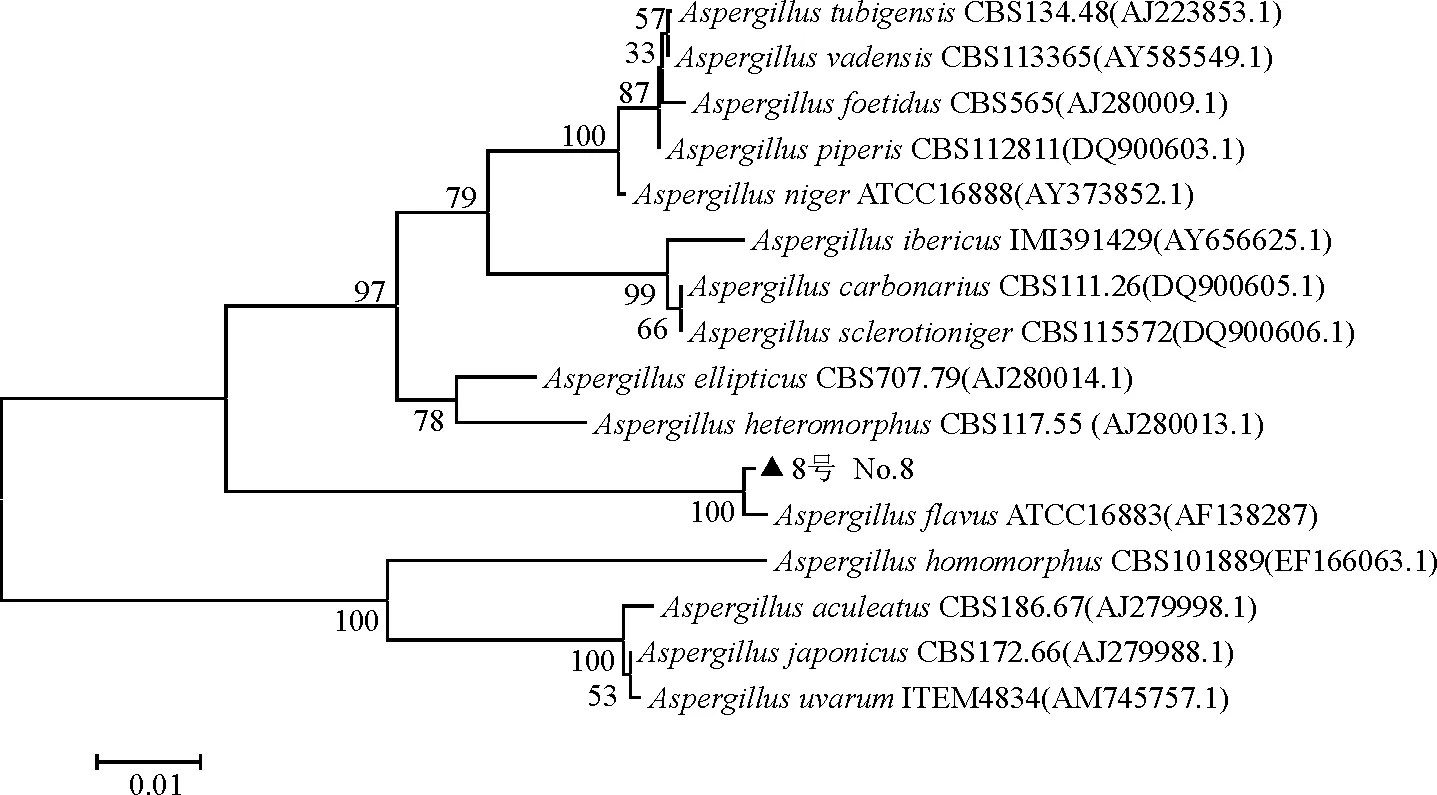
图5 8号菌株的 ITS序列构建的系统树Fig.5 Phylogenetic tree based on ITS sequences of strain No.8
本研究筛选出一批具有硫苷降解能力的菌株,粗硫苷降解率在44.69%~58.11%,平均为46.75%,最高可达58.11%,单个菌株的降解能力高于已报道的[3-7]。有研究表明,硫苷是一大类物质,基本结构之外侧链有不同,而降解硫苷的芥子酶也是一类结构类似、功能相近的酶[13-15]。因此,针对不同菜籽粕中不同的硫苷种类及含量,采用不同结构的芥子酶降解菌株可能会提高降解率,本研究分离的菌株为进一步研究不同分解酶的结构及其编码基因奠定了基础。
[1] 朱文优,李华兰,周守叙.菜籽粕脱毒方法及其特点[J].粮食与食品工业,2009,16(2):6-8.
[2] 陈君.菜籽饼脱毒方法的研究进展[J].畜牧与饲料科学,2010,31(3):33-34.
[3] 谢建坤,张强,李忠娴,等.菜籽饼发酵菌株筛选研究[J].江西农业学报,1994,6(1):75-81.
[4] 魏晶石,汪正华,沈俭.菜籽粕生物降解法脱毒及综合利用[J].西部粮油科技,1999,24(6):49-52.
[5] 蒋玉琴,李荣林,张玳华,等.复合菌脱毒菜籽饼粕及其应用Ⅰ——不同处理条件下复合菌体系发酵对菜籽饼粕硫甙的降解[J].江苏农业学报,1999,15(2):104-106.
[6] 张宗舟.菜籽饼脱毒微生物的筛选、分离、纯化与复配[J].甘肃科技纵横,2005(3):48-49.
[7] 刘军,王娟娟.菜籽粕脱毒及提高蛋白质含量菌株的筛选[J].饲料资源开发与利用,2007(10):33-35.
[8] 孙林,李吕木,张邦辉,等.多菌种固态发酵菜籽粕的研究[J].中国粮油学报,2009,24(1):85-89.
[9] 王宁惠.油菜籽(饼粕)中硫苷葡萄糖苷总量速测方法——氯化钯法[J].青海农业科技,2009(3):58-59.
[10] 周德庆.微生物学实验教程[M].第二版.北京:高等教育出版社,2006:26-32.
[11] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1982:58-647.
[12] 岳海梅,张新军,巩文峰,等.林芝地区不同草地土壤微生物区系分析[J].草业科学,2012,29(7):1019-1022.
[13] Sakorn P,Rakariyatham N,Niamsup H,etal.Rapid detection of myrosinase-producing fungi:A plate method based on opaque barium sulphate formation[J].World Journal of Microbiology & Biotechnology,2002,18(1):73-74.
[14] Meulenbeld G H,Hartmans S.Thioglucosidase activity fromSphingobacteriumsp.strain OTG1[J].Applied Microbiology and Biotechnology,2001,56(5-6):700-706.
[15] Zukalova H,Vasak J.The role and effects of glucosino-lates ofBrassicaspecies-A review[J].Rostlinná Vroba,2002,48(4):175-180.

