二苯并噻吩加氢脱硫过程在镍钼硫催化剂表面的吸附
孙 炜,王 鹏,杨 犁,方 元
(武汉工程大学绿色化工过程教育部重点实验室,湖北 武汉 430074)
0 引 言
石油加工中加氢脱硫是一个重要过程,对于提高原油加工深度,合理利用石油资源,改善产品质量,提高轻质油收率以及减少大气污染都具有重要作用[1-2].当今能源消耗趋势表明,原油日益变重变劣,而市场对优质中间馏分油的需求不断加深,因此加氢脱硫就更显重要.其中,二苯并噻吩作为石油中最主要和最难脱除的含硫物质之一,解决其在石油中的脱除的问题并获得清洁燃料,成为目前加氢脱硫研究工作的重点之一.因此对二苯并噻吩(DBT)及其在加氢过程中所产生的含硫衍生物的脱除研究更是十分必要的.然而当前人们对其反应机理,尤其是各物质在催化剂表面的吸附状态和反应网络还不是十分明确,对此有待进一步的研究探讨.对二苯并噻吩的加氢脱硫过程的研究已经有了大量文献报道,通常认为二苯并噻吩加氢脱硫过程分为直接脱硫(DDS)和预加氢脱硫(HYD)两种不同方法[3-5],图1[6]简要展示了这两种反应路径.
图1显示,二苯并噻吩(KS1过程)直接脱除其含有的硫元素,再加氢饱和(KHYD4过程);或者二苯并噻吩经先部分加氢(KHYD1或KHYD2过程)得到四氢二苯并噻吩(4 H—DBT)或六氢二苯并噻吩(6H—DBT),再脱除硫元素(KS2或 KS3过程),最后加氢饱和(KHYD5);或者直接加氢(KHYD3过程)得到饱和氢的含硫化合物十二氢二苯并噻吩(HY—DBT),最后直接脱除其中所含硫元素(KS4过程).四氢二苯并噻吩(4H—DBT)、六氢二苯并噻吩(6 H—DBT)和十二氢二苯并噻吩(HY—DBT)是二苯并噻吩的加氢脱硫过程中的重要中间产物.本实验主要研究二苯并噻吩和这些中间产物在NiMoS催化剂表面的吸附关系和吸附能.

图1 二苯并噻吩加氢脱硫反应路径Fig.1 Reaction pathways in the hydrodesulfurization of dibenzothiophenes
伴随着产业升级以及加氢脱硫工艺的进步,对高效加氢脱硫催化剂也有着更高的需求.关于此类催化剂的活性相结构也有多种模型,大部分研究者认为加氢脱硫催化剂的主催化组成是Mo(或 W),并以类MoS2(或 WS2)晶体的形式存在.研究同时发现,以Co、Ni等金属元素掺杂的硫化物催化剂较传统催化剂对加氢脱硫有更高的催化效率,其中部分已应用于工业生产中.而MoS2催化剂掺杂Co、Ni元素后也表现出不同的特点:其中含Co的MoS2硫化物催化剂对直接脱硫(DDS)活性较高且氢耗较低;而含Ni的 MoS2催化剂则有较高的预加氢活性[7].同时研究发现在以金属Ni掺杂的硫化物催化剂中,Ni元素将优先处于催化剂表面[8-9].
随着计算机性能的提高以及各种计算方法的的成熟,理论计算逐步发展成为人们进行科学研究的一项新的有效的工具,并已在石油相关领域得到运用[10-11].诸多研究人员如 Yang、Fairbridge[6]、石灵娟、叶天旭[12-13]等人都利用量子化学方法对含硫物质在硫钼催化剂上的吸附性质进行了理论计算研究.然而对于含硫物质在NiMoS催化剂表面的吸附性质的理论研究并不全面.因此本文主要是在此基础上,采用Ni取代硫钼催化剂上的Mo构建了Ni MoS催化剂,利用密度泛函理论对二苯并噻吩及其在加氢脱硫过程中各含硫化合物于催化剂表面的吸附性质进行研究,考察Ni MoS催化剂对二苯并噻吩(DBT)、四氢二苯并噻吩(4 H—DBT)、六氢二苯并噻吩(6 H—DBT)以及十二氢二苯并噻吩(HY—DBT)吸附性质的影响以及吸附能力,为Ni MoS催化剂在加氢脱硫过程中的应用提供理论研究.
1 催化剂模型和计算方法
本研究采用Ni MoS催化剂的团簇结构模型作为研究对象,其结构如图2(Ⅱ)所示.该结构是以图2(Ⅰ)所示MoS2催化剂的团簇结构模型为基础,用Ni取代其最顶层的全部Mo原子所得,并对所获的结构进行了结构优化.密度泛函理论选取广义梯度近似GGA中的PW91(Perdew and Wang)交换关联泛函在DNP基组(Basis set)和有效原子赝势(ECP)基础上进行计算,其中几何优化精度设定为“fine”,cut-off和smearing分别取值0.4 nm和0.000 5 Ha,同时考虑自旋修正.主要研究垂直吸附以及平面吸附两种吸附形式,寻找最小能量的构型.吸附能ΔE的计算方程如下:
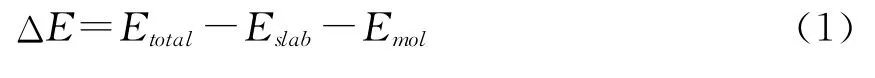
式(1)中Etotal、Eslab和Emol分别表示吸附体系的总能量、催化剂净表面能量和吸附分子在气相中的能量.对于ΔE,其符号及大小变化则表示吸附作用进行的可能性以及吸附的程度.当ΔE大于0时,表明吸附作用不能自发进行,而需要外加能量;当ΔE小于0时,则表明吸附作用能自发进行,且负值越大吸附越稳定,见图3.
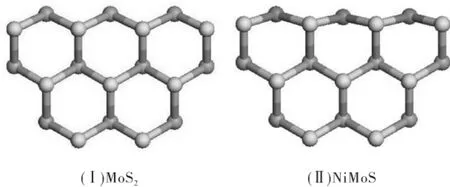
图2 MoS2催化剂的团簇结构模型(Ⅰ)和NiMoS催化剂的团簇结构模型(Ⅱ)Fig.2 Structure model of crystal
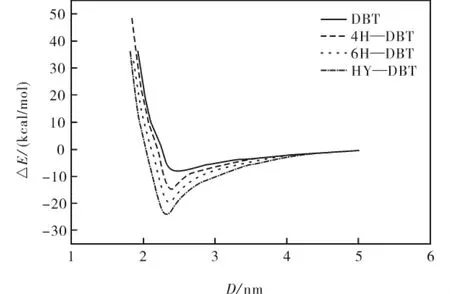
图3 化合物与Ni MoS催化剂垂直吸附能与Ni-S距离关系Fig.3 The trend of adsorption energy for the perpendicular adsorption of compounds on Ni MoS catalyst at different Ni-S distance
2 结果与讨论
2.1 NiMoS催化剂表面垂直吸附
DBT及其加氢脱硫过程中的含硫化合物与催化剂表面的吸附状态是研究DBT加氢脱硫反应机理的基础.对此存在几种不同的观点:一种认为是通过含硫组分上S与催化剂表面原子端连吸附[14],称作垂直吸附;另一种则认为是各含硫组分通过芳香环上的π电子平躺吸附于催化剂表面[15],称作平行吸附;同时也有研究者认为两种吸附状态同时存在[16].因此本实验考察了DBT、4H—DBT、6H—DBT和 HY—DBT四种含硫化合物在Ni MoS催化剂表面不同吸附情况.对于NiMoS催化剂表面垂直吸附状态,选取化合物中硫原子与催化剂表面镍原子间的Ni—S距离D来表示化合物与NiMoS催化剂表面的距离.
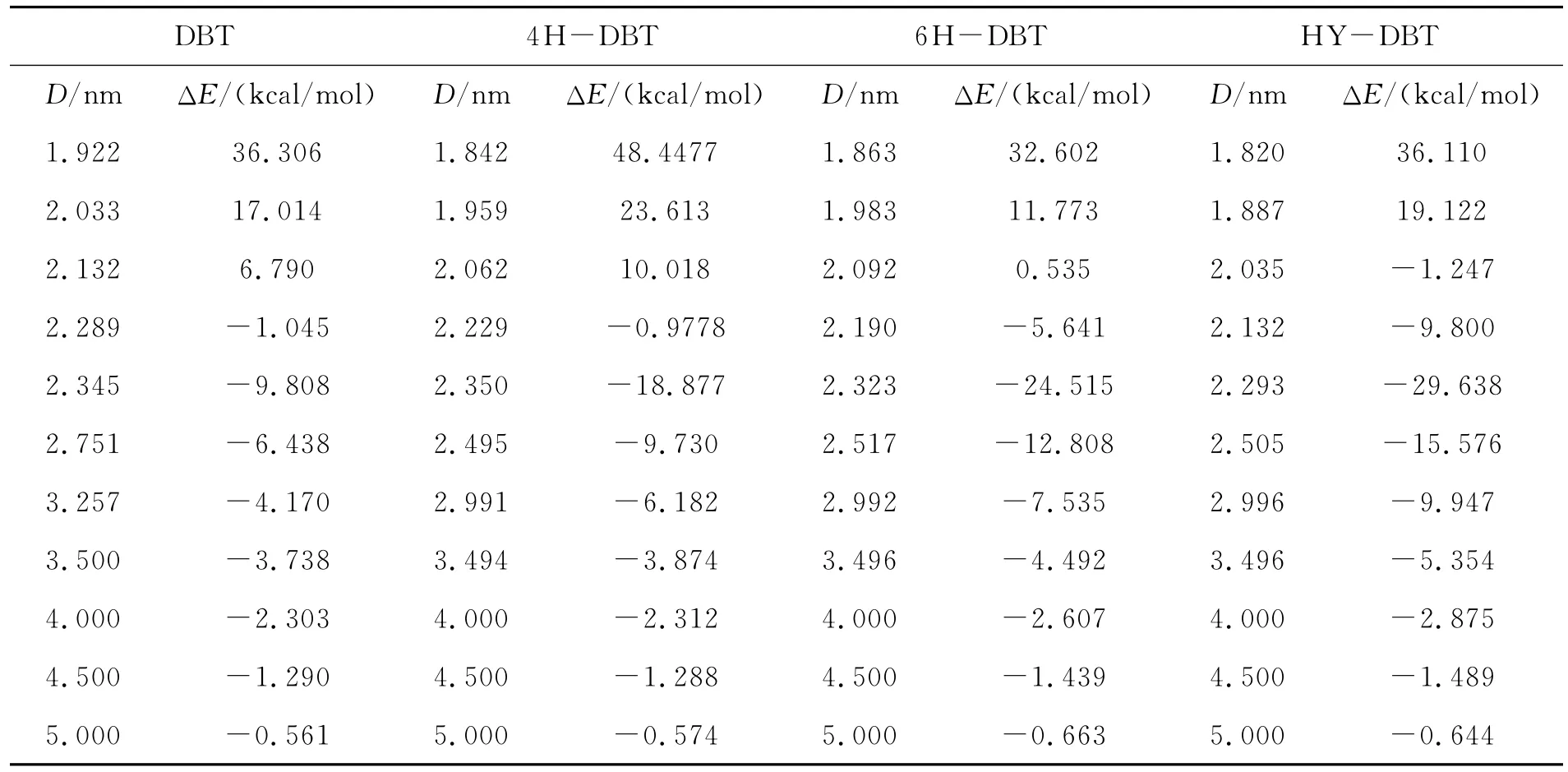
表1 化合物与NiMoS催化剂在不同Ni—S距离的垂直吸附能Table 1 Adsorption energy for the perpendicular adsorption of compounds on Ni MoS catalyst at different Ni—S distance
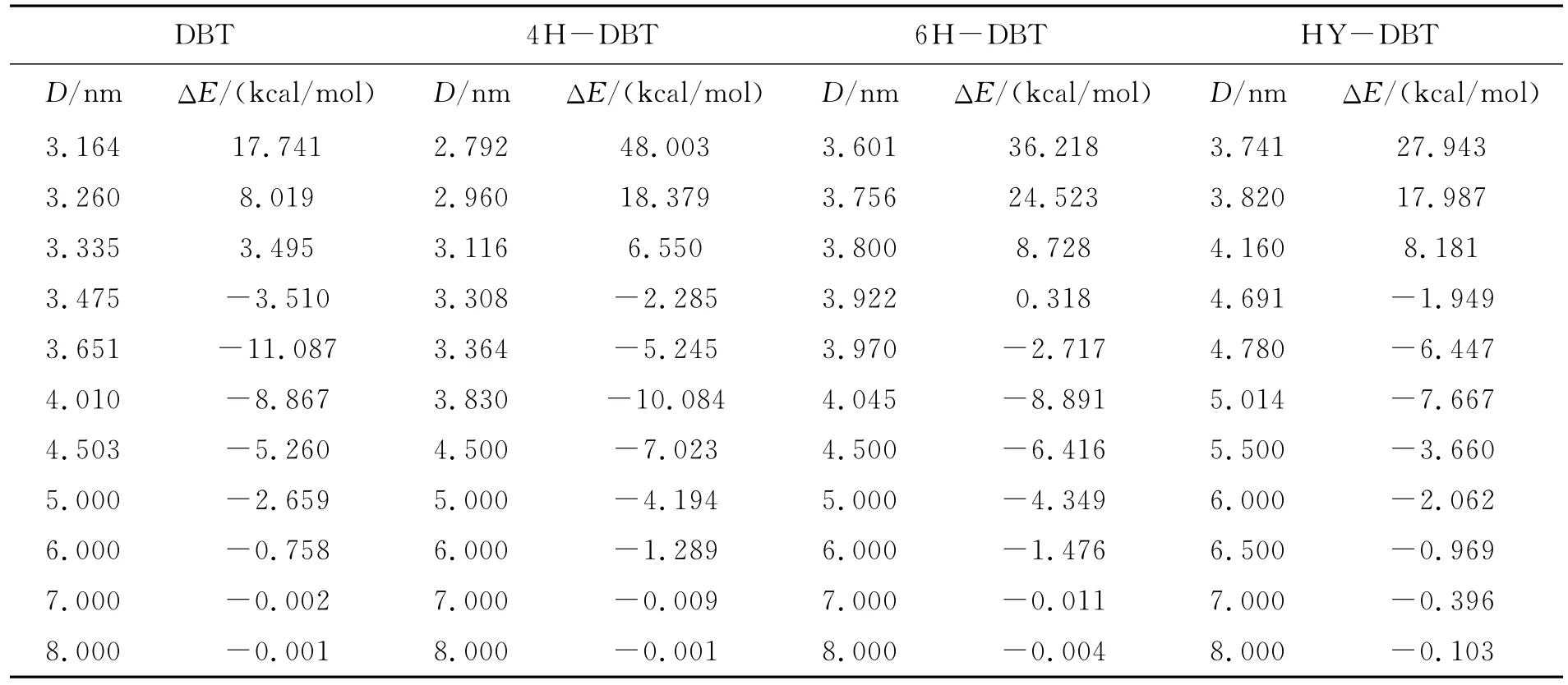
表2 化合物与NiMoS催化剂在不同Ni—S距离的平行吸附能Table 2 Adsorption energy for the flat adsorption of compounds on Ni MoS catalyst at different Ni—S distance

图4 含硫化合物在Ni MoS催化剂表面垂直吸附构型Fig.4 The perpendicular configuration of each sulfur compounds on NiMoS catalyst
表1列出了DBT、4H—DBT、6H—DBT和HY—DBT四种物质垂直吸附于Ni MoS催化剂表面时的吸附距离与吸附能.从表1可知,当S—Ni原子间距离即吸附距离为分别为2.345、2.350、2.323、2.293 nm 时,DBT、4 H—DBT、6 H—DBT、HY—DBT在Ni MoS催化剂Ni表面垂直吸附吸附能分别为-9.808、-18.877、-24.515、-29.638 kcal/mol,此时各吸附体系形成稳定吸附构型(图4).
对Ni MoS催化剂表面垂直吸附研究发现,DBT的各加氢含硫衍生物较DBT有着更高的吸附能.对于含硫物质的垂直吸附,其吸附能的大小主要取决于各含硫物质上硫原子与催化剂吸附表面间结合强度,本文则表征为Ni—S键结合强度.当前有着类似的研究报道,例如 Ma、Schobert[17-18]在垂直吸附构象的的报道中,发现加氢的噻吩和苯并噻吩的化合物吸附能都要高于噻吩和苯并噻吩,此结论与本实验对DBT的研究结果相一致.其次实验研究发现,加氢后噻吩化合物较噻吩有更高的氢化活性,此实验说明加氢后的化合物与催化剂之间有着更强的结合强度[19-20].本研究结果与 Yang、Fairbridge[6]等人的研究结果比较发现,当用Ni取代Mo后,各化合物于催化剂表面垂直吸附能较未取代之前有所降低,同时本结果与Orita[21]等人在通过密度泛函理论计算噻吩在过渡金属掺杂MoS2催化剂上的吸附结果较为一致.
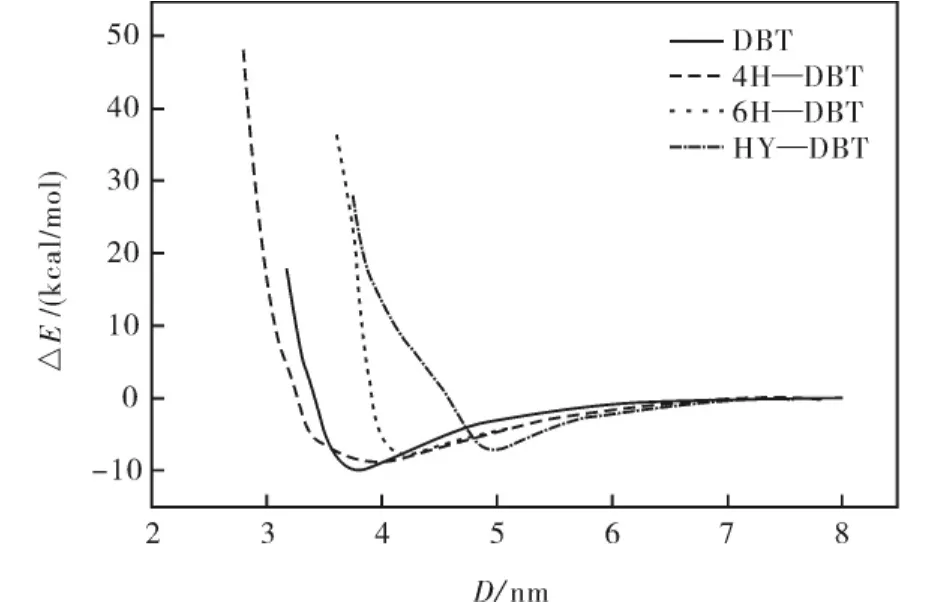
图5 化合物与NiMoS催化剂平行吸附能与Ni-S距离关系Fig.5 The trend of adsorption energy for the flat adsorption of compounds on Ni MoS catalyst at different Ni-S distance
2.2 Ni MoS催化剂表面平行吸附
平行吸附研究是将化合物平行于NiMoS催化剂表面的吸附形式.当DBT、4H—DBT、6H—DBT和HY—DBT四种化合物平行吸附于NiMoS表面的吸附距离与吸附能见表2.平行吸附时各含硫化合物吸附能与吸附距离关系见图5.从表2可知,当吸附距离分别为3.654、3.830、4.045和5.014 nm时,各含硫物质在NiMoS催化剂表面平面吸附吸附能分别为-11.807、-10.804、-8.891和-7.667 kcal/mol.此时各体系稳定吸附构型如图6所示.
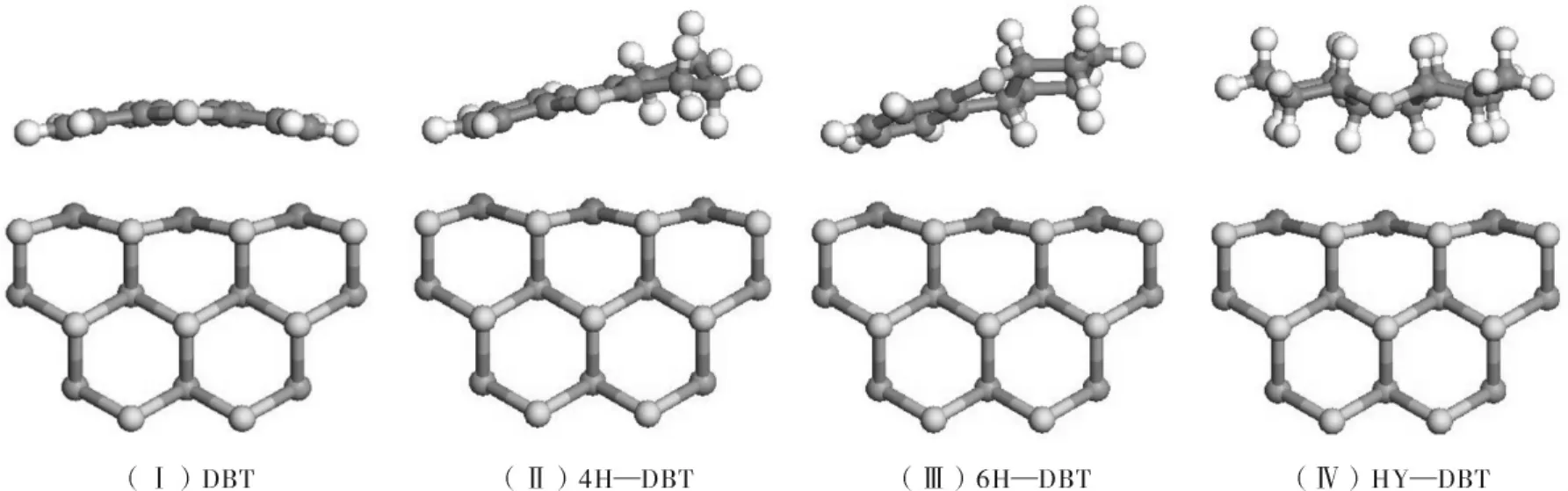
图6 含硫化合物在Ni MoS催化剂表面平行吸附构型Fig.6 The flat configuration of each sulfur compounds on Ni MoS catalyst
在DBT等平行吸附时,各含硫化合物在NiMoS催化剂表面的吸附能随着加氢过程中氢原子数增加而减小.对于DBT等物质在催化剂表面的平行吸附主要是表现为噻吩环的π键电荷吸附于催化剂表面,随着氢原子数增加,各含硫化合物与催化剂表面间的相互作用点逐渐减少,吸附能也随之逐渐减小.Yang、Fairbridge[6]等人通过布局电荷分析发现,随着加氢反应的进行,各含硫物质上硫原子恢复了预先提供给噻吩环π键的部分或全部电荷,使其正电荷逐渐减小,这是导致化合物与催化剂之间相互作用逐渐减少的原因.本次研究结果与 Yang、Fairbridge[6]等人的研究结果对比发现,DBT等含硫化合物在Ni元素掺杂催化剂上平面吸附时,随着加氢过程的进行,各化合物的吸附能比未掺杂之前都有一定程度的降低,表明Ni对加氢脱硫活性影响降低,对此有待进一步研究.
3 总 结
本研究采用密度泛函理论研究了DBT及其加氢脱硫过程中的含硫化合物与Ni MoS催化剂的吸附形式、吸附构型和吸附能,研究结果表明:
a.DBT、4H—DBT、6H—DBT和 HY—DBT垂直吸附于NiMoS催化剂表面时,随着加氢程度的加深更易吸附于催化剂表面,且其稳定吸附构型的吸附能也逐渐增大.而当它们以平行吸附时,随着加氢程度的加深吸附能呈逐渐减小的趋势.
b.DBT在NiMoS上垂直吸附吸附能和平行吸附吸附能较为接近,表明DBT在Ni MoS催化剂表面上垂直吸附与平面吸附可能同时存在.而对于其加氢含硫衍生物而言,更易在Ni MoS催化剂表面形成垂直吸附.
c.DBT、4 H—DBT、6 H—DBT和 HY—DBT在Ni MoS催化剂上吸附能较MoS2催化剂更低.
致谢
感谢国家自然科学基金委员会和湖北省教育厅重点项目组对本课题的资助.
[1]钱松.世界原油质量及我国面临的挑战[J].中国石油和化工,2005,(6):45-50.
[2]王天普.石油化工清洁生产与环境保护技术进展[M].北京:中国石油出版社,2006:3-5.
[3]徐永强,赵瑞玉,商红岩,等.二苯并噻吩和4-甲基二苯并噻吩在 Mo和Co Mo/γ-Al2O3催化剂上加氢脱硫反应机理[J].石油学报(石油加工),2003,19(5):14-21.
[4]Wang A,Wang Y,Kabe T,et al.Hydrodesulfurization of Dibenzothiophene over Siliceous MCM-41-Supported Catalysts:I.Sulfided Co-Mo Catalysts[J].J Catal,2001,199:19-29.
[5]Nag N K,Sapre A V,Brodefick D H,et al.Hydrodesulfurization of polycyclic aromaticscatalyzed by sulfided Co-Mo/Al2O3:The relative reactivities [J].J Catal,1979,57:509-512.
[6]Yang H,Fairbridge C,Ring Z.Adsorption of Dibenzothiophene Derivatives over a MoS2Nanocluster-A D ensity Functional Theory Study of Structure-Reactivity Relations[J].Energy Fuels,2003,17:387-398.
[7]Grange P,Vanhaeren X,Hydrotreating catalysts,an old story with new challenges[J].Catal Today,1997,36(4):375-391.
[8]Schweiger H ,Raybaud P,Toulboat H.Promoted sensitive shapes of co(ni)mos nanocatalysts in sulforeductive conditions [J].J Catal,2002,212(1):33-38.
[9]Sun M,Nelson A E,Adjaye J.On the incorporation of nickel and cobalt into MoS2-edge structures[J].J Catal,2004,226(1):32-40.
[10]曹斌,高金森,徐春明.分子模拟技术在石油相关领域的应用[J].化学进展,2004,16(2):291-298.
[11]居沈贵,曾永平,姚虎卿,等.吸附脱硫及分子模拟应用的研究进展[J].现代化工,2005,25(7):11-13.
[12]石灵娟,周涵,代振宇.几种典型硫化物在 MoS2晶面上的吸附形式研究[J].计算机与应用化学,2004,21(3):501-504.
[13]叶天旭,徐永强,张予辉,等.Co/MoS2催化剂加氢脱硫活性的量子化学研究[J].石油大学学报:自然科学版,2005,29(4):51-57.
[14]Kahe T,Qian W,Ishihara A.Mechanism of hydrodesulfurization of hydrogenation on Co-Mo/Al2O3and Co/Al2O3catalyst by the use of radioisotope35S tracer[J].J Catal,1993,143:239-248.
[15]Michaud P,Lemberton J L,Perot G.Hydrosulfurization of dibenzothiophene and 4,6-dimethyldibenzothiophene:Effect of an acid component on the activity of a sulfided Ni Mo on adumina catalyst[J].Appl Catal A,1998,169:343-353.
[16]Nicholson D E.Identification of Adsorption Species by Infrared Spectrometry:Thiophene-Cobalt Moly bdate-Molybdenum Sulfide System [J]. Anal Chem,1962,34(3):370-374.
[17]Ma X,Schobert H H.Molecular simulation on hydrodesulfurization of thiophenic compounds over MoS2using ZINDO [J].J Catal,2000,160:409-427.
[18]Ma X,Schobert H H.Hydrodesulfurization of thiophenic compounds on MoS2:A computational Study Using Zindo [J].Preper Div Fuel Chem ACS.1997,42(3):657-661.
[19]Whitehurst D,Isoda T,Mochida I.Present State of the Art and Future Challenges in the Hydrodesulfurization of Polyaromatic Sulfur Compounds[J].J Catal,1998,42:345-471.
[20]Devanneaux J,Maurin J.Hydrodesulfurization and hydrogenation of thiophenic compounds on a Co-Mo/Al/sub 2/O/sub 3/catalyst.[J].J Catal,1981,69:202-205.
[21]Orita H,Uchida K,Itoh N.A volcano-type relationship between the energy of thiophene on promoted MoS2cluster-model catalysts and the experimental HDS activity:ab initio density functional study[J].Appl Catal A,2004,258(1):115-120.

