白云边酒优势酵母菌的分离鉴定及其发酵特征分析
刘婷婷,曾 驰,杨团元,宋 瑶,刘超帝,缪礼鸿*
(1.武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;2.湖北白云边酒业股份有限公司,湖北 松滋 434200)
中国传统白酒发酵过程是利用曲及环境中多种微生物的固态混合发酵结果,其中酵母菌在酒醅的发酵过程中起主导作用[1]。白酒发酵过程的酵母菌种类及功能具有多样性,如从清香型白酒固态酿造过程中分离出多株不同种类的酵母菌[2]。各酵母菌株除酒精产生能力有差异外,与酒的风味物质的产生有密切关系[3-6]。本研究在对前期白云边酒酿造过程中的主要细菌及霉菌分析的基础上[7],对白云边酒酿造过程中的优势酵母菌进行了分离鉴定和发酵特征的比较研究,为进一步揭示白云边酒风味物质产生的机理奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
实验菌株:东方伊萨酵母属(Issatchenkia orientalis)CBS5147由以色列技术研究院惠赠;酿酒酵母(Saccharomyces cerevisiae)XG-1为本实验室分离和保存;安琪耐高温酿酒活性干酵母(Saccharomyces cerevisiae)TRADY(以下简称TRADY):购自安琪酵母公司。
1.1.2 实验材料
白云边酒堆积料、酒醅和发酵用高粱原料均由湖北白云边酒业股份有限公司提供。
1.1.3 培养基
酵母菌种子培养基:酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose,YPD)液体培养基:葡萄糖20g,蛋白胨10g,酵母粉10g,水1000mL;配制固体培养基时添加1.5%(w/v)琼脂粉。
酵母菌分离培养基:马丁-孟加拉红培养基[8];曲汁培养基:取新鲜酒醅20g,加水200mL,煮沸30min,过滤,补水至200mL,加入2%蔗糖和1.5%琼脂粉,115℃灭菌30min。
酵母菌酒精发酵培养基:配制淀粉含量为18.00%的高粱淀粉浆,60℃糊化30min,按15U/g淀粉的比例加入液化酶,95℃液化90min,冷却后调pH值至4.5,然后按150U/g淀粉的比例加入糖化酶,65℃糖化30min,制成发酵培养基。
1.1.4 主要试剂
Taq DNA聚合酶和dNTP:购自上海申能博彩公司;DL2000 marker:购自大连宝生物公司;PCR引物NS1、NS4、16S-27F、16S-1492R委托北京奥科生物技术公司合成。
1.2 仪器与设备
ZHJHlll2B洁净工作台:上海智城分析仪器制造有限公司;DNP9028型电热恒温培养箱:上海精宏实验设备有限公司;BIOMETRA PCR仪:德国BIOMETRA公司;UNICO 7200型分光光度计:尤尼柯(上海)仪器有限公司。
1.3 实验方法
1.3.1 酵母菌株分离方法
采用稀释平板分离法[8]。分别取白云边酒醅及发酵堆积料用无菌水浸出,按不同梯度稀释。取不同稀释度的样液各0.1mL分别涂布于不同的分离培养基平板上,37℃培养2d~3d,挑去平板上数量占优势和形态有一定差异的酵母菌落,经进一步划线分离纯化后,对菌株进行编号、保存备用。
1.3.2 酵母菌总菌数的测定方法
采用血球板计数法[8]。
1.3.3 酵母菌对糖的利用
在氮源基础培养基[8]中分别添加不同的糖为唯一碳源,115℃灭菌30min后,接种各菌株37℃培养1d~2d,观察各菌株的生长情况。
1.3.4 DNA的提取
接种酵母菌单菌落于YPD液体培养基,过夜培养后,用Biospin真菌基因组DNA提取试剂盒提取酵母菌基因组DNA,检测后置于-20℃保存备用。
1.3.5 提取DNA的PCR扩增和分子测序
以提取的不同菌株的基因组DNA为模板作PCR分别扩增26S rDNA D1/D2区域,扩增引物为通用引物NS1:5'-GTAGTCATATGCTTGTCTC-3' 和NS4P:5'-CTTCCGTCAATTCCTTTAAG-3',以及通用引物16S-27F:5'-GAGTTTGATCCTGGCTCAG-3'和16S-1492R:5'-ACGGCTACCTTGTTACGACTT-3'。
PCR 扩增体系(25μL):引物NS1/NS4(10μmol/L)各1μL,10×PCR 缓冲液(含20mmol/L的Mg2+)2.5μL,模板DNA(约50ng/mL)1.8/2.8μL,dNTP(10mmol/L)0.5μL,Taq酶(5U/μL)0.2μL,双蒸水18/17μL。
PCR反应程序:94℃预变性5min,94℃变性40s,50℃退火40s,72℃延伸1min,共进行30个循环后,72℃延伸10min。PCR产物经检测为单一条带后送往北京奥科纯化测序。
1.3.6 微生物系统发育树的构建
用校正后的分离菌株的26S rDNA D1/D2区序列,在GenBank核酸序列数据库中进行同源序列搜索,比较分离菌株与已报道的酵母菌株相应序列的相似程度。根据搜索结果,用ClustalX1.8软件进行多序列匹配排列,通过Neighbor-Joining分析方法构建系统进化树。
1.3.7 酵母菌耐高温能力测定
划线接种待测试的酵母菌于YPD平板上,分别置于33℃和42℃培养箱中培养48h,观察酵母菌生长情况。
1.3.8 酵母菌耐酒精能力测定
按2%接种量分别接种预先培养好的酵母菌液于酒精度分别为0、8%vol、10%vol、12%vol和14%vol的YPD液体培养基中,30℃、180r/min摇床培养24h,用分光光度计在波长630nm处测定酵母菌在不同酒精浓度条件下生长达到的细胞浓度(OD值)。
1.3.9 酵母菌的液态酒精发酵方法
将各酵母菌分别接种于YPD种子液培养基中,经120r/min摇床培养12h后,按2%接种量分别接种于酒精发酵培养基中,28℃静置发酵72h后,取发酵醪液测定酵母菌总数、残还原糖及最终pH值,并对各菌株的发酵醪液进行蒸馏取蒸馏液采用气相色谱测定各馏出液的酒精度和乙酸乙酯等其他成分。残还原糖的测定采用3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法[8]。
1.3.10 气相色谱检测发酵醪馏出液的色谱条件
气相色谱条件:Agilent Technologies 7890A;色谱柱(50m×0.25mm×0.25μm);内标物:乙酸正戊酯、叔戊醇、2-乙基丁酸;载体:氮气;色谱检测条件:初始温度为35℃,保持4min;以3℃/min的速率上升至70℃;再以10℃/min的速率上升至200℃,保持15min,总运行时间为43.67min。入口温度为230℃,出口温度为240℃。
2 结果与分析
2.1 酵母菌株的分离鉴定结果
2.1.1 酵母菌对糖的利用及其形态观察结果
从白云边酒堆积发酵料和酒醅中共分离获得7株酵母菌。其中4株酵母菌(编号分别为Z1、Z2、Z3、和Z4)是从3个堆积发酵样品中分离获得的,为37℃培养条件下分离平板上数量占优势的酵母菌;另外3株酵母菌(编号分别为BYB-2、BYB-3和FJ5)是分别从3个出池酒醅中分离获得的,其在分离平板上的菌落数占相对优势,并且菌落形态有一定差异。
7株酵母菌对不同糖类的利用情况结果表明,这7株酵母菌均能利用果糖和蔗糖;均不能利用菊糖、纤维二糖、绵子糖、D-阿拉伯糖、L-阿拉伯糖、L-鼠李糖和L-山梨糖。其中菌株Z4、BYB-2、BYB-3和FJ5能利用D-半乳糖;Z4和BYB-2菌株还能利用D-海藻糖;Z2和Z4菌株能利用D-木糖。除菌株BYB-2的菌落表面湿润外,其他6株酵母菌落表面均较干燥。
2.1.2 酵母菌的分子分类鉴定结果
选取上述分离的7株酵母菌和与其相近的典型菌株(只取已正式定种的酵母菌的标准菌株)的26S rDNA序列进行相似性比较后,构建系统发育树(图2)。其中Z1、Z2、Z3和FJ5菌株与已报道的东方伊萨酵母菌(I.orientalis)的同源性为99%,可归为该种;Z4、BYB-2和BYB-3分别与热带假丝酵母(C.tropicalis)、酿酒酵母(S.cerevisiae)和毕赤酵母(P.galeiformis)的同源性均为99%,可以分别归为相对应的种。

图1 基于26S rDNA D1/D2区序列采用邻接法构酵母菌相关菌株系统发育树Fig.1 Neighbor-joining tree constructed showing the phylogenetic relationships among the isolated yeast strains and other related strains based on 26S rDNA D1/D2 region sequence
2.2 酵母菌酒精发酵结果
采用高粱为原料,各酵母菌株酒精发酵结果见表1。

表1 酵母菌酒精发酵结果Table 1 Alcoholic fermentation results of different yeast strains
由表1可知,菌株BYB-2的发酵酒精度最高,达到10.0%vol,与菌株TRADY酒精发酵能力相近,与其他非酿酒酵母菌株相比,这2株酿酒酵母成熟发酵醪的残还原糖含量也最低。菌株BYB-3的发酵酒精度最低,仅为3.8%vol,4株东方伊萨酵母菌株(Z1、Z2、Z4和FJ5)发酵的酒精度为5%vol左右。表明从白云边酒醅中分离的7株酵母菌产酒精能力最强的为酿酒酵母,其他非酿酒酵母仍有一定的产酒精能力。
2.3 酵母菌耐高温能力和耐酒精能力结果
2.3.1 各酵母菌的耐高温能力测定结果
不同温度条件下的培养结果表明,7株酵母菌在33℃条件下生长均很好;42℃条件下东方伊萨酵母菌Z1、Z2、Z3和FJ5,热带假丝酵母Z4和毕赤酵母BYB-3的生长几乎不受影响,长势优于东方伊萨酵母标准菌株CBS5147,但酿酒酵母TRADY和BYB-2菌株生长受到明显抑制。

表2 酵母菌耐高温能力Table 2 Growth of different yeast strains at 33℃and 42℃
2.3.2 酵母菌耐酒精能力测定结果
5株酵母菌株(Z1、Z4、FJ5、BYB-2和BYB-3)的耐酒精能力测定结果见图2。东方伊萨酵母菌Z1的耐酒精能力最强,在含不同酒精浓度的培养基中(0%除外)的细胞浓度最大。其次为东方伊萨酵母FJ5和酿酒酵母BYB-2,毕赤酵母BYB-3的耐酒精能力最差。
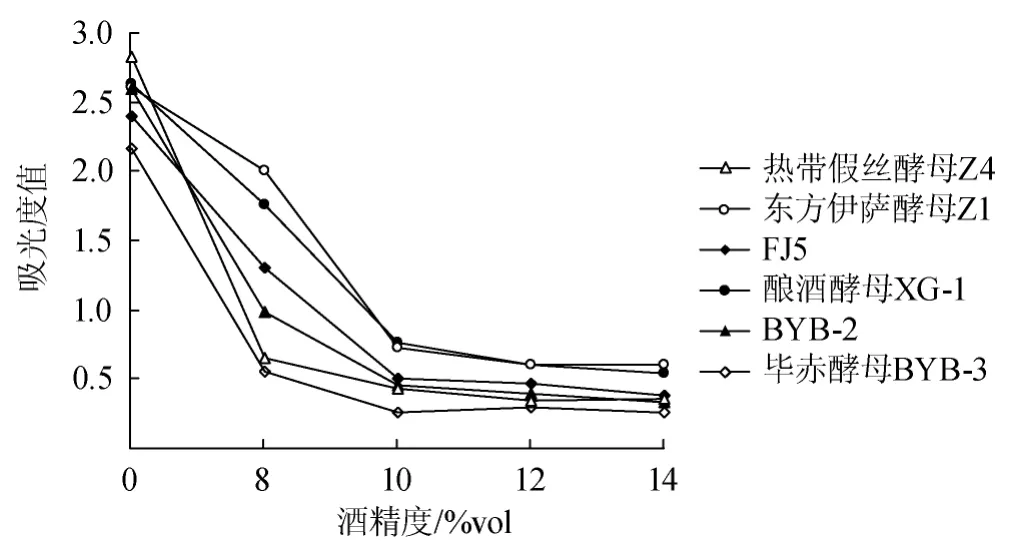
图2 酵母菌耐酒精能力曲线Fig.2 Alcohol tolerance of different yeast strains
2.4 酵母菌株酒精发酵产物分析
酵母菌酒精发酵产物的气相色谱分析结果见表3。3株酿酒酵母发酵醪的酒精度最高,其余5株非酿酒酵母菌发酵醪的酒精度以热带假丝酵母Z4最高,为(6.5±0.3)%vol,其次是东方伊萨酵母菌Z1,为(5.2±0.1)%vol。乙酸乙酯产量最高的菌株分别为从白云边酒醅和堆积料中分离的2株东方伊萨酵母Z1和FJ5,平均含量达204.19mg/L,比所测试的3株酿酒酵母乙酸乙酯平均含量8.43mg/L高23倍,也明显高于其标准菌株CBS5147(116.66 mg/L),另外2株东方伊萨酵母Z2和Z3产乙酸乙酯的能力与Z1菌株相近。其他2株非酿酒酵母C.tropicalisZ4 和P.galeiformisBYB-3酒精发酵产物中乙酸乙酯的含量比酿酒酵母更低,由此可以推断,东方伊萨酵母是白云边酒中乙酸乙酯的主要产生菌。
分析结果表明,3株S.cerevisiae菌株的异戊醇和正丙醇平均含量分别为264.91mg/L和22.81mg/L,比3株I.orientalis平均含量(117.89mg/L和10.49mg/L)均高1倍以上。Z1菌株酒精发酵产物中丁酸含量只有16.1mg/L,比CBS5147(424.57mg/L)和FJ5(749.23mg/L)菌株丁酸含量低很多,而菌株Z2和Z3的酒精发酵产物中丁酸含量分别为56.80mg/L和249.56mg/L(Z2、Z3菌株其他成分的分析结果与Z1相似,数据未列出),结果表明,不同的I.orientalis菌株产丁酸的能力差异较大。Pichia.sp.BYB-3菌株的丁酸含量更高,达到1253.65mg/L,比3株S.cerevisiae平均含量高约24倍。对不同酵母菌株酒精发酵产物分析结果表明,同种酵母菌不同菌株的酒精发酵某些风味成分含量具有很高的相似性和稳定性,可作为酵母菌株分类鉴定的重要参考依据。

表3 各酵母菌株酒精发酵样品气相色谱分析结果Table 3 Gas chromatography results of alcohol fermentation by different yeast strains
3 讨论
本研究从白云边酒高温堆积料中仅分离到耐热的东方伊萨酵母和热带假丝酵母,可以推断东方伊萨酵母是白云边酒高温堆积过程中的优势酵母菌,这一结果与白云边酒采用高温制曲和高温堆积发酵生产工艺相一致。有研究报道表明,汾酒中占优势的酵母菌为伊萨酵母属(Issatchenkia)[9]。耐高温的东方伊萨酵母出现在不同品牌的中国白酒酿造过程中并占优势,可能与中国传统白酒具有某些相似的发酵工艺有关。从白云边酒成熟的酒醅中除分离获得I.orientalis外,还分离到S.cerevisiae,C.tropicalis等多个属的酵母菌株,表明有多种酵母菌参入了白云边酒的酿造过程。
东方伊萨酵母是一种能够在高温条件下生长并连续发酵产生乙醇的非酿酒酵母菌[10],其耐受性好,是一种潜在的木质纤维素酒精发酵菌种[11]。除在中国白酒中的存在外,其广泛存在于葡萄表面及葡萄酒酒酿造体系中[12-13]。这些研究大多集中在对微生物的多样性的研究,但对东方伊萨酵母在中国白酒发酵过程的生理功能知之甚少。
本研究报道了从中国传统白酒发酵过程中分离到I.orentalis菌株、并确定该菌株是堆积发酵过程中的优势菌株。酵母菌纯种酒精发酵试验结果显示,I.orentalis具有一定的酒精发酵能力,其产乙酸乙酯能力比酿酒酵母高20倍以上,而产异戊醇和正丙醇能力比酿酒酵母低2~3倍。有研究表明,白酒中的乙酸乙酯主要产生于酒醅的堆积发酵过程[14-15],因此,可以推断I.orentalis可能是白云边酒中乙酸乙酯的主要产生菌。而以前白酒中产乙酸乙酯等风味物质的研究报道多为Hanseniaspora和Pichia属的酵母菌。这一研究结果也为中国传统白酒风味物质的产生给出了一种可能的解释,即中国传统白酒酯含量高、高级醇含量低的主要原因是由于其独特的发酵工艺,使I.orentalis等耐热好、产酯率高的非酿酒酵母在发酵过程中占主导所致。
[1]敞 颜,赵 辉,凌宏志.传统白酒发酵微生物的研究进展[J].食品工业科技,2012(9):425-431.
[2]王 薇,吴 群,徐 岩.清香型白酒固态酿造过程中酵母种群结构和多样性分析[J].微生物学通报,2012(9):1272-1279.
[3]唐 洁,王海燕,徐 岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报,2012(7):921-930.
[4]董士伟,吴兴泉,王德良,等.豉香型白酒中产酯酵母的筛选与应用[J].中国酿造,2012,31(2):125-129.
[5]许 玲,张秋月.几株生香酵母的分离筛选及应用[J].酿酒科技,2010(12):48-54.
[6]沈怡方.白酒中四大乙酯在酿造发酵中形成的探讨[J].酿酒科技,2003(5):28-33.
[7]刘婷婷,张明春,曾 驰,等.白云边酒大曲及小麦原料中主要微生物的分析[J].中国酿造,2010,29(11):32-35.
[8]赵 斌,何绍江.微生物学实验[M].北京:科学出版社,2002.
[9]LI X,MA E,YAN L,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].Int J Food Microbiol,2011,146(1):31-37.
[10]GALLARDO JCM,SOUZA CS,CICARELLI RMB,et al.Enrichment of a continuous culture ofSaccharomyces cerevisiaewith the yeastIssatchenkia orientalisin the production of ethanol at increasing temperatures[J].J Ind Microbiol Biotechnol,2011,38(3):405-414.
[11]KWON YJ,MA AZ,LI Q,et al.Effect of lignocellulosic inhibitory compounds on growth and ethanol fermentation of newly-isolated thermotolerantIssatchenkia orientalis[J].Bioresource Technol,2011,102(17):8099-8104.
[12]CLAVIJO A,CALDERON IL,PANEQUE P.Diversity ofSaccharomycesand non-Saccharomycesyeasts in three red grape varieties cultured in theSerranía de Ronda(Spain) vine-growing region[J].Int J Food Microbiol,2010,143(3):241-245.
[13]LI S,CHENG C,LI Z,et al.Yeast species associated with wine grapes in China[J].Int J Food Microbiol,2010,138(1-2):85-90.
[14]曾 驰,张明春,刘婷婷,等.兼香型白云边酒高温堆积过程主要细菌的分子鉴定[J].中国酿造,2010,29(4):39-41.
[15]宋 瑶,缪礼鸿,高素芹,等.耐高温酒精酵母菌株的筛选及发酵能力比较[J].中国酿造,2009,28(5):38-42.

