超排卵周期中卵泡不同反应组钙粘素的表达研究
张峥程 张治芬
●论 著
超排卵周期中卵泡不同反应组钙粘素的表达研究
张峥程 张治芬
目的 研究超排卵周期中卵巢不同反应组患者的卵泡液E-cadherin、N-cadherin、雌二醇、孕酮的表达及相互关系。 方法 对70例因输卵管、男性因素不孕患者行体外受精-胚胎移植,按取卵时卵泡发育数目不同分为低反应组、高反应组及正常反应组。用ELISA法及CL法分别测定各组卵泡液中E-cadherin、N-cadherin、雌二醇、孕酮水平,并作比较分析。 结果 高反应组N-cadherin显著高于正常反应组(P<0.05)。低反应组E-cadherin显著高于正常反应组(P<0.05)。低反应组FSH用量明显高于正常反应组及高反应组(P<0.05),且与E-cadherin呈正相关。高反应组雌二醇水平明显高于其余各组(P<0.05),低反应组孕酮水平明显高于其余各组(P<0.05)。 结论 高反应组患者卵泡群发可能与卵泡局部N-cadherin的高表达有关,而低反应组卵泡发育受阻可能与高E-cadherin水平有关,使卵泡对FSH反应性降低并有黄素化倾向。
钙粘素 卵泡 颗粒细胞 卵泡液 性激素
卵泡发育过程、机制一直是国内外的研究热点。卵泡被募集或被选择形成优势卵泡或闭锁,其具体机制尚不明确。颗粒细胞的增殖、分化、相互作用,颗粒细胞与卵母的关系都借助于细胞粘附,细胞间的相互黏附、信息表达、沟通影响着细胞的相互作用。钙粘素(cadherin)是其中主要黏附分子,但黏附分子在卵泡发育中的作用尚知之甚少。目前,关于cadherin与卵泡发育之间关系的研究主要局限于动物实验,相关研究亦不多。本研究通过观察卵泡不同反应患者cadherin的表达情况,旨在探讨cadherin在卵泡发育中的作用。
1 资料和方法
1.1 一般资料 选取2007-10—2009-05在浙江大学医学院附属妇产科医院因输卵管性不孕或男性因素不孕而行体外受精-胚胎移植(IVF-ET)者70例。根据给予超排卵周期方案后取卵时平均直径>14mm的卵泡数目的不同进行分组,卵泡数≤5个为卵巢低反应组(低反应组),卵泡数6~20个为正常反应组,≥21个为卵巢高反应组(高反应组)。3组患者的一般资料见表1,其年龄及不孕时间的差异均无统计学意义(P>0.05)。

表1 3组患者的一般资料
1.2 超排卵周期方案 所有患者均行基础激素水平测定,包括基础促卵泡激素(bFSH)。常规体外受精或卵胞浆内单精子注射的患者促排卵采用长周期方案,在促排卵周期的前1个月经周期测基础体温,当基础体温上升后第7天,即在黄体高峰期起每天皮内注射短效促性腺激素释放激素类似物(GnRHa),在下1个月经周期第3天始肌注重组FSH促卵泡发育,周期第8天开始行B超下卵泡监测;当最大卵泡平均直径达18mm或有3个卵泡平均直径达16mm时停用FSH,并在停用36h后肌肉注射绒毛膜促性腺激素(HCG)10 000U,36h后行阴道B超下取卵术。记录每例患者的FSH使用剂量。
1.3 标本采集和处理 留取澄清不带血卵泡液(取卵时选择卵泡直径1.8~2.0cm的卵泡)经3 000r/min离心10min后,取上清液-70℃贮存待测。
1.4 卵泡液检测 检测卵泡液上皮型 cadherin(E-cadherin)及神经型cadherin(N-cadherin)水平、雌二醇、孕酮水平。采用酶联免疫分析仪(德国拜尔公司制造)检测E-cadherin、N-cadherin,ELISA试剂盒购自USCN LIFE公司。采用免疫化学发光法测定雌二醇、孕酮均,在全自动免疫分析仪(ACS:180SE,德国拜耳公司),试剂盒由该公司提供。所有标本均为同批检测,具体操作按试剂盒说明书进行,各项质控均符合要求。
1.5 统计学处理 采用SPSSl7.0统计软件,所得数据均以 表示,组间比较采用方差分析,相关关系采用Pearson相关分析。
2 结果
3组患者各项检测指标的比较见表2。
由表2可见,低反应组bFSH明显高于正常反应组、高反应组(P<0.05)。低反应组FSH用量明显高于正常反应组及高反应组(P<0.05),且FSH用量与E-cadherin存在正相关性(P<0.05)。高反应组N-cad-herin显著高于正常反应组及低反应组(P<0.05)。低反应组E-cadherin明显高于正常反应组(P<0.05)。高反应组雌二醇水平明显高于其余各组(P<0.05)。低反应组孕酮水平明显高于其余各组(P<0.05)。
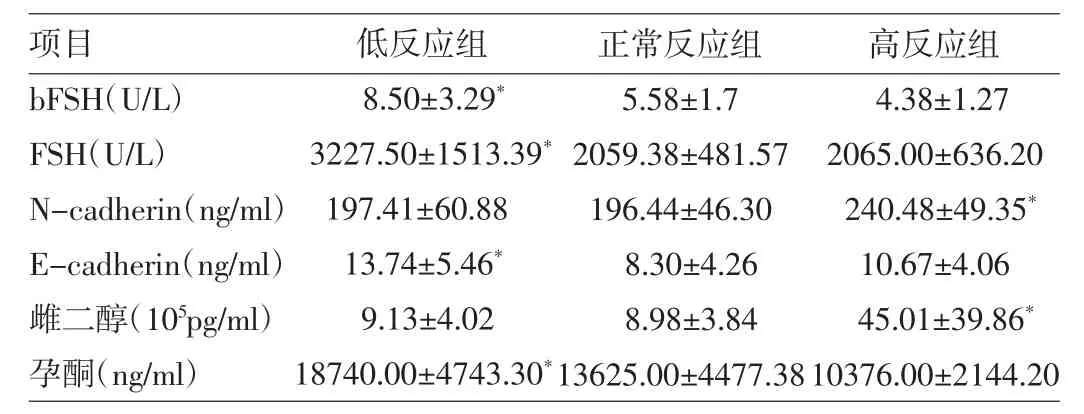
表2 3组患者各项检测指标的比较
3 讨论
黏附分子是位于细胞表面或细胞基质中的糖蛋白,使细胞与细胞间以及细胞与基质间发生黏附,参与细胞的识别、活化和信号传导,细胞增殖与分化、伸展与运动是免疫应答、炎症发生、凝血、肿瘤转移、创伤愈合等一系列重要生理和病理过程的分子基础。不同黏附分子在体内有其独特的组织分布,其表达随细胞生长发育状态的不同而不同。cadherin是细胞黏附分子的一种,至今已鉴定出30种以上,主要有E-cadherin(CD324/CDH1)、N-cadherin(CD325/CDH2)等。卵泡在生理周期发育过程中呈现出不同类型的cadherin的时空表达变化。卵泡颗粒细胞间的相互作用是影响细胞分化、卵泡发育,导致卵泡排卵或选择闭锁的重要因素。
N-cadherin在各卵泡阶段颗粒细胞中均有表达,早、中期黄体均有强烈表达[1]。N-cadherin涉及细胞间黏附和组织形态发生,也参与信号转换,以影响各种细胞功能。N-cadherin胞外区域和成纤维生长因子(bFGF)受体的结构相似(两者含有共同的保守HAV区域),而bFGF能影响原始卵泡向初级卵泡转化。在原始卵泡阶段,卵母细胞分泌碱性bFGF和生长分化因子-9以及骨形态发生蛋白-15等,由此促进颗粒细胞的增殖[2-3]。另外,N-cadherin相互结合启动信号转导级联,经cAMP途径可抑制颗粒细胞凋亡,调控卵泡闭锁,维持、促进了卵泡生长发育[4-5]。同时,N-cadherin介导的细胞接触可使颗粒细胞表面G蛋白配体与G蛋白相关受体结合影响cAMP[6],刺激、激活信号瀑布级联,卵母细胞表面的FGF受体激活以防止生发泡破裂,阻滞减数分裂[7-8]。卵泡的成熟主要受垂体分泌的FSH和LH通过颗粒细胞介导调控,FSH和LH的作用很大程度上取决于cAMP依赖性信号转导,cAMP信号通路参与了卵巢卵泡生长的启动与发育。本研究结果提示,高反应组N-cadherin高于正常反应组及低反应组,可能与N-cadherin升高,通过碱性bFGF系统及第二信使cAMP信号传导系统,激发大量的卵泡启动,对FSH产生应答,诱导众多卵泡迅速发育,造成卵泡过度刺激综合征。由此推测,超促排卵中多囊卵巢综合征(PCOS)大量卵泡的启动发育也可能与之有关。
原始卵泡发育完成后颗粒细胞表达包括FSH、GnRH、糖皮质激素和雌激素等受体,成为对激素具应答能力的初级卵泡,因此激素与卵泡的启动无关。E-cadherin在始基卵泡和早期初级卵泡的卵母细胞和颗粒细胞表达。随着始基卵泡生长发动,E-cadherin首先在卵细胞,随后在颗粒细胞表达消失,cadherin在始基卵泡的表达变化提示E-cadherin可能参与早期卵泡生长始动的调节[1,9]。本研究结果提示,卵泡液E-cadherin在低反应组明显高于正常反应组,低反应组基础促性腺激素水平高于正常反应组及高反应组,卵泡储备功能差,超促排卵中FSH的用量也明显高于其他两组,FSH用量与E-cadherin存在一定正相关。推测可能是高E-cadherin水平使卵泡一直处于早期卵泡状态,抑制了卵泡的发育,表现为对FSH刺激呈现低反应性。导致E-cadherin在低反应组中迟迟不降的原因及机制尚待进一步研究。
Peluso等[10]及Machell等[11]的研究结果显示,未成熟大鼠在促性腺激素治疗下颗粒细胞E和N-cadherin的表达类似于性成熟生殖周期中大鼠。促性腺激素所致的黄素化颗粒细胞N-cadherin表达略有减少;而E-cadherin的表达又始于卵泡黄素化,这两种钙粘素在黄体完全形成时呈显著表达。本研究结果提示,低反应组卵泡液E-cadherin及孕酮水平均明显高于正常反应组、高反应组,孕酮水平的偏高提示卵泡有局部黄素化表现。Luborsky等[12]也发现,在低反应组卵泡液中孕酮显著高于正常反应组,并且其他一些黄素化指标如VEGF、抑制素A、抑制素A/抑制素B的比值也在低反应组显著升高。可见卵巢对促性腺激素低反应与卵泡过早黄素化有关,这可能是低反应组获卵率低的原因之一。但本研究未发现E-cadherin的表达与孕酮的分泌具有直接相关性。Lu等[13]认为,含过熟卵丘复合物OCCC组卵泡液中孕酮水平显著低于成熟、未成熟组,提出排卵前卵泡液中高孕酮水平有助于卵母细胞成熟成长。低反应组中孕酮的变化及意义有待于更多的研究证据。
E-cadherin在体外未成熟大鼠颗粒细胞中的表达受E2的影响[14],而体内雌激素治疗可提高未成熟小鼠卵巢E-cadherin和N-cadherin mRNA的表达。由此推测,激素是调节E-cadherin、N-cadherin介导的细胞相互作用的一个重要的因子[15]。但本研究结果显示,低反应组孕酮与E-cadherin均有显著升高,高反应组雌二醇与N-cadherin均明显升高,但孕酮与E-cadherin、N-cadherin,雌二醇与E-cadherin、N-cadherin间均无明显相关性,其相互作用机制有待于进一步研究。Farookhi等[16]发现,E2与FSH能刺激分离的大鼠颗粒细胞中N-cadherinmRNA的表达,但不影响聚合颗粒细胞N-cadherin mRNA的转录水平。本研究结果提示,尽管卵泡颗粒细胞受不同剂量FSH刺激,但未呈现出N-cadherin表达量的相关性变化,而E-cadherin与FSH呈正相关。也有研究报道,FSH可修正胚胎原始卵泡形成受损相关的N-cadherin mRNA表达减少及E-cadherin mRNA表达增加[17]。这种表达的改变可被绒毛膜促性腺激素逆转。本研究中低反应组FSH用量最大,与各组有显著差别,绒毛膜促性腺激素使用各组剂量无差异而E-cadherin表达增加仍然存在,N-cadherin表达较正常反应组未见减少,可见常规剂量绒毛膜促性腺激素不能逆转E-cadherin、N-cadherin的表达改变。综上所述,卵泡的发育机制复杂,其中颗粒细胞间、颗粒细胞与卵母细胞间的相互关系非常重要,而黏附分子是其中关键之一,进一步研究颗粒细胞间、颗粒细胞与卵母细胞间相互关系及作用机制,探讨卵泡发育机制,对了解病理过程的发生及探索治疗具有极大的临床意义。
[1] Machell N H,Blaschuk O W,Fauokhi R.Developmental expression and distribution of N-and E-cadherin in the rat ovary[J].Biel Reprod,2000,63:797-804.
[2] Manova K,Huang E J,Angeles M,et al.The expression pattern of the c-kit ligand in gonads of mice supports a role for the c-kit receptor in oocyte growth and in proliferation of spermatogonia [J].DevBiol,1993,157(1):85-99.
[3] Tisdall D J.Steroidogeniv factor 1(SF-1)and SP1 are required for regulation of bovine cyp11A gene expression in bovine luterl cells and adrenal Y1 cells[J].JMol Endocrinol,1997,18:127-35.
[4] Sundfeldt K,Piontkewitz Y,Billig H,et al.E-cadherin-catenin complex in the rat ovary:cell-specific expression during folliculogenesis and luteal formation[J].Journal of Reproduction and Fertility.2000,118:375-385.
[5] Peluso J J,Pappalardo A.Progesterone and cell-cell adhesion interact to regulate rat granulosa cell apoptosis[J].Biochem Cell Biol,1995,72:547-551.
[6] Mehlman L M,Saeki Y,Tanakas S,et al.The Gs-linked receptor GPR3 maintains meiotic arrest in mammalian oocytes[J].Science, 2004,306:1947-1950.
[7] Amsterdam A,Kannan K,Givol D,et al.Apoptosis of granulose cells and female infertility in achondroplastic mice expressing mutant fibroblast growth factor receptor 3G374R[J].Molecular Endocrinology,2001,15:1610-1623.
[8] Peluso J J.N-cadherin mediated cell contact inhibits germinal vesicle breakdown in mouse oocytes maintained in vitro[J].Reproduction,2006,131:429-437.
[9] Machell N H,Blaschuk O W,Farookhi R.Expression and localization of P-,K-,and OB-cadherin in the prepubertal rat ovary [J].Molecular Reproduction and Development,2002,61:142-154.
[10] Peluso J J,Pappalardo A,Trolice M P.N-cadherin-mediated cell contact inhibits granulosa cell apoptosis in a progesterone-independent manner[J].Endocrinology 1996,137:1196-1203.
[11] Machell N H,Farookhi R.E-and N-cadherin expression and distribution during luteinization in the rat ovary[J].Reproduction, 2003,125:791-800.
[12] Luborsky J L,Thiruppathi P,Rivnay B,et al.Evidence for different aetiologies of low estradiol response to FSH:age-related luteinization of follicles or presence of ovarian autoantibodies [J].Hum Reprod,2002,10(7):2641-2649.
[13] Lu Xiu'e,Zhou Fuzhen,Huang Hefeng.The Relationship between Steroid Hormone Levels in Follicular fluid and Development of Human Ooocy during in Vitro Fertilization and Embryo Transfer [J].Journal of Zhejiang University(Medical Sciences),2000,29 (5):199-202.
[14] MacCalman C D,Farookhi R,Blaschuk O W.Estradiol regulates E-cadherin mRNA levels in the surface epithelium of the mouse ovary[J].Clin Exp Metastasis,1994,12(4):276-282.
[15] MacCalman C D,Farookhi R,Blaschuk O W.Estradiol regulates N-cadherin mRNA levels in the mouse ovary[J].Dev Genet, 1995,16(1):20-24.
[16] Farookhi R,Geng C S,Mac Calnan CD,et al.Hormonal regulation of N-cadherin mRNA levels in rat granulose cells[J].Ann NYAcad sci,1997,17:165-172.
[17] Wang C,Roy S K.Expression of E-Cadherin and N-Cadherin in perinatal hamster ovary:possible involvement in primordial follicle formation and regulation by follicle-stimulating hormone[J]. Endocrinology,2010,151(5):2319-2330.
The expression of cadherin in various follicles reactive groups during superovulation cycle
ZHANG Zhengcheng,ZHANG Zhifen.Wom-
en's Hospital School of Medicine Zhejiang University,Hangzhou 310006,China
【 Abstract】Objective To investigate the levels of E-cadherin,N-cadherin,estradiol,progesterone in human follicular fluid(FF)and its association with different responses to ovarian stimulation. Methods Enzyme-linked immnosorbent assay(ELISA) was performed to determine the levels of E-cadherin,N-cadherin in FF obtained from follicle aspirates in 70 patients undergoing IVF treatment,and chemiluminescence (CL)method was performed to determine the levels of estradiol,progesterone in FF.According to the response to ovarian stimulation the patients were divided into poor responder group(PRG),high responder group(HRG)and normal responder group(NRG).Results N-cadherin levels in FF of HRG were significantly higher than those in NRG and PRG(P<0.05),E-cadherin levels of PRG were significantly higher than those in NRG、HRG(P<0.05).FSH dosages of PRG were significantly higher than those in NRG and HRG (P<0.05).There was a positive correlation between the FSH dosages and the E-cadherin levels.Estradiol levels in FF of HRG were significant higher than those of other two groups(P<0.05).Progesterone levels of PRG were significantly higher than those in other two groups(P<0.05). Conclusion Increased levels of N-cadherin in FF may be associated with the a large number of follicular development in high response to ovarian stimulation.Increased levels of E-cadherin in FF may be associated with the blocked follicular development in PRG,which suggests that the follicles were not sensitive to the stimulation of FSH and there is a tendency to luteinized with the rising of progesterone.
Cadherin Follicular Granulosa cells Follicular fluid Sex hormones
2012-08-15)
(本文编辑:欧阳卿)
浙江省卫生厅医药卫生科研基金项目(2008A17);浙江省科技厅科技计划项目(2009C33114)
310006 杭州,浙江大学医学院附属妇产科医院(张峥程系解放军第117医院妇产科在职研究生);杭州市第一人民医院妇产科(张治芬)
张治芬,E-mail:zhangzf@zju.edu.cn

