脑胶质瘤中脂肪酸酰胺水解酶的表达及意义
张小林 蒋峰 龚清永 韩丽君 任杰 林志雄 傅瑾
脑胶质瘤中脂肪酸酰胺水解酶的表达及意义
张小林 蒋峰 龚清永 韩丽君 任杰 林志雄 傅瑾
目的 研究内源性大麻素代谢酶脂肪酸酰胺水解酶(FAAH)在脑胶质瘤组织中的表达情况及其与胶质瘤病理级别的关系,探讨其临床意义。 方法 选取首次手术切除并经病理检查证实的脑胶质瘤标本23例,其中WHOⅠ级1例,Ⅱ级7例,Ⅲ级5例,Ⅲ~Ⅳ级2例,Ⅳ级8例。另取8例因颅脑外伤行内减压术切除的正常脑组织作为对照。应用实时荧光定量PCR和高效液相色谱-质谱联用技术分别检测各组织标本中FAAH mRNA和FAAH活性的表达。 结果 FAAH mRNA、FAAH活性在低级别(WHOⅠ~Ⅱ级)和高级别(WHOⅢ~Ⅳ级)脑胶质瘤组织中的表达水平较正常脑组织明显降低,差异有统计学意义(均P<0.01),且随着肿瘤病理级别的增高而降低,与肿瘤的病理分级呈负相关(均P<0.01)。FAAH mRNA与FAAH活性的表达水平呈正相关(P<0.01)。 结论 FAAH可能参与了脑胶质瘤的发生、发展过程,检测FAAH的表达可评价脑胶质瘤的生物学行为,为脑胶质瘤的临床治疗和预后判断提供参考。
大麻素 花生四烯酸乙醇胺 FAAH 胶质瘤
脑胶质瘤是最常见的原发性中枢神经系统肿瘤,据报道约占原发性脑肿瘤的45%~50%,患者的5年生存率仅为12%~15%[1]。近年来,大量研究表明内源性大麻素及其相关药物能在体内外实验中抑制胶质瘤的生长[2]。目前,尚未见脑胶质瘤中内源性大麻素代谢酶脂肪酸酰胺水解酶(FAAH)与肿瘤病理级别关系的研究,本文拟通过实时荧光定量PCR(qRT-PCR)和高效液相色谱-质谱联用技术(HPLC-MS)检测FAAH在脑胶质瘤组织和正常脑组织中的表达,探讨其与肿瘤病理级别的内在联系,为胶质瘤的治疗和预后判断提供参考,也为内源性大麻素系统抗胶质瘤的研究提供理论依据。
1 材料和方法
1.1 组织标本 选择福建医科大学附属第一医院神经外科2007—2008年首次手术切除并经病理检查证实的脑胶质瘤组织标本23例,患者临床资料齐全,术前均未行放疗、化疗和免疫治疗,无其他神经系统疾病史、精神病史和毒物接触史。正常脑组织标本8例作为对照,均为脑外伤行内减压术切除的脑组织。一部分标本用液氮速冻,-80℃冰箱保存;另一部分用甲醛溶液固定,作常规病理组织学和免疫组织化学染色检测。参照2007年WHO神经系统肿瘤分类分级标准,其中Ⅰ级1例,Ⅱ级7例,Ⅲ级5例,Ⅲ~Ⅳ级2例,Ⅳ级8例。本研究将组织标本分为3组:正常脑组织组(8例)、低级别脑胶质瘤组(Ⅰ~Ⅱ级,8例)和高级别脑胶质瘤组(Ⅲ~Ⅳ级,15例)。1.2 qRT-PCR检测 (1)组织总RNA的提取:液氮下研钵粉碎组织块。按照Trizol试剂说明书推荐的步骤操作。按照文献[3]报道的方法检测RNA的浓度、纯度和完整性。(2)cDNA的合成:使用ToYoBo公司的ReverTra Ace qPCR RT Kit进行逆转录反应,所有操作均在冰上完成,总反应体系为10μl。取总RNA1μg,加DEPC水至7μl,65℃加热5min,冰上放置3min,依次加入5xRT Buffer 2μl、RT Enzyme mix 0.5μl、Primer mix 0.5μl,混匀后37℃15min、98℃5min、4℃10min,即得到逆转录产物(cDNA),加灭菌纯水稀释至10倍,-20℃保存备用。⑶rt-PCR:以逆转录反应产物为模板进行扩增反应。PCR所用引物由Oligo 6软件设计,上海生工生物工程有限公司合成。FAAH引物正义为:5′-AAAACCGTGATTGCCCAGTG-3′,反义为:5′-TCCCCAAAGTAGCCCCTGTAA-3′;GAPDH引物正义为:5′GCACCGTCAAGGCTGAGAAC-3′,反义为:5′-TGGTGAAGACGCCAGTGGA-3′。PCR所用试剂为TaKaRa公司的SYBR Premix Ex TaqTMⅡ试剂盒,反应体系为20μl:SYBR Premix Ex TaqTMⅡ 10μl、Forward Primer 0.8μl、Reverse Primer 0.8μl、ROX Reference Dye 0.4μl、cDNA 8μl。置于ABI7300荧光定量PCR仪上按下列条件扩增:95℃30s预变性,95℃5s、60℃31s,扩增40个循环,然后95℃15s、60℃1min、95℃15s。PCR完成后,由ABI 7300 System SDS Software软件进行分析,在调整基线循环和计算域值后,根据标准曲线,计算出待测基因的表达水平,将待测基因表达量/管家基因GAPDH表达量的比值进行统计分析。
1.3 FAAH活性测定 按照BCA法测定组织蛋白的浓度,用80 μg蛋白进行FAAH活性测定。在50 mM Tris-HCL(pH8.0)含有0.05%BSA缓冲液内加入80 μg蛋白、25 M AEA,混合均匀,在37℃下反应30 min。以上反应中加入含有1 nmol 17∶0脂肪酸内标的甲醇终止液200μl终止反应,HPLC-MS分析水解反应产物含量。HPLC-MS条件:Agilent 1200 series型号液相色谱仪,ABI 3200 Q TrapLC/MS/MS system型号质谱仪,Agilent ZOR BAX Eclipse XDB-C18column(4.6mm×150 mm,1.8 μm)型号液相色谱柱,柱温保持在40℃,进样量5μl,流动相A:水(含0.25%醋酸和5 mM醋酸铵),流动相B:甲醇,流速0.6 ml/min,95%B洗脱5 min。质谱为ESI(-)离子源,干燥气为N2,温度350℃,扫描质量范围50~400 amu。结果以17∶0脂肪酸m/z=269作为内标对FAAH水解产物FAAH m/z=303进行定量分析。1.4 统计学处理 采用SPSS13.0统计软件。计量数据以 表示,组间比较采用 Kruskal-Wallis H检验。FAAH mRNA、FAAH活性与脑胶质瘤病理级别的相关性采用Spearman相关分析。FAAH mRNA与FAAH活性的关系采用Pearson相关分析。
2 结果
2.1 FAAH表达水平和FAAH活性在正常脑组织和胶质瘤组织中的表达 见表1。
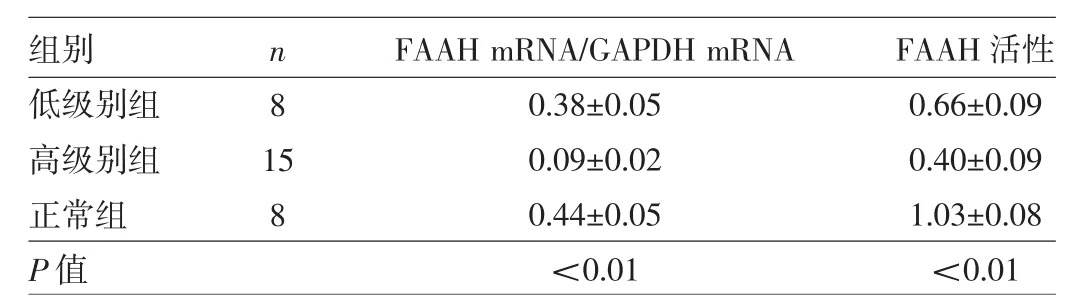
表1 正常脑组织和各级别胶质瘤组织中FAAH表达水平的比较
由表1可见,所有组织中均能检测到FAAH mRNA的表达,在正常脑组织中呈高表达,而在脑胶质瘤组织中呈低表达,差异有统计学意义;并且,FAAH mRNA的表达量与胶质瘤的病理级别呈负相关(r=-0.77,P<0.01)。此外,所有组织中还可检测到FAAH活性,正常脑组织FAAH活性明显高于脑胶质瘤组织,差异也有统计学意义;并且,FAAH活性与胶质瘤的病理级别也呈负相关(r=-0.68,P<0.01)。
2.2 FAAH表达水平与FAAH活性的关系 将每个组织样本的FAAH mRNA/GAPGH mRNA的比值与该组织的FAAH活性进行Pearson相关分析(图1),结果显示,FAAH表达水平与FAAH活性之间具有明显的正相关关系(r=0.598,P<0.01)。
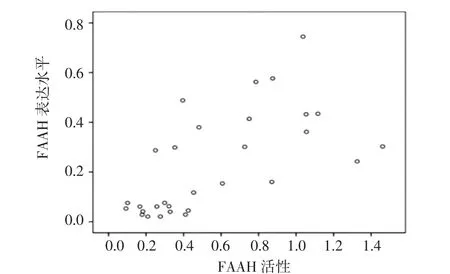
图1 FAAH表达水平与FAAH活性的关系
3 讨论
大麻(Marijuana,植物学名Cannabissativa)其主要的活性成分是Δ9-四氢大麻酚(deltatetrahydrocannabinol,Δ9-THC),既是毒品,又是具有抑制细胞生长、抗炎症、抑制肿瘤生长的治疗药物[4]。大麻素受体是指对大麻类物质如Δ9-THC有应答作用的受体,广泛分布于人体各组织系统。内源性大麻素是指机体内产生的具有与Δ9-THC相似的空间三维结构,并能与大麻素受体相结合而发挥生物学效应的花生四烯酸的衍生物。迄今为止,已经鉴定出5种内源性大麻素[5]:花生四烯酸乙醇胺(anandamide,AEA),2-花生四烯酸甘油(2-arachidonylglycerol,2-AG),2-花生四烯酸甘油醚(2-arachidonylglycerolether,2-AGE),油酰乙醇胺(oleoylethanolamide,OEA),花生四烯酸多巴胺(N-arachidonyldopamine,NADA)。
AEA是第一个被发现并从体内分离出来的内源性大麻素。AEA可通过增加神经酰胺从头合成抑制人胶质瘤U251细胞的增殖并诱导其发生早期凋亡[6];另还可作用于辣椒素受体,增加细胞内钙浓度,激活环氧合酶,释放细胞色素C和激活天冬氨酸蛋白水解酶caspase 3,诱导人神经母细胞瘤和C6胶质瘤细胞的凋亡[7]。Jacobsson等[8]发现,AEA可激活大麻素受体和辣椒素受体,引起胶质瘤细胞的氧化应激;激活钙蛋白酶(calpain),引起细胞内钙超载而抑制C6胶质瘤细胞的增殖。1971年,Folkman首次提出肿瘤的生长和转移是一个依赖血管形成的过程,因此,阻止新生血管的形成成为抑制肿瘤生长的一个基本的治疗策略[9]。AEA通过抑制成纤维细胞生长因子(bFGF)引起的血管内皮细胞的增殖、毛细样管道的形成和基质金属蛋白酶-2(MMP-2)的降解活性来抑制肿瘤新生血管的形成[10]。
哺乳动物体内AEA主要在神经细胞内由FAAH直接降解成花生四烯酸和乙醇胺[11]。FAAH是一种属于丝氨酸水解酶家族的膜酶,由579个氨基酸组成,主要定位于微粒体和线粒体,广泛分布于机体的各个部位,在大脑和肝脏中的浓度较高[12]。迄今为止,关于AEA的水解酶FAAH与肿瘤发生或发展相关的研究甚少。在小鼠的结肠癌模型中,抑制FAAH的活性能增加AEA的含量,通过促进异常细胞的凋亡,从而减少了结肠组织中异常腺窝(早期癌前病变)的形成[13]。Endsley等[14]学者运用组织芯片技术发现,相对于正常的前列腺组织,前列腺癌组织FAAH的表达增加了。更为有趣的是,高表达FAAH蛋白的PC3前列腺癌细胞2-AG的表达增加了,增强了PC3细胞的侵袭和迁移能力;相反的是,通过RNAi技术敲除LNCaP前列腺癌细胞的FAAH基因,则抑制了前列腺癌细胞的侵袭。此外,FAAH的抑制剂CAY10401也能减弱前列腺癌细胞的侵袭力,并能进一步减弱转染了FAAH siRNA的LNCaP细胞的侵袭能力和迁移活动。随后,Thors研究团队[15]对412例前列癌患者的石蜡包埋标本进行免疫组化检测,发现FAAH的免疫反应性(FAAH-IR)与Gleason评分、样本中所含肿瘤细胞的百分数、磷酸化的EGFR含量(前列腺癌预后指标)和人表皮生长因子受体2含量呈正相关;另外,也发现281例处于癌症终末期仅接受姑息治疗患者的FAAH-IR与患者的预后呈现出明显的负相关,多变量Cox比例风险回归分析提示FAAH-IR可作为前列腺癌的预后指标。胰腺癌组织中,低表达FAAN蛋白的患者的中位生存期为10个月,而中等表达和高表达FAAH蛋白的患者的中位生存期为19.1个月,这表明FAAH蛋白的表达水平与患者的预后有关[16]。
本研究的结果显示,脑胶质瘤组织中无论在基因水平还是在蛋白水平均可检测到FAAH的表达,FAAH的表达明显低于正常脑组织,并且FAAH的表达水平与胶质瘤的病理级别呈负相关。由此可以推测,FAAH可能参与了脑胶质瘤的发生、发展过程,检测FAAH的表达可评价脑胶质瘤的生物学行为,为脑胶质瘤的临床治疗和预后判断提供参考。此外,本研究结果为内源性大麻素系统抗胶质瘤的应用提供了一定的理论依据,FAAH基因可能成为脑胶质瘤治疗的一个新药理学靶点,因为目前已有研究发现FAAH抑制剂AA-5-HT能抑制C6胶质瘤细胞的增殖[8]。
[1] Lu C,Shervington A.Chemoresistance in gliomas[J].Mol Cell Biochem,2008,312(1-2):71-80.
[2] PisantiS,Bifulco M.Endocannabinoid system modulation in cancer biology and therapy[J].Pharmacol Res,2009,60(2):107-116.
[3] 张小林,韩丽君,李龙,等.RNA甲醛琼脂糖凝胶电泳的优化及探讨[J].现代生物医学进展,2011,11(2):351-353.
[4] Maccarrone M,Finazzi-Agrò A.Endocannabinoids and their actions[j].Vitam Horm,2002,65:225-255.
[5] 张小林,林志雄.内源性大麻素系统抗胶质瘤的作用机制[J].临床肿瘤学杂志,2011,16(3):274-277.
[6] 马超,袁先厚,江普查,等.花生四烯酸乙醇胺对人胶质瘤U251细胞增殖和凋亡的影响[J].中华实验外科杂志,2007,24(4):468-470.
[7] Maccarrone M,Lorenzon T,Bari M,et al.Anandamide induces apoptosis in human cells via vanilloid receptors.Evidence for a protective role of cannabinoid receptors[J].J Biol Chem,2000, 275(41):31938-31945.
[8] Jacobsson S O,Wallin T,Fowler C J.Inhibition of rat C6 glioma cell proliferation by endogenous and synthetic cannabinoids. Relative involvement of cannabinoid and vanilloid receptors[J]. Pharmacol Exp Ther,2001,299(3):951-959.
[9] Ferrara N,Kerbel R S.Angiogenesis as a therapeutic target[J]. Nature,2005,438(7070):967-974.
[10] Pisanti S,Borselli C,Oliviero O,et al.Antiangiogenic activity of the endocannabinoid anandamide:correlation to its tumorsuppressor efficacy[J].J CellPhysiol,2007,211(2):495-503.
[11] Onnis V,Congiu C,Bj rklund E,et al.Synthesis and evaluation of paracetamol esters as novel fatty acid amide hydrolase inhibitors[J].J Med Chem,2010,53(5):2286-2298.
[12] Ueda N.Endocannabinoid hydrolases[J].Prostaglandins Other Lipid Mediat,2002,68-69:521-534
[13] Izzo A A,Aviello G,Petrosino S,et al.Increased endocannabinoid levels reduce the development of precancerous lesions in the mouse colon[J].J Mol Med,2008,86(1):89-98.
[14] Endsley M P,Thill R,Choudhry I,et al.Expression and function of fatty acid amide hydrolase in prostate cancer[J].Int J Cancer,2008,123(6):1318-1326.
[15] Thors L,Bergh A,Persson E,et al.Fatty acid amide hydrolase in prostate cancer:association with disease severity and outcome,CB1 receptor expression and regulation by IL-4[J].PLoS One,2010,5(8):e12275.
[16] Michalski C W,Oti F E,Erkan M,et al.Cannabinoids in pancreatic cancer:correlation with survival and pain[J].Int J Cancer, 2008,122(4):742-750.
Expression of fatty acid amide hydrolase in brain glioma and its significance
ZHANG Xiaolin,JIANG Feng,GONG Qingyong,et al.
Department of Neurosurgery,Zhoushan Hospital,Zhoushan 316021,China
【 Abstract】Objective To investigate the expression of endocannabinoid metabolic enzyme fatty acid amide hydrolase(FAAH)in human brain glioma tissues and its clinicopathological significance. Methods Twenty-three patients with brain glioma,including one case with grade I,7 grade II,5 grade III,2 grade III~IV and 8 glioblastoma,undergoing surgical excision were enrolled in the study;and 8 samples of normal brain tissues from patients undergoing decompression operation due to cerebral hernia served as controls.qRT-PCR and HPLC-MS were used to detect the mRNA and the activity of FAAH,respectively. Results The expression of mRNA and activity of FAAH was significantly higher in low grade(gradeⅠ~Ⅱ)and high grade (gradeⅢ~Ⅳ)brain glioma than those in the normal brain tissues(P<0.01).The expression of FAAH mRNA was positively correlated with the FAAH Activity,and both were negatively correlated with the pathological grades(P<0.01). Conclusion FAAH may be involved in the occurrence and development of brain glioma;the detection of FAAH expression may be of value in evaluation of biological behavior and prognosis of brain glioma.
Cannabinoid Anandamide FAAH Glioma
2012-03-14)
(本文编辑:沈叔洪)
卫生部科学研究基金-福建省卫生教育联合攻关计划资助项目(WKJ2008-2-45)
316021 浙江省舟山医院、温州医学院附属舟山医院神经外科(张小林、蒋峰);福建医科大学附属第一医院神经外科(龚清永、林志雄);厦门大学医学院药学系(韩丽君、任杰、傅瑾)
傅瑾、林志雄,E-mail:lzx1967@sina.com

