食管鳞癌组织中miR-129与患者预后的关系分析
杨诗舟 凌志强 李沛 董子明 季文豪 毛伟敏
食管鳞癌组织中miR-129与患者预后的关系分析
杨诗舟 凌志强 李沛 董子明 季文豪 毛伟敏
目的 研究miR-129在食管鳞癌组织与癌旁组织中的表达差异及其与肿瘤大小、淋巴结转移、分期、分化程度及患者无病生存期的关系。 方法 提取106例患者食管鳞癌组织和癌旁组织标本中的总RNA,应用real-time PCR检测两者miR-129的表达差异。 结果 106例食管鳞癌标本中,有36例(33.9%)出现了不同程度的miR-129表达上调,另有58例(54.7%)出现了miR-129的表达下调。男性、有饮酒史的患者癌组织中miR-129表达水平明显高于女性、不饮酒者(P<0.05),miR-129相对表达的升高与淋巴结转移、肿瘤分期、分化程度均存在相关性(均P<0.05)。miR-129表达升高的患者无病生存期较表达不高的患者缩短(P<0.01),miR-129相对表达水平、肿瘤分化程度和性别是影响食管鳞癌患者生存的因素(P<0.05)。 结论 miR-129可能参与了食管鳞癌进展,miR-129表达的升高可能提示食管鳞癌患者的不良预后。
食管鳞状细胞癌 miR-129 无病生存期 淋巴结转移
microRNAs(miRNAs)是真核生物中发现的一类内源性的具有调控功能的小分子非编码RNA,其进化保守,大小长约20nt左右。miRNAs通过序列特异性的方式作用于特定靶基因的3′端非编码区(3′untranslated region,3′UTR),由此调节靶基因的蛋白表达,从而发挥其生物学功能。miRNA参与各种各样的调节途径,包括发育、病毒防御、造血过程、器官形成、细胞增殖和凋亡、脂肪代谢等等。最近的研究表明,大部分的miRNAs在基因组上定位于与肿瘤相关的脆性位点,起到类似于抑癌基因或癌基因的功能。本研究通过比较食管鳞癌组织与癌旁组织中miR-129表达水平的差异,探讨其与肿瘤的发展及患者生存预后的关系。
1 对象和方法
1.1 对象 选择2010-01—07在浙江省肿瘤医院就诊的食管癌患者106例,其中男85例,女21例,年龄40~74岁,平均59.7岁。术前未经任何放化疗,排除自身免疫性疾病或严重感染性疾病。食管癌根治术中标本切取后均立即放入液氮中冷冻,即刻移至-80℃冰箱保存。所有标本均经病理证实为食管鳞状细胞癌。癌旁组织为术中切取距肿瘤边缘≥5cm处的肉眼下正常的食管组织。食管癌TNM分期,肿瘤分级均参照国际抗癌联盟(international union against cancer,UICC)2009年第7版食管癌分期标准。Ⅰ、Ⅱ期64例,Ⅲ期42例;伴淋巴结转移67例,无淋巴结转移39例;高、中分化66例,低分化40例。本研究经医院伦理委员会批准,所有患者均签署知情同意书。所有患者均进行电话随访,随访截止时间为2012年10月1日,其中失访12例(失访率11.3%),失访患者在生存分析中以最后1次的有效随访日期作为的截尾值处理。
1.2 试剂和仪器
1.2.1 试剂 RNA提取试剂盒MirNeasy Mini Kit(Qiagen公司),逆转录试剂盒PrimeScriptmiRNA cDNA Synthesis Kit(TaKaRa公司),real time RT-PCR试剂盒SYBR Premix Ex TaqTMⅡ(TaKaRa公司)。real time RT-PCR引物序列如下:下游引物为通用引物,来自PrimeScriptmiRNA cDNA Synthesis Kit,hsa-miR-129-5p引物由上海Invitrogen公司合成,信息如下:5′-CUUUUUGCGGUC UGGGCUUGC-3′(Gene ID:406917),内参基因U6(U6 small nuclear RNA)序列:5′-CGCAAGGATGACACGCA AATTC-3′(NCBI:X07425.1)。
1.2.2 仪器 real time PCR仪(ABI 7500PCR,Applied Biosystems公司)用于PCR扩增,荧光定量和熔解曲线分析。梯度PCR仪(Bio-Rad S1000,Bio-Rad公司)用于逆转录。
1.3 实验方法
1.3.1 总RNA提取 总RNA提取参照MirNeasy Mini Kit说明书。所有提取的样本均经紫外分光光度计测量纯度、浓度及琼脂糖凝胶电泳检验完整度,将光密度值A260/A280>1.8及完整的RNA样本用于逆转录。
1.3.2 逆转录 取合格的总RNA(1μg)进行逆转录合成cDNA。方法和步骤均参照PrimeScriptmiRNA cDNA Synthesis Kit中说明书。
1.3.3 PCR扩增 参照SYBR Premix Ex TaqTMⅡ说明书,PCR扩增的反应体系为20μl,反应过程:激活聚合酶,50℃2min;预变性,95℃1min;继续变性,95℃5s;退火和延伸,60℃34s,共40个循环。熔解曲线的制作过程为95℃15s;60℃1min;85℃15s;再60℃15s。每个样本重复3次,将平均Ct值作为结果。结果处理按照2-ΔΔCT法:首先计算出每个样本的miR-129及内参基因U6的Ct值,ΔCT=Ct(miR-129)-Ct(U6);再按照ΔΔCT=ΔCT(癌组织)-ΔCT(癌旁组织),算出miR-129在癌组织与癌旁组织之间表达的差异,即癌组织中miR-129表达量为正常组织的2-ΔΔCT倍,ΔΔCT<-1,表示表达升高2-ΔΔCT倍;ΔΔCT>1,表示表达降低2-ΔΔCT倍[1]。
1.4 统计学处理 采用SPSS17.0统计软件,计量资料以 表示,各组间率的比较采用χ2检验,并采用Kaplan-Meier法进行单因素生存分析,Cox比例风险模型进行多因素生存分析。
2 结果
2.1 食管鳞癌组织和癌旁组织中miR-129的表达水平 106例食管鳞癌标本中,有36例(33.9%)出现了不同程度的miR-129表达上调,与癌旁组织比较具有统计学差异(P<0.05);另有58例(54.7%)表现出miR-129的表达下调,12例表达无变化。其中,表达上调最高达3297.72倍,下调最低达0.10倍。食管鳞癌组织中miR-129的平均表达量为(129.913±488.331),明显高于癌旁组织(1.061±0.118),两者比较具有统计学差异(P<0.01),见图1-2。
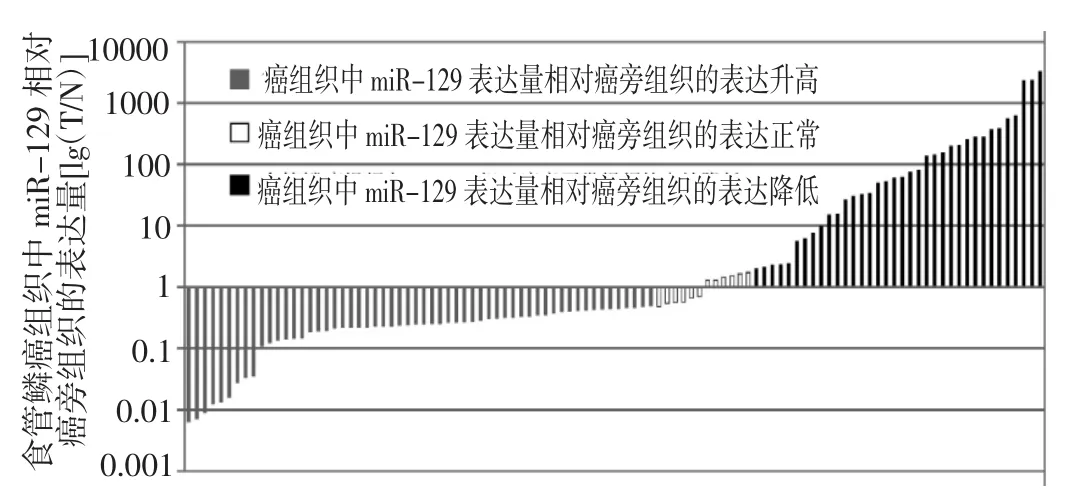
图1 患者食管鳞癌组织中miR-129相对癌旁组织的表达量
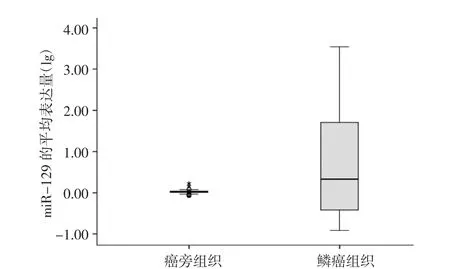
图2 患者食管鳞癌组织与癌旁组织中miR-129平均表达量
2.2 miR-129表达水平与临床病理特征的关系 研究miR-129的表达与患者临床病理特征之间的关系后得出,miR-129相对表达量在不同性别、淋巴结转移、分化程度、肿瘤分期以及有无饮酒史的患者中差异有统计学意义(均P<0.05)。其中,男性或有饮酒史的患者miR-129相对表达量显著高于女性或无饮酒史的患者;中低分化的肿瘤患者的miR-129相对表达量高于高分化患者;Ⅲ期食管鳞癌患者的miR-129相对表达量高于Ⅰ、Ⅱ期患者;伴淋巴结转移的N1~3组患者的miR-129相对表达量高于无淋巴结转移的N0组,见表1。
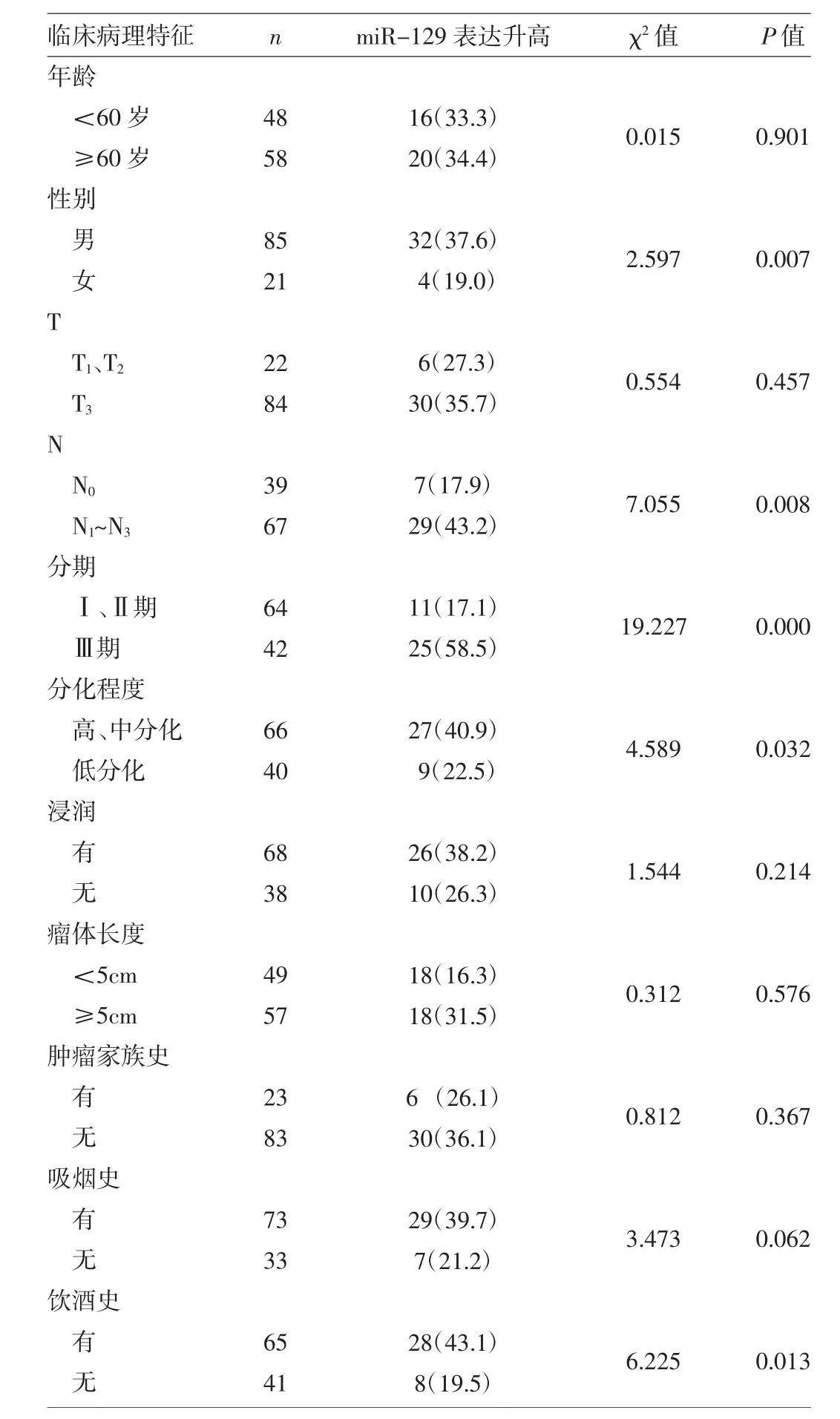
表1 患者miR-129表达水平与临床病理特征的关系[例(%)]
2.3 miR-129表达水平与预后的关系
2.3.1 将106例患者分为miR-129相对表达量未升高和升高两组,利用Kaplan-Meier法比较两组患者的无病生存期,提示miR-129相对表达量未升高的患者较升高的患者有生存优势(P<0.01),见图3。
2.3.2 临床病理特征、生活习惯与生存时间的相关分析 利用Cox回归模型分析临床病理特征及生活习惯吸烟、饮酒对生存时间的影响,提示miR-129的相对表达量、肿瘤的分化程度、性别是影响食管鳞癌患者生存时间的因素,风险系数分别为5.173、0.337、0.280(均P<0.05),说明miR-129相对表达量是影响生存的危险因素,高分化程度和女性是生存的保护因素,见表2。

图3 miR-129相对表达量不同患者的生存曲线
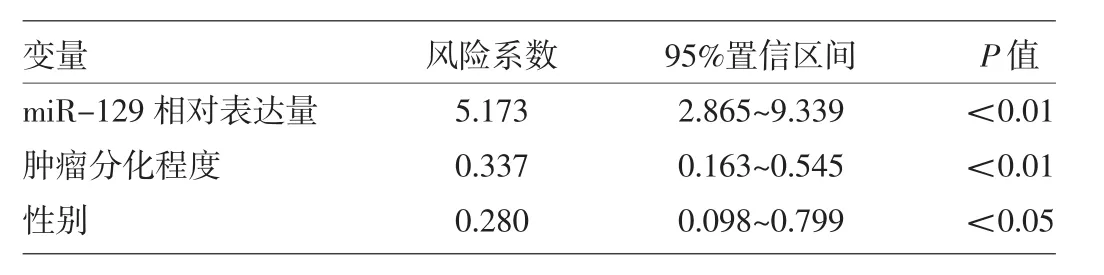
表2 影响106例食管鳞癌患者无病生存期的多因素分析
3 讨论
食管癌在我国恶性肿瘤发病率中排名第6,病死率排名第4[2],且一旦发生即进展迅速,仅14%~21%的食管癌局限于黏膜层(T1),30%~68%的食管癌浸润肌层并转移到淋巴结(T2),50%的食管癌在发现时已有远处转移或已经无法进行手术切除[3-4]。因此,研究与食管癌发生、发展、预后相关的分子对诊断治疗有重要意义。
1993年,在研究蠕虫的基因lin-4时第1次发现了miRNA[5]。通过克隆和生物学信息技术,至今已发现1000多种miRNA,不仅发现miRNA包含了大约3%的蛋白编码基因,还发现其参与许多基因调控网络[6]。近年来,大量研究也表明,miRNA的异常表达、调控可能参与肿瘤的发生、进展、组织侵袭与远处转移[7-10]。如miR-15a和miR-16a表达的减少可引起靶基因抗凋亡因子(B cell lymphoma/leukemia-2,Bcl-2)表达的增加,引起细胞抗凋亡的活性增加,促进成人B细胞慢性淋巴瘤的发生[11-12]。在乳腺癌中,miR-10b起到类癌基因的作用,miR-10b的表达的增加,减少其靶基因(homeoboxD-10,HOXD10)的表达,导致转移相关蛋白(ras homolog family member C,RHOC)表达增加,促进乳腺肿瘤细胞的转移[13]。miRNA与恶性肿瘤的发生、侵袭及远处转移的相关性说明循环miRNA可能是一种肿瘤相关的生物标记物。且有研究表明,miRNA的表达具有明显的组织细胞特异性更进一步提示miRNA可作为预测肿瘤发生,判断肿瘤进展、预后的特异性生物指标[14]。
研究表明,miR-296、miR-143、miR-145、miR-21、miR-205与食管癌的发生有关[15-16],miR-31和miR-142-3p的表达水平与食管鳞癌的分化程度有关[17],miR-200c、miR-194和miR-192的表达可区分不同病理类型的食管癌[15],miR-21的过表达及miR-375在食管癌组织中的表达减少与患者的预后不良有关[16],均说明microRNA在食管癌的发生、发展、预后中起到了不可忽略的作用。
miR-129与多种恶性肿瘤相关,在不同的肿瘤中表达水平各异,所起作用也不同。乳腺癌中miR-129表达的增加可上调E-钙黏蛋白的表达,从而阻碍乳腺癌细胞的迁移运动能力,抑制乳腺癌的发展、转移[18]。膀胱癌细胞中miR-129表达的增加会降低膀胱癌细胞的稳定性,抑制细胞凋亡,促进膀胱癌的进展[19]。miR-129还通过调控转录因子SOX4和乙酰半乳糖氨基转移酶1,抑制肿瘤细胞的转移[19]。
本研究中106例食管鳞癌组织标本中36例的miR-129相对癌旁正常组织的表达量升高,与叶昱坪[20]等的研究结果一致。另外,本研究还发现miR-129相对表达越高的患者肿瘤分化程度越低,更易出现淋巴结转移,肿瘤分期越晚,进一步说明miR-129的表达升高与肿瘤的进展有关。miR-129相对表达水平、肿瘤分化程度、不同性别是影响食管鳞癌患者生存的因素,说明miR-129的表达与食管鳞癌的预后相关。
RNASEN酶参与miRNA从premiRNA剪切形成成熟miRNA的过程,miR-129表达与RNASEN酶的表达呈正相关,RNASEN酶在食管癌组织中表达的上升可促进食管恶性肿瘤的发展、侵袭[21]。miR-129还可通过抑制APC基因和Ras基因的信号传导途径,使APC基因和Ras基因的表达受限,引起体内生物学过程紊乱[22],促进肿瘤发生。也有研究表明,miR-129的靶基因为TAMTA1和EIF2CA,两者都是miRNA转录相关基因,或许miR-129通过调控其他肿瘤相关miRNA的转录,影响肿瘤的发生、发展[23]。miR-129在不同肿瘤中表现出不同的作用,说明miR-129的作用具有肿瘤特异性。
miRNA是一类新兴研究热点,其在肿瘤发生、发展中的作用还需进一步的研究。本研究提示,miR-129可能是一种促进食管鳞癌发展的分子,其表达可能影响着食管鳞癌的发生、进展,同时还与患者的生存预后有关。但是,miR-129参与食管鳞癌发生、发展的具体分子学机制还未清楚,需要进一步的研究验证。
[1] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTMethod [J].Methods,2001,25(4):402-408.
[2] 贺小停,曹秀峰.miRNA与食管癌[J].世界华人消化杂志,2007,15 (19):2133-2137.
[3] Siewert J R,Stein H J,Feith M,et al.Histologic tumor type is an independentprognostic parameterin esophageal cancer: lessons from more than 1,000 consecutive resections at a single center in the Western world[J].Ann Surg,2001,234:360-367.
[4] Collard J M,Otte J B,Fiasse R,et al.Skeletonizing en bloc esophagectomy for cancer[J].Ann Surg,2001,234:25-32.
[5] Lee R C,Feinbaum R L,Ambros V.The C.elegans heterochronic gene encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[6] Wang B,Doench J G,Novina C D.Analysis of microRNA effector functions in vitro[J].Methods,2007,43(2):91-104.
[7] Lawrie C H,Gal S,Dunlop H M,et al.Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-celllymphoma[J].J Haematol,2008,141(5): 672-675.
[8] Jung M,Mollenkopf H J,Grimm C,et al.MicroRNA profiling of clear cell renal cell cancer identifies a robust signature to define renal malignancy[J].J Cell Mol Med,2009,13(9B):3918-3928.
[9] Murakami Y,Yasuda T,Saigo K,et al.Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues[J].Oncogene,2006,25(17):2537-2545.
[10] Ueda T,Volinia S,Okumura H,et al.Relation between microRNA expression and progression and prognosis of gastric cancer:a microRNAexpression analysis[J].Lancet Oncol,2010, 11(2):136-146.
[11] Calin G A,Dumitru C D,Shimizu M,et al.Frequent deletions and down-regulationof micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia[J].Proc NatlAcad Sci, 2002,99(24):15524 15529.
[12] Cimmino A,Calin G A,Fabbri M,et al.miR-15 and miR-16 induce apoptosis by targeting BCL2[J].Proc Natl Acad Sci USA,2005,102(39):13944-13949.
[13] Ma L,Teruya-Feldstein J,Weinberg R A.Tumour invasion and metastasis initiated by microRNA-10b in breast cancer[J]. Nature,2007,449(7163):682-688.
[14] Calin G A,Sevignani C,Dumitru C D,et al.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J].Proc Natl Acad Sci USA,2004,101(9):2999-3004.
[15] Feber A,Xi L,Luketich J D,et al.MicroRNA expression profiles of esophageal cancer[J].J Thorac Cardiovasc Surg,2008 135(2):255-260.
[16] Mathe E A,Nquyen G H,Bowman E D,et al.MicroRNA expression in squamous cell carcinoma and adenocarcinoma of the esophagus:associations with survival[J].Clin Cancer Res,2009, 15:6192-6200.
[17] Lin R J,Xiao D W,Liao L D,et al.MiR-142-3p as a potential prognostic biomarker for esophageal squamous cell carcinoma[J].J Surg Oncol,2012,105(2):175-182.
[18] Wang Q Y,Tang J,Zhou C X,et al.The down-regulation of mir-129 in breast cancer and its effect on breast cancer migration and motility[J].Sheng Li Xue Bao,2012,64(4):403-411.
[19] Dyrskjot L,Ostenfeld M S,Bramsen J B,et al.Genomic profiling of microRNAs in bladder cancer:mir-129 is associated with poor outcome and promotes cell death in vitro[J].Cancer Res,2009,69(11):4851-4860.
[20] 叶昱坪,刘真真,董子明.miR-129的表达与食管鳞癌发生发展的关系[J].医学论坛杂志,2011,32(10):18-21.
[21] Sugito N,Ishiguro H,Kuwabara Y,et al.RNASEN regulates cell proliferation and affects survival in esophageal cancer patients[J].Clin Cancer Res,2006,12(24):7322-7328.
[22] Senda T,Iizuka-Kogo A,Onouchi T,et al.Adenomatous polyposis coli(APC)plays multiple roles in the intestinal and colorectal epithelia[J].Med Mol Morphol,2007,40:68-81.
[23] Liao R,Sun J,Zhang L,et al.MicroRNAs play a role in the development of human hematopoietic stem cells[J].J Cell Biochem,2008,104:805-817.
The relationship between miR-129 and prognosis for patients with esophageal squamous cell carcinoma
YANG Shizhou,LING
Zhiqiang,LI Pei,et al.School of the First Clinical Medical Sciences,Wenzhou Medical College,Wenzhou 325000,China
【 Abstract】Objective To investigate the expression of miR-129 and its correlation with the prognosis of patients with esophageal squamous cell carcinoma(ESCC). Methods Total RNA was extracted from tissue specimens of 106 cases of ESCC. Real-time RT-PCR was applied to detect the expression of miR-129 in primary ESCC tissues and normal esophageal tissues. Results High-expression and low-expression of miR-129 was detected in 36(33.9%),and 58(54.7%)ESCC samples,respectively.The expression levels of miR-129 in males,alcohol user were higher than those in females and non drinkers(P<0.05).The high-expression of miR-129 was significantly correlated with regional lymph node involvement,differentiation and disease stage (P<0.05).The disease-free survival in patients with high expression of miR-129 was shorter than that in patients with low expression. Conclusion Our findings suggest that miR-129 may be involved in the progression of ESCC and prognosis of patients.
ESCC miR-129 DFS Regional lymph node involvement
2012-10-11)
(本文编辑:胥昀)
卫生部科研基金(WKJ2010-2-004);浙江省自然基金项目(Y2091110);浙江省重大科技专项计划项目(2011C13039-1)
325000 温州医学院第一临床医学院(杨诗舟、毛伟敏、季文豪,杨诗舟系硕士研究生,现在浙江省肿瘤医院实习,毛伟敏系温州医学院硕士生导师);浙江省肿瘤医院、浙江省肿瘤研究所、浙江省胸部肿瘤(肺、食管)诊治技术研究重点实验室(毛伟敏、凌志强、季文豪);郑州大学医学院病理生理教研室(李沛、董子明)
毛伟敏,E-mail:maowm@163.com

