磁性水滑石负载纳米钯催化剂的制备及催化Suzuki反应的研究*
范艳霞,单雯妍,张智,白雪峰
(黑龙江省科学院石油化学研究院,黑龙江哈尔滨 150040)
磁性水滑石负载纳米钯催化剂的制备及催化Suzuki反应的研究*
范艳霞,单雯妍,张智,白雪峰**
(黑龙江省科学院石油化学研究院,黑龙江哈尔滨 150040)
采用化学沉淀法将磁性基质与二维层状水滑石组装制备了磁性的水滑石,再利用浸渍法和滴加吸附的负载方法制备了磁性水滑石负载纳米钯催化剂。通过XRD、ICP-AES、TG、氢气脉冲吸附等分析手段对磁性催化剂晶型结构、形貌及金属分散度进行了表征,考察了用磁性水滑石负载纳米钯催化剂对不同碱、溶剂、溶剂与水比例、时间、温度、催化剂用量等条件对Suzuki反应的影响。实验结果表明,水滑石赋予磁性后结构并没有改变,仍然具有较高的催化活性。反应的最佳条件为:碳酸钾作碱、溶剂为乙醇、与水比例为1∶5、反应温度为60℃、反应1h、催化剂用量分别为3.6×10-3mmol和4.8×10-3mmol,催化剂重复三次产物收率仍可保持在90%以上。
磁性水滑石;负载;纳米钯;Suzuki偶联反应
前言
Suzuki偶联反应广泛应用于合成联苯类化合物,具有操作简单、对水不敏感、有较好的立体选择性和区域选择性等优点[1~4]。传统的均相催化剂带来诸如成本高、配体不稳定、回收困难等问题,采用非均相催化剂可以有效的解决这些问题。常用的非均相无配体催化剂的载体可以分为碳材料[5]、高分子聚合物[6]、金属氧化物[7]及其他类无机材料[8~9]。
近年来,磁性材料负载催化剂引起了人们的广泛关注[10]。相对于其他物理或化学分离方法,如过滤、离心、萃取和色谱法,磁性材料负载催化剂只需要一个外加磁场就可以有效方便地实现同反应体系的分离,是一种更绿色环保的分离方法。
本文以Fe3O4为磁性基质,Na2PdCl4为钯源,制备了磁性的水滑石负载纳米钯催化剂。通过XRD、ICP-AES、TG、氢气脉冲吸附等分析方法对其结构进行了表征,考察了碱、溶剂等因素对磁性催化剂催化Suzuki反应的影响,筛选及溴代芳烃与苯硼酸的Suzuki反应的最佳反应条件。
1 实验部分
1.1 磁性水滑石负载纳米钯催化剂的制备
首先制备磁性基质Fe3O4[11],氮气保护下,将2.78g FeSO4·7H2O和4.73g FeCl3·6H2O溶解在300mL的蒸馏水中,加入到500mL的三口瓶中,整个体系加热到50℃,滴加20mL氢氧化胺水溶液并调节pH值,使pH≥10,调节温度加热到80℃,保温反应30min后冷却至室温,在外磁场的作用下,用蒸馏水洗涤至中性,再用30mL乙醇洗涤3次,倾去乙醇,在50℃下减压干燥5h,研磨即得顺磁性纳米Fe3O4。
按镁铝物质的量比为3称量11.43g MgCl2· 6H2O和4.53g AlCl3·6H2O配成50mL水溶液A,按C(NaOH)/[C(Mg2+)+C(A13+)]=2.25,C(Na2CO3)/[C (Mg2+)+C(A13+)]=0.67分别称量约6.75gNaOH和5.3g无水Na2CO3,配成50mL溶液B。按Mg/Fe(Ⅱ)物质的量比为15取磁性Fe(Ⅱ)/Fe(Ⅲ)氢氧化物凝胶加到250mL的三颈烧瓶中,再加入100mL蒸馏水,剧烈搅拌,控制温度为65℃。将溶液A和溶液B同时滴加到烧瓶中,滴完后,pH值为12~13,继续搅拌,保温陈化18h,过滤,反复水洗至中性,产物于80℃下干燥12h,得到磁性水滑石(磁性LDH)。
称取两份上述干燥后的磁性LDH 3.5g,分别加入到10 mL、0.01 M的氯钯酸钠(Na2PdCl4)溶液中。一份样品60℃搅拌25h,使之充分混合;另一份样品采用滴加吸附的方式负载,滴加完成后再搅拌16h,再分别用水和丙酮洗数次,再分别以30mL乙二醇溶液还原Pd2+,依次再以水、丙酮洗涤后并干燥,得到两份棕黄色固体,分别记为磁性LDH-Pd1和磁性LDH-Pd2。
1.2 催化剂的表征
X射线衍射分析(XRD)采用德国BRUKER公司生产的D8型ADVANCE X射线衍射仪,Cu靶,管电压40kV,电流40mA,扫描区间10~80°(2θ);X射线光电子能谱(XPS)在Thermo Electron公司的光电子能谱仪上进行,X射线源为Al kα(1.5eV)射线,真空度为10-7Pa,高分辨扫描谱通过能为100eV,扫描步长为1.0eV;样品的TG测试是在Perkin Elmer model Diamond TG/DTA/DTG热分析仪上进行的,氮气氛围,升温速率为10℃/min,温度区间为100~600℃。
1.3 催化剂催化性能的评价
通过催化Suzuki偶联反应来评价催化剂的催化性能:空气气氛下,将1mmol芳基卤化物溶解于12mL有机溶剂中,移入三口瓶中,然后加入相当于底物2倍物质的量的碱,体系加热到一定温度再加入一定量的催化剂,搅拌2~3min,再加入1.5mmol的苯硼酸,通过此反应考察此催化剂的最佳反应条件:碱、溶剂、溶剂与水比例、温度、时间、催化剂用量,并评定催化剂的反应活性。
2 结果与讨论
2.1 磁性LDH-Pd的表征
用ICP-AES测得固载催化剂磁性LDH-Pd1的钯含量为1.783×10-4mol/g,磁性LDH-Pd2的钯含量为2.362×10-4mol/g。利用氢气脉冲吸附测得磁性LDH-Pd1的钯分散度为19.28%,磁性LDH-Pd2的钯分散度为20.36%。
图1~3分别为制备的两磁性催化剂的XRD谱图、红外谱图以及热重曲线。由图1可知,样品b、c和d都在11°,23°和34°附近出现了三个较强的衍射峰,这分别对应于水滑石层状结构(003),(006)和(009)晶面的特征衍射峰,峰形窄而尖;同时,样品b、c和d也在36°附近出现了一个较强的衍射峰,这是磁性基质Fe3O4的特征衍射峰,说明水滑石包覆磁性基质后不但没有影响水滑石的表面结构并且成功使水滑石赋予了磁性;样品在60°附近出现了明显的表征层状结构的双峰,说明两磁性催化剂均呈现出层状水滑石的结构,并且具有良好的结晶度。对比曲线b、c和曲线b、d发现,在40°附近的峰变宽,这是由于出现了钯的特征衍射峰的缘故,由此证明钯成功负载到层状的水滑石上。
由图2可知,样品b、c和d的特征衍射峰基本一致,每条光谱在波数640cm-1处均出现了Fe-O的特征吸收峰,说明载体与催化剂都被成功赋予了磁性;磁性的水滑石与负载钯后的磁性水滑石都在波数3500cm-1处出现的吸收峰为-OH的特征吸收峰,说明水滑石是碱性载体,表面覆盖着羟基,负载过渡金属钯后羟基仍然存在,间接说明磁性的催化剂是碱性催化剂。
由图3可知,磁性基质没有失重峰,保持热稳定的状态,由水滑石包覆的磁性基质在50~350℃有一个较大失重峰,两个磁性催化剂在50~400℃有很大的失重峰,在低温下开始失重是一个失水过程,因为水滑石属于结晶水复合物,在低温下加热容易失水;两磁性载体负载钯之后,其热解区间向后移,这可能是由于空间效应使钯原子变活泼,发生热解的缘故。
2.2 磁性LDH-Pd催化Suzuki偶联反应

图1 XRD谱图(A)a:Fe3O4b:磁性LDH c:磁性LDH-Pd1(B)d:磁性LDH-Pd2Fig.1XRD patterns of(A)a:Fe3O4,b:Fe3O4-LDH,c:Fe3O4-LDH-Pd1and(B)d:Fe3O4-LDH-Pd2
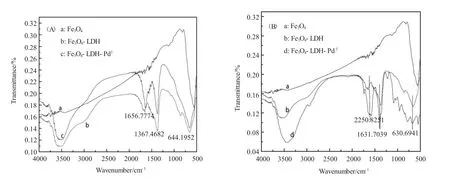
图2 FT-IR谱图(A)a:Fe3O4b:磁性LDH c:磁性LDH-Pd1(B)d:磁性LDH-Pd2Fig.2FT-IR spectra of(A)a:Fe3O4,b:Fe3O4-LDH,c:Fe3O4-LDH-Pd1and(B)d:Fe3O4-LDH-Pd2
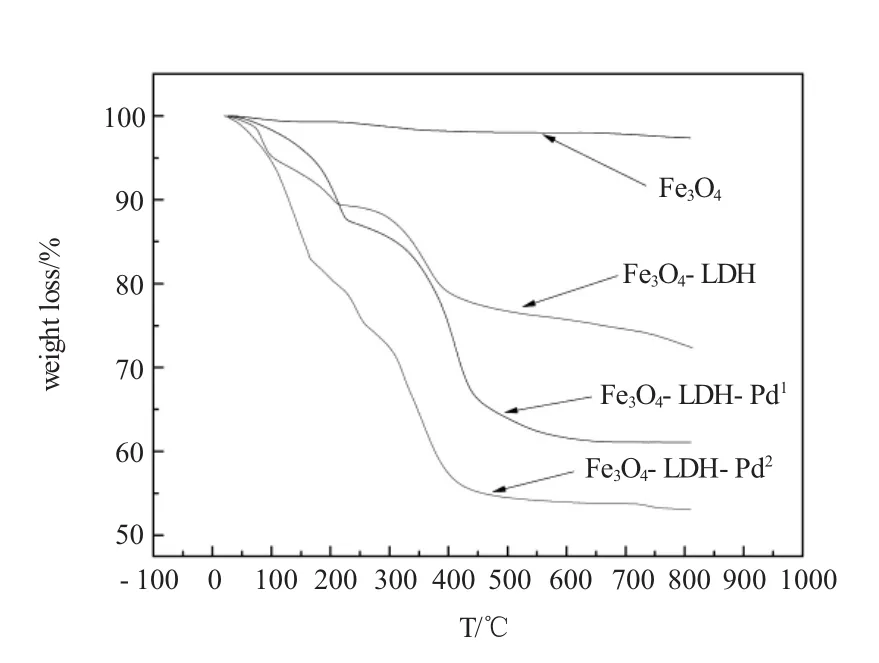
图3 Fe3O4、磁性LDH、磁性LDH-Pd1和磁性LDH-Pd2的失重率曲线Fig.3The thermal gravitycurve ofFe3O4,Fe3O4-LDH, Fe3O4-LDH-Pd1and Fe3O4-LDH-Pd2
通过催化Suzuki偶联反应来评价两磁性催化剂的催化活性,选取苯硼酸1.5mmol和对溴苯己酮1mmol为反应原料,在60℃下反应1h,在采用3.6× 10-3mmol Pd1和4.8×10-3mmol Pd2催化剂用量下,考察碱、溶剂、有机溶剂/水比等反应条件对反应结果的影响(分别见表1~4)。

表1 溶剂对Suzuki反应的影响Table 1Effect of solvents on Suzuki reaction
从表1可以看出,磁性催化剂在质子性溶剂中,如甲醇、乙醇中的催化效果较好。采用浸渍法制备的催化剂在较温和条件下催化Suzuki反应的产物收率分别达到了93.30%和76.43%;滴加吸附法制备的催化剂分别为94%和68.26%。在偶极性溶剂如DMAc、DMF和THF中的催化效果不太理想,在非极性溶剂甲苯中产物收率也不高,为此,选择乙醇为适宜溶剂。

表2 碱对Suzuki反应的影响Table 2Effect of bases on Suzuki reaction
由表2可知,K2CO3、K3PO4·3H2O、KOH等多数钾盐对该催化体系具有较好的促进作用,可能是因为钾离子的半径较大,有较好的溶解性,容易产生亲核性更强的阴离子,加快转移金属化历程的进行,K2CO3对反应的促进作用最强,因此选其为最优碱。
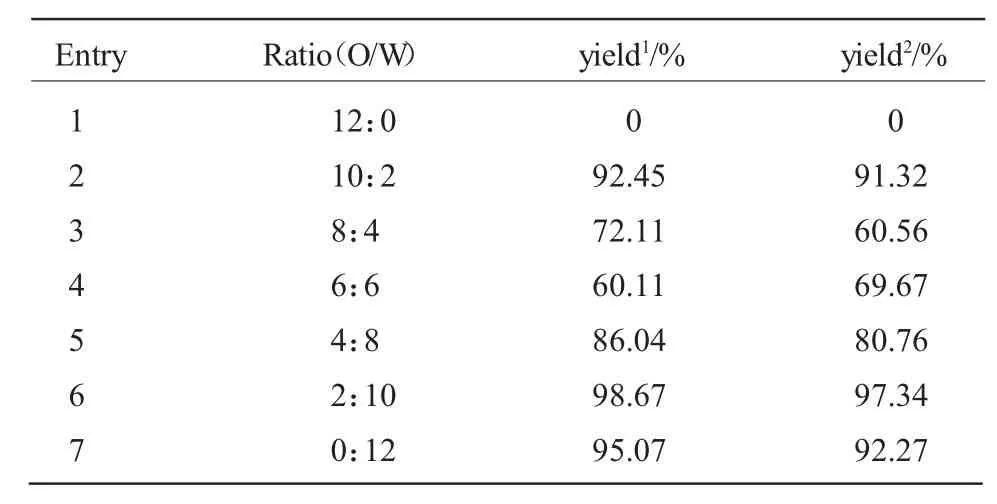
表3 有机溶剂/水比对Suzuki反应的影响Table3EffectofratiooforganicsolventstoH2OonSuzukireaction
由表3可知,在油与水比例为5/1和1/5时,两催化剂对Suzuki偶联反应的收率都很高,催化剂1的收率分别为92.45%和98.67%,催化剂2的收率分别为91.32%和97.34%,水是环保型的绿色能源,所以选油水比为1/5为最适宜条件。
为评价制备的两种磁性催化剂的重复使用性,选取对溴苯己酮(1mmol)和苯硼酸(1.5mmol)为原料,碳酸钾(2mmol)为碱,12mL乙醇/水(体积比1/5)为溶剂,控制反应时间为1h,反应温度为60℃,催化剂用量分别为3.6×10-3mmol Pd1和4.8×10-3mmol Pd2,进行了重复性实验,结果见表4。
由表4可知,磁性催化剂1在前三次均保持较好的反应收率,从第四次开始收率明显下降,而催化剂2在前四次都保持很高的收率,在重复5次后收率明显下降,这可能是由于负载方法不一样,金属钯原子在载体表面分布形态不一样的缘故。

表4 催化剂的重复使用Table 4Reuse of catalyst

表5 催化剂催化不同底物的Suzuki反应Table 5 The Suzuki reaction of different substrates catalyzed by catalyst
测试了在最优条件下两磁性催化剂催化不同溴代芳烃与苯硼酸的Suzuki反应,其结果如表5所示,在温和的反应条件下,两磁性催化剂对多种溴代芳烃和苯硼酸的Suzuki反应都有很高的催化活性。对含有吸电子基团的溴代芳烃,如4-溴苯腈,两催化剂收率分别达到了96.7%和95.82%,。对较不活泼的含供电子基团的溴代芳烃,如4-溴甲苯,两催化剂目标产物收率都大于98%。这说明不同负载方法制备的磁性催化剂都具有很高的催化活性。
3 结论
本文通过化学沉淀法制备了磁性的水滑石,再利用不同负载方法制备了两种磁性催化剂。两磁性催化剂的钯含量分别为1.783×10-4mol/g和2.362× 10-4mol/g,分散度分别为19.28%和20.36%。通过催化对溴苯己酮和苯硼酸的Suzuki偶联反应,说明两磁性催化剂均具有很高的催化活性,两种催化剂的最优反应条件均为:溶剂为乙醇的混合溶液,碳酸钾为碱,反应温度为60℃,反应时间为1h,催化剂用量分别为3.6×10-3mmol Pd1和4.8×10-3mmol Pd2。
[1]MIYAURA N,SUZUKI A.Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds[J].Chem.Rev,1995,95 (7):2457~2483.
[2]OSCAR N,ROY A KELLY.A General Method for the Suzuki-Miyaura Cross-Coupling of Sterically Hindered Aryl Chlorides: Synthesis of Di-and Tri-ortho-substituted Biaryls in 2-Propanol at Room Temperature[J].J.Am.Chem.Soc,2003,125(52):16194~16195.
[3]ADAM F,GREGORY C FU.Palladium-Catalyzed Coupling Reactions of Aryl Chlorides[J].Angew.Chem.Int.Ed.,2002,41(22): 4176~4211.
[4]SUZUKI A.Organoboron compounds in new synthetic reactions[J].Pure Appl Chem.1985,57(12):1749~1758.
[5]ANTONIO A,GIORGIO C,MARCO C,et al.A Mild and Versatile Method for Palladium-Catalyzed Cross-Coupling of Aryl Halides in Water and Surfactants[J].Eur.J.Org.Chem,2003,20:4080~4086.
[6]CHO J K,NAJMAN R,DEAN T W,et al.In Situ Generation of Palladium Nanoparticles:A Simple and Highly Active Protocol for Oxygen-Promoted Ligand-Free Suzuki Coupling Reaction of Aryl Chlorides[J].Am.Ceram.Soc.Bull,2007,9(20):4005~4007.
[7]ANDRZEJ G,JO′ZEF J.Palladium nanoparticles supported on alumina-based oxides as heterogeneous catalysts of the Suzuki-Miyaura reaction[J].Journal of Catalysis,2008,254:121~130.
[8]JOSE′R RUIZ,CESAR A.Palladium supported on hydrotalcite as a catalyst for the Suzuki cross-coupling reaction[J].Tetrahedron,2006,62:2922~2926.
[9]MOHAMMAD B,ALI K,BAHRAM B,et al.Coupling Reaction of Acid Chlorides with Terminal Alkynes Catalyzed by Diatomite-Supported Palladium(II)Salophen Complex[J].Laser Chem,2011,8:364~367.
[10]POLSHETTIWAR V,LUQUE R.Magnetically recoverable nanocatalysts[J].Chemical Reviews,2011,1(5):3021~3666.
[11]秦润华,姜炜,刘宏英,等,Fe3O4纳米粒子的制备与超顺磁性[J].材料导报,2007,38(6):902~903.
Preparation of Magnetic Hydrotalcite Supported Nanopalladium Catalyst and Its research on Suzuki Coupling Reaction
FAN Yan-xia,SHAN Wen-yan,ZHANG Zhi and BAI Xue-feng
(Institute of Petrochemistry,Heilongjiang Academy of Sciences,Harbin 150040,China)
The magnetic hydrotalcite has been prepared by chemical co-precipitation method.Then two kinds of catalysts of magnetic hydrotalcite supported nanopalladium are synthesized by impregnation and adding adsorption method.The crystal structure,morphology and metal dispersity of above-prepared catalysts are characterized by X-ray diffraction(XRD),inductively coupled plasma-atomic emission spectrometry(ICPAES),thermo-gravimetry(TG),and hydrogen pulse adsorption.The influences of different bases,solvents,ratio of solvent to water,time,temperature and catalyst amount on the catalytic activity of magnetic hydrotalcite supported nanopalladium catalyst applied in Suzuki reaction are investigated. The results of Suzuki coupling reaction demonstrated that the structure of hydrotalcite is not changed after being magnetized and it retains high catalytic activity.The product yield of the Suzuki coupling reaction after the third recycled reaction can reach more than 90%when using ethanol/ H2O and K2CO3as the solvent and base and the adding amount of catalysts is 3.6×10-3mmol and 4.8×10-3mmol respectively within 1h at 60℃.
Magnetic hydrotalcite;supported;nanopalladium;Suzuki coupling reaction
TQ426.6
A
1001-0017(2013)04-0005-05
2013-03-15*基金项目:黑龙江省科学院科研基金项目
范艳霞(1987-),女,黑龙江哈尔滨人,在读硕士研究生,研究方向:工业催化剂。
**通信联系人:白雪峰,博士,研究员,主要从事工业催化方面研究,E-mail:bxuefeng@163.net。

